電解鋁廢渣提鋰方法研究
郝建堂,溫豐源,李 霞
(多氟多化工股份有限公司,河南焦作454001)
碳酸鋰作為鋰產業鏈的中樞,具有至關重要的地位,隨著新能源汽車進入黃金發展期,動力鋰電池行業呈爆發式增長,碳酸鋰的需求量也逐年遞增[1]。目前國內碳酸鋰生產主要有礦石提鋰和鹽湖提鋰兩種,受資源、技術、開采條件和經濟性等的影響,碳酸鋰產業化進程較為緩慢。在鋁電解生產中,為改善電解質性質,達到提高電流效率和降低能耗的目的,除了向電解質中添加氟化鋁或冰晶石,還將某種氟化物或氯化物等的鹽類添加到電解質中,常用的添加劑之一就是氟化鋰。含鋰氟化鹽目前在電解鋁行業使用效果良好,可有效降低電解質初晶溫度,減少氟排放,對電解鋁企業節能降耗起到促進作用[2]。含鋰氟化鹽的使用造成大量含鋰電解鋁廢渣產生,其含鋰質量分數為1%~2.7%(以Li+計)。2018年上半年中國電解鋁產量為1799萬t,按出渣量為1%計算,則上半年電解鋁廢渣量為17.99萬t,以含鋰電解鋁廢渣計,則折合鋰質量為1799~4857.3 t,這部分鋰資源同樣為“城市鋰礦”,如果得到合理回收利用,將有利于緩解新能源產業帶來的用鋰壓力。為此,多氟多化工股份有限公司對電解鋁廢渣進行了大量工藝研究。
1 實驗部分
1.1 實驗原料
電解鋁廢渣(成分見表1);濃H2SO4(工業級,質量分數為98%);碳酸鈉(工業級,質量分數為98%);生石灰(工業級,質量分數為98%);二氧化碳氣體(工業級,質量分數為99.9%)。

表1 實驗所用電解鋁廢渣成分分析 %
1.2 實驗原理
實驗以含鋰電解鋁廢渣和濃硫酸為原料,依次進行浸取、堿解、苛化、碳化等工藝,制備得到電池級碳酸鋰,同時,將HF氣體經水吸收后與堿解產生的濾液(鈉鹽)、苛化反應產生的濾渣(鋁鹽)反應制備冰晶石,涉及的化學反應方程式如下:

1.3 實驗方法及工藝流程
將含鋰電解鋁廢渣與濃硫酸在200~400℃條件下反應2 h,加水浸取后過濾,得到硫酸鹽的混合濾液A和濾渣A。在濾液A中加入碳酸鈉,在40℃條件下進行堿解反應,過濾得到硫酸鈉濾液B和粗碳酸鋰與氫氧化鋁的混合濾渣B,濾渣B加水制成料漿,再加入石灰進行苛化反應,得到氫氧化鋰濾液C和氫氧化鋁濾渣C。濾液C中通入CO2進行碳化反應,過濾、洗滌、干燥,即得碳酸鋰。反應過程中產生的HF氣體經水吸收得到質量分數不低于40%的氫氟酸溶液,與硫酸鈉濾液B和氫氧化鋁濾渣C混合進行反應,制得冰晶石料漿,經過濾、洗滌、干燥后,得到冰晶石產品。該工藝流程如圖1所示。
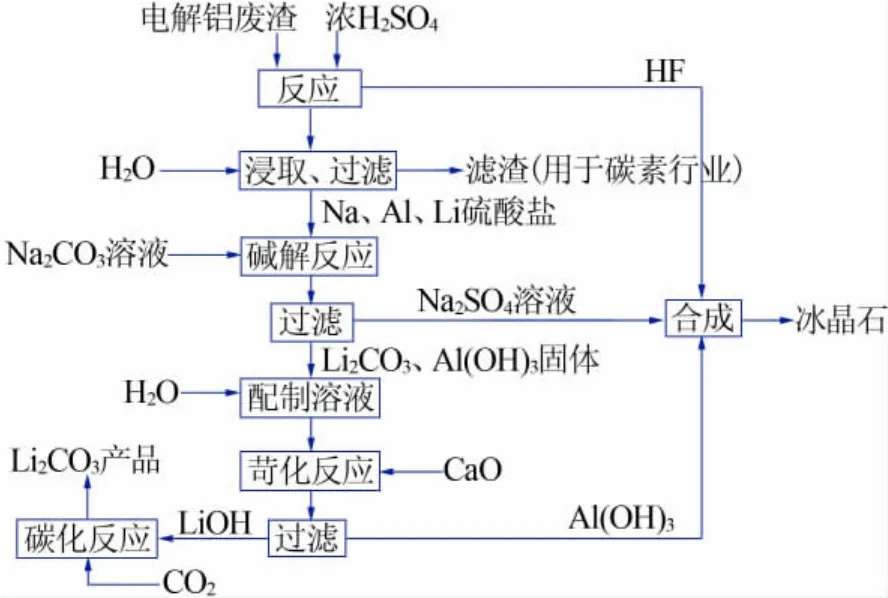
圖1 電解鋁廢渣提鋰并副產冰晶石工藝流程圖
2 實驗過程關鍵點控制
2.1 浸取過程溶液質量的控制
將含鋰電解鋁廢渣與濃硫酸在高溫條件下反應,當生成的HF完全溢出,反應逐漸停止,稱取反應渣量,加水開始浸取,此時加入的水量影響溶液中鋰的濃度,從而影響鋰的浸取率。實驗數據如表2所示。從表2可以看出,隨著溶液中鋰濃度升高,浸取率逐漸提升,但鋰濃度達到一定值后浸取率反而下降,實驗發現,當浸取水量較大時,酸濃度較低,鋰的溶出率相應較低;而當浸取水量減少時,溶液中的鈉、鋰濃度均升高,過濾過程中,溫度下降,帶結晶水的硫酸鈉會有部分析出,從而夾裹了部分的鋰,造成鋰的浸取率降低。因此,當溶液中鋰質量濃度達到2 g/L時,浸取率最高,可達到98.5%。

表2 不同鋰濃度下鋰浸取率的變化
2.2 堿解過程碳酸鈉的濃度控制
在硫酸鹽的溶液中加入碳酸鈉進行堿解反應,如果直接在溶液中加入固體碳酸鈉,無法確認生成的沉淀是否為碳酸鋰或是反應不完全的碳酸鈉與碳酸鋰的混合物,而碳酸鈉的濃度影響溶液脫鋁效果,結果見表3。由表3可知,控制碳酸鈉在溶液中的濃度為3 mol/L時,脫鋁效果最好,且鋰損失相對較少。實驗發現,隨著碳酸鈉在溶液中濃度的升高,溶液的堿性增強,生成的氫氧化鋁固體會溶解后進入溶液,從而帶走部分碳酸鋰,造成鋰損失。
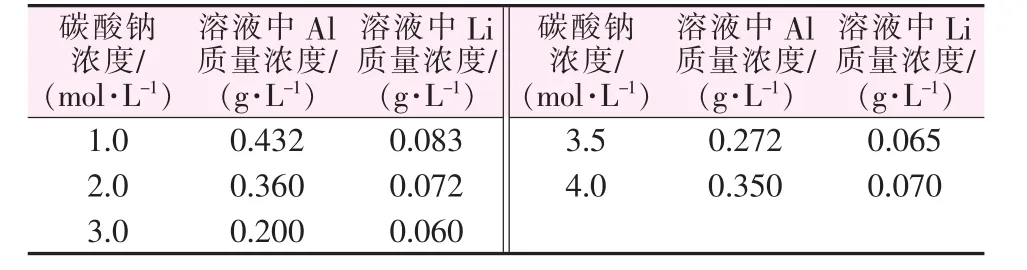
表3 不同碳酸鈉濃度下溶液中鋰、鋁濃度的變化
2.3 苛化過程活性氧化鈣的質量濃度控制
苛化過程加入氧化鈣,將不溶性的碳酸鋰轉化成氫氧化鋰溶液,而其他微量金屬離子以沉淀形式與氫氧化鋁一同被過濾。在此過程中,氧化鈣的加入量是過量的,這樣金屬離子可完全沉淀,但過量后碳酸鋰產品的鈣離子含量也會相對升高[3],通過實驗驗證,氧化鈣的加入量保持在與碳酸鋰完全反應后過量0.3倍,成品碳酸鋰中的鈣質量分數保持在2×10-5~3×10-5。
2.4 碳化過程反應終點的控制
苛化反應結束后過濾,氫氧化鋰溶液的pH約為14,將CO2氣體緩緩通入到氫氧化鋰溶液中,約30 min后,生成碳酸鋰沉淀,隨著反應的進行,溶液的pH逐漸降低,生成的碳酸鋰的量也在不斷變化,結果見表4。從表4數據看出,隨著CO2氣體不斷通入,碳酸鋰的量開始不斷增加,達到峰值后,繼續通入CO2氣體,碳酸鋰的量則逐漸減少,分析其原因為碳酸鋰本身會與CO2氣體發生發應,生成碳酸氫鋰溶液,碳酸鋰逐漸減少,使得碳酸鋰的收率降低,通過多組實驗驗證,發現當反應溶液的pH達到9~10時,生成碳酸鋰的收率最高,達到95%以上。
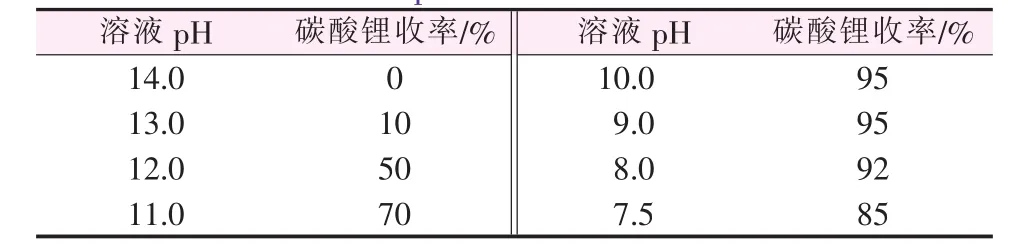
表4 不同pH下碳酸鋰收率的變化
3 工藝特點
1)本工藝所得電池級碳酸鋰中雜質離子含量低,產品質量優于行業標準YS/T 582—2013《電池級碳酸鋰》的要求,解決了目前礦石提鋰制備電池級碳酸鋰收率低、生產成本高、市場競爭力弱等問題。2)通過改進工藝,使用苛化加碳化除雜工序,避免使用昂貴的樹脂除雜工藝,簡化了工藝流程,降低了生產成本。3)鋰元素收率高,且制備過程中母液實現閉路循環,降低了生產成本,同時聯產冰晶石,將廢渣中的鋰、氟、鋁資源同時進行循環利用,解決了制約電解鋁行業發展的瓶頸。
4 產品質量
本實驗通過不斷優化工藝關鍵控制點及參數后制得的電池級碳酸鋰和冰晶石,無論從物化指標還是使用效果來看,質量均優于目前市售產品,完全可以滿足下游客戶需求。本工藝所得產品的性能指標如表5、表6所示,符合現行標準要求。
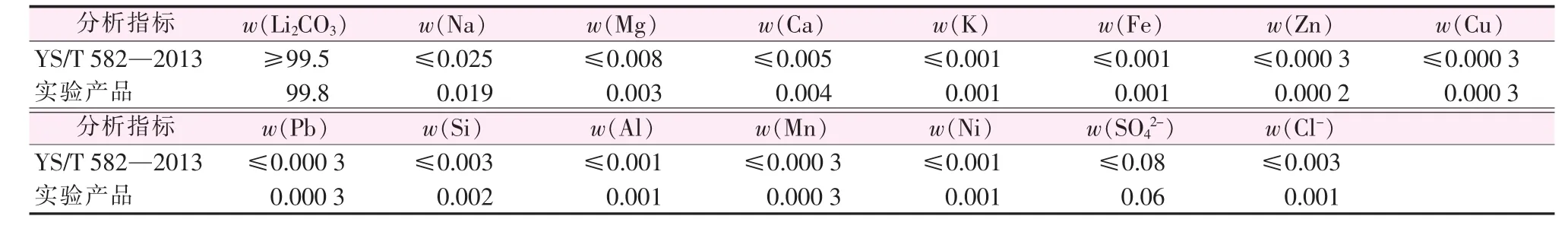
表5 實驗制備碳酸鋰產品指標及標準指標對比 %

表6 實驗制備冰晶石產品指標及標準指標對比 %
5 結論
本工藝以含鋰電解鋁廢渣和濃硫酸為原料,通過酸浸取、堿解、苛化、碳化等工藝,制備電池級碳酸鋰,同時副產冰晶石,將氟、鋰、鋁資源同時進行回收利用,大大提高了資源利用效率,屬于國家產業結構調整和產品結構升級的支持項目,其經濟效益、社會效益和環保效益顯著,值得大力推廣應用。

