IL-1β誘導椎間盤細胞凋亡通路再認識
韓敦富,尹荷珊,管晨彤,王 磐,張培國,王建秀
炎癥因子特別是白介素(interleukin,IL)-1β不僅抑制椎間盤細胞合成細胞外基質,而且誘導基質金屬蛋白酶分泌,導致細胞外基質減少[1-2]。研究發現,其對椎間盤細胞的凋亡作用不容忽視[3-6],它不僅能夠直接導致椎間盤細胞凋亡,且還可明顯提高椎間盤細胞對Fas Ligand介導的凋亡敏感性[4],促進椎間盤細胞凋亡。目前的研究認為,IL-1β通過線粒體損傷途徑誘發椎間盤細胞凋亡[5-7],膜受體途徑是否參加該過程尚不清楚。
本研究采用IL-1β刺激正常大鼠椎間盤髓核細胞,并分別檢測Fas/FasL凋亡途徑中的關鍵因子Fas,Caspase-8,9,3及Bid mRNA的表達水平,檢測Caspase-8,9,3的酶活性和線粒體膜電勢的改變,對椎間盤細胞凋亡途徑進行再探討。
1 材料與方法
1.1材料
1.1.1動物 3月齡SD大鼠共12只,雌雄不限,清潔級[中山大學動物實驗中心,合格證號SCXK(粵)2015-0623]。
1.1.2試劑及儀器 DMEM-F12培養基(批號:1501133,美國Gibco公司);特優級胎牛血清(批號:1407236,美國Hyclone公司);重組大鼠IL-1β(批號:1501268,美國R&D Systems公司);RT-PCR試劑盒(批號:1409225,日本TaKaRa公司);PCR引物(批號:1506167,中國上海生工生物工程公司);碘化丙啶、Annexin V-FITC(批號:1503157,奧地利Bender MedSystems公司);Caspase-8,9,3 CoLorimetric Activity Assay Kit(批號:1503218,加拿大Chemicon公司);線粒體膜電勢檢測試劑盒(批號:1501268,美國R&D Systems公司)。流式細胞儀(美國Beckman CouLter公司);酶標儀(WeLLscan MK3,芬蘭Thermo Labsystems公司)。
1.2方法
1.2.1大鼠椎間盤髓核細胞分離和培養 參照文獻[8]方法,10%水合氯醛麻醉SD大鼠,取出L3~L6椎間盤髓核組織,PBS緩沖液沖洗、切碎、轉移、胰蛋白酶消化、過濾、離心,以1×106mL-1密度在37 ℃、體積分數為0.05的CO2培養箱中培養,鑒定。
1.2.2細胞準備 原代細胞融合達85%~90%時,以3×105細胞/孔接種于6孔板中。10%FBS培養基,37 ℃、體積分數為0.05的CO2培養箱中培養至細胞融合達80%以上時,更換為1%FBS培養基,培養條件度不變,培養8 h。
1.2.3分組 建立A,B,C及D共4組:A組為空白對照組;B,C及D組分別加入10,20,50 ng/mL濃度的IL-1β后再培養24 h。
1.2.4檢測細胞凋亡 以上4組在培養24 h后更換為1%FBS培養基,倒置顯微鏡觀察細胞凋亡情況。胰酶消化收集細胞,PBS洗滌2次,離心收集全部細胞,EpicsALtra流式細胞儀分析細胞凋亡率。
1.2.5凋亡途徑相關因子檢測 細胞與IL-1β共培養24 h后,分別檢測Fas,Caspase-8,9,3及Bid mRNA的表達水平,檢測Caspase-8,9,3酶活性變化及線粒體膜電勢的改變情況。
1.2.5.1Fas,Caspase-8,9,3及Bid mRNA表達水平檢測 TRIzoL法提取總RNA,兩步法RT-PCR進行擴增(表1),收集PCR產物用于瓊脂糖凝膠電泳,凝膠成像系統進行拍照,圖像分析軟件進行光密度掃描分析。
表1Fas,Caspase,β-actin上下游引物序列、退火溫度及產物長度
Tab 1Primer sequence, annealing temperature and product length of Fas,Caspase,β-actin
1.2.5.2Caspase-8,9,3酶活性變化測定 酶活性檢測基于pNA標記底物的比色法,分別按照酶活試劑盒標準步驟進行。髓核細胞與IL-1β共培養24 h后,胰酶消化收集全部細胞,在酶標儀上405 nm波長讀出OD值和作出標準曲線,據此計算出Caspase-8,9,3酶活性變化情況。
1.2.5.3線粒體膜電勢改變情況檢測 胰酶消化收集全部細胞,按線粒體膜電勢試劑盒檢測標準步驟完成后,即刻在熒光顯微鏡下觀察拍照,立即用流式細胞儀分析線粒體電勢變化。
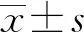
2 結 果
2.1不同濃度IL-1β對髓核細胞的凋亡作用 倒置顯微鏡觀察:髓核細胞和IL-1β共培養24 h后,隨著IL-1β濃度增加,發生形態改變的細胞也明顯增加,偽足回縮,細胞折光變化,有絮狀細胞器釋放,凋亡細胞漂浮增多(圖1)。流式細胞儀分析細胞凋亡結果與鏡下觀察結果一致。
2.2細胞Fas,Caspase-8,9,3及Bid mRNA的表達變化 RT-PCR檢測結果顯示:Fas,Caspase-9和Caspase-3 mRNA的表達與IL-1β濃度呈正相關,較大濃度的IL-1β(50 ng/mL)對髓核細胞Fas mRNA的上調作用更明顯;與之不同,10,20 ng/mL的IL-1β對Caspase-8及Bid mRNA影響無統計學意義,而50 ng/mL IL-1β則明顯上調Caspase-8及Bid mRNA的表達(圖2,3)。

A:空白對照組; B,C,D:10,20,50 ng/mL IL-1β組.

圖2 髓核細胞與不同濃度IL-1β共培養24 h Fas,Caspase-8,9,3及Bid mRNA表達變化情況
2.3Caspase-8,9,3酶活性檢測 Caspase-8,9,3酶活性檢測結果顯示:IL-1β可以明顯激活髓核細胞Caspase-9,3的酶活性,二者間酶活性存在一定的一致性,且具有較明顯的 IL-1β濃度相關性;10,20 ng/mL的IL-1β對Caspase-8酶活性影響不明顯,而50 ng/mL濃度的IL-1β則明顯激活Caspase-8酶活性(表2),該結果與RT-PCR結果一致。
2.4線粒體膜電勢檢測結果
2.4.1熒光顯微鏡下細胞線粒體膜電勢改變 熒光顯微鏡下,線粒體膜電勢發生改變的細胞胞漿呈現完全綠色,而健康細胞胞漿呈現紅色。隨著IL-1β濃度增加,呈現綠色的細胞明顯增多,綠色越深表明線粒體膜電勢變化越大(圖4)。

圖3 髓核細胞與不同濃度IL-1β共培養24 h Fas,Caspase-8,9,3及Bid mRNA表達變化比較
表2不同濃度IL-1β髓核細胞共培養24 h對各Caspase酶活性的影響
Tab 2Influence of co-culture of IL-1 beta myeloid cells at different concentrations for 24 h on the activity of Caspase enzymes

ρIL-1β/(ng·mL-1)酶活性Caspase-8Caspase-9Caspase-300.95±0.181.08±0.260.99±0.23100.95±0.152.05±0.22△2.29±0.24△201.34±0.234.22±0.30▲5.28±0.41▲503.28±0.47▲5.35±0.46▲7.34±0.58▲
Caspase:半胱氨酸蛋白酶. 與對照組比較,△:P<0.05,▲:P<0.01.
2.4.2流式細胞儀檢測線粒體膜電勢變化 右上象限為健康細胞,右下象限為線粒體膜電勢發生變化細胞。可見細胞線粒體膜電勢的改變隨IL-1β濃度升高而明顯升高,0,10,20,50 ng/mL的線粒體膜電勢分別為(0.52±0.08),(4.01±0.30),(8.19±1.13)及(16.61±1.33),差別具有統計學意義(P<0.05,圖5)。
3 討 論
椎間盤退變是一個復雜的過程。早有證據表明,椎間盤細胞的大量凋亡打斷了椎間盤內部自我平衡機制,加速了退變進程[7-10]。目前認為細胞凋亡主要有3條途徑,即死亡受體活化途徑(膜受體途徑)、線粒體損傷途徑和內質網應激途徑。3條途徑并非截然分開。Fas/FasL凋亡系統是椎間盤細胞凋亡的主要途徑,以Caspase-8激活為啟動標志的膜受體途徑和以Caspase-9激活為標志的線粒體損傷途徑是該系統中的兩條經典途徑[8-13]。然而,椎間盤細胞凋亡的確切途徑仍有不同研究結果[13]。Park等研究認為,椎間盤細胞的凋亡是通過膜受體途徑進行的[10-11,14]。Park等在研究體外培養的兔椎間盤纖維環細胞凋亡時發現,膜受體途徑中的Caspase-8,3被激活,而線粒體損傷途徑中的細胞色素C的水平沒有變化,并且阻斷Caspase-8能夠阻斷凋亡,而阻斷Caspase-9卻對凋亡沒有影響,因此認為線粒體損傷途徑并未參與椎間盤細胞凋亡過程[15]。Rannou的研究則與上述結果完全相反,他們發現不論人還是兔的退變椎間盤標本均未檢測到FasL陽性細胞,而檢測到細胞色素C的表達;在體外培養的兔椎間盤纖維環細胞凋亡中檢測到Caspase-9活性增強,而Caspase-8沒有變化;阻斷Caspase-9能夠減少細胞凋亡,而阻斷Caspase-8卻對凋亡沒有影響。因此,其認為線粒體損傷途徑是椎間盤細胞凋亡途徑,而膜受體途徑并未參與[16]。Heyde的研究則發現,膜受體途徑和線粒體損傷途徑都參與椎間盤細胞的凋亡[17]。通過FasL對大鼠椎間盤細胞凋亡作用的研究發現,這兩條經典途徑均參與了椎間盤細胞的凋亡[9]。

圖4 髓核細胞與不同濃度IL-1β共培養24 h熒光顯微鏡觀察細胞線粒體膜電勢的變化( ×100)
自Gronb等發現突出椎間盤組織中含有大量IL-1β等炎性因子表達以來,IL-1β對椎間盤細胞的凋亡作用越來越被重視[5-7]。研究認為,IL-1β可以直接通過線粒體途徑發揮細胞凋亡作用。Shen等研究發現,IL-1β 可以誘發人退變椎間盤髓核細胞的凋亡和細胞自噬,檢測到Bax和細胞色素C升高,導致線粒體損傷誘發人退變椎間盤髓核細胞的凋亡,用3-甲基腺嘌呤阻斷線粒體途徑可以減少細胞凋亡和自噬作用[7]。Niu等研究表明,高壓氧可以降低Caspase-3,9,而不是Caspase-8的活性,從而減少人退變椎間盤髓核細胞的凋亡[18]。Hu等研究證實,通過阻斷NF-κB信號通路和線粒體途徑可以減輕大鼠椎間盤纖維環細胞的炎癥反應和凋亡[6]。Yang等研究表明,IL-1β可以導致椎間盤纖維環細胞凋亡,同時Bax及Caspase-3,9表達升高[5]。以上研究均支持IL-1β通過線粒體損傷途徑誘發椎間盤細胞凋亡。然而,Park等研究認為,椎間盤細胞的凋亡僅通過膜受體途徑進行,線粒體損傷途徑并未參與這一過程[10,11,14-15]。

圖5 髓核細胞與不同濃度IL-1β共培養24 h流式細胞儀分析線粒體膜電勢變化情況
本研究結果表明,IL-1β所誘導的椎間盤細胞凋亡率和Caspase-9,3 mRNA的表達、酶活性以及線粒體膜電勢的改變均呈正相關關系,該結果與當前眾多研究一致,說明線粒體損傷途徑直接參與椎間盤細胞凋亡過程。本研究中,10,20 ng/mL的IL-1β對Caspase-8及Bid mRNA表達沒有明顯影響,而較高濃度(50 ng/mL)的IL-1β則明顯上調了髓核細胞Caspase-8及Bid mRNA的表達,與此對應的死亡受體Fas的表達也明顯上調,同時Caspase-8的活性也明顯增強。這一現象表明,當IL-1β達到一定濃度時,激活了以Caspase-8激活為啟動標志的膜受體途徑。因此,本研究結果說明,IL-1β主要通過線粒體損傷途徑誘導椎間盤細胞凋亡,高濃度時可以激活膜受體途徑。
細胞凋亡是一個復雜的過程,啟動凋亡因素的不同可能會導致凋亡途徑的差異,不同的凋亡途徑之間也會相互交叉相互影響。膜受體途徑和線粒體損傷途徑之間可以通過Bid作為橋梁產生交聯,Bid通過抑制線粒體外膜上Bcl-2的功能影響線粒體膜的通透性而導致線粒體中的細胞色素C逸出,細胞色素C在胞質中激活Caspases-9,從而引發Caspase蛋白家族的級聯反應,最終導致細胞凋亡。然而,Bid的功能發揮依賴于Caspase-8的激活,即在Fas/FasL凋亡系統中只能由Caspase-8通過激活Bid而激活線粒體損傷途徑,反之則不然。那么,IL-1β是通過何種機制激活了細胞膜受體途徑?筆者認為,這一作用極有可能是通過上調Fas的表達而進行的。以往研究結果顯示,IL-1β不僅能夠上調椎間盤細胞Fas的表達[8],而且可提高其對FasL的應答敏感性[4],從而產生超常凋亡。但是,對于IL-1β是如何上調Fas的表達還有待于進一步的研究。

