缺血后處理通過mdm2-p53負反饋通路減輕大鼠缺血再灌注損傷后的氧化應激反應
李曉倩,陳鳳收,張再莉,馬 虹
0 引言
脊髓缺血再灌注損傷(Spinal cord ischemia reperfusion injury,SCIRI)常見于術中需要短暫阻斷脊髓供應血管的手術,如胸腹主動脈瘤手術、脊柱成形手術等,一旦出現可引起不同程度的、難以逆轉的運動和感覺功能異常,可造成巨大的經濟和社會負擔[1]。SCIRI是多細胞交互聯系、多誘因、多種病理機制混雜的復雜的疾病過程[2]。隨著研究的深入,越來越多的研究發現,廣泛的氧化應激反應是SCIRI發生后多種繼發性病理損傷急劇發展的關鍵環節[3-4]。缺血后處理(Ischemic post-conditioning,IPC)是在損傷早期使用機械阻斷血流到目標區域的一種人為干預措施,在動物缺血模型中已證實具有良好的神經保護作用[5]。p53是一種最常見的應激傳感效應蛋白,既往針對IPC治療機制的研究中發現,IPC可以通過p53信號通路調控氧化應激反應[6-7]。而鼠雙微粒體蛋白2(Murine double-minute 2,mdm2)是p53信號通路中重要的調控因子,可以與p53構成降解-反式激活環路,從而恒定胞內mdm2/p53比值,維持正常的細胞功能和活性[7-8]。在脊髓神經元離體細胞實驗中,糖氧剝離可明顯下調mdm2水平,干擾兩者間的負反饋環路,使p53在核內累積,引起胞內脂質過氧化,激活氧化應激反應[6]。目前在SCIRI中,關于IPC能否通過p53-mdm2負反饋通路調節損傷脊髓中的氧化應激反應的研究甚少,深入研究有助于探求新的臨床治療靶點。故本研究以IPC干預SCIRI模型大鼠,通過觀察大鼠后肢運動功能、對脊髓組織中氧化應激代表性產物丙二醛(MDA)和超氧化物歧化酶(SOD)的檢測,探討IPC的作用機制,為臨床治療提供依據。
1 材料與方法
1.1 材料 兔抗p53多克隆抗體,兔抗mdm2單克隆抗體、GAPDH(武漢博士德);MDA測定試劑盒(南京建成生物工程研究)、SOD測定試劑盒(上海放射免疫技術有限公司);BCA蛋白質測定試劑盒、ECL化學發光試劑盒(碧云天科技有限公司);HIPAS-1000型圖像分析系統(武漢華海公司);EIx800型酶標儀(美國BIO-TEK公司)。
1.2 實驗動物、分組和模型制備 雄性SD大鼠,8~10周齡,體重(200±20)g,購自中國醫科大學動物中心。12 h晝夜節律喂養,實驗前后可自由進食水。采用隨機數碼表將60只大鼠分為假手術組(Sham組)、損傷組(IR組)和缺血后處理組(IPC組),每組20只。參照文獻制備模型和IPC治療[2]。簡要過程如下:麻醉后,將大鼠右側臥位,通過頸胸口切口暴露主動脈弓,直視下將動脈夾夾至左頸總動脈和左鎖骨下動脈之間,夾閉14 min誘導缺血,后撤除動脈夾誘導再灌注。Sham組僅暴露主動脈弓而不夾閉動脈夾。IPC組:在再灌注開始5 min后給予5個循環IPC(阻斷主動脈弓1 min/開放1 min為1個循環),其余步驟同IR組。所有大鼠均逐層縫合傷口,腹腔內注射氨芐青霉素30 mg(0.3 ml)預防感染。
1.3 神經功能評價 采用BBB評分測定脊髓神經功能恢復情況[3]。于術后12、24、36、48 h將大鼠放置于直徑為2米的圓形平臺上自由活動4 min,觀察記錄其后肢的行走及肢體活動,定量評價損傷后的運動功能。評分分為3個部分:第1部分(0~7分)評判大鼠后肢各關節活動情況;第2部分(8~13分)評判后肢的步態及前后肢協調功能,如是否可見爪掌面承重移動;第3部分(14~21分)評判運動中后肢后爪的精細動作,如是否可見持續性掌面移動、持續性爪抓地等。3項滿分為21分。
1.4 脊髓組織SOD和MDA含量測定 術后48 h,取L4-6節段脊髓組織,制成10%脊髓勻漿。低溫下以3 500 r/min的速度離心15 min,取上清進行組織蛋白定量。SOD采用黃嘌呤氧化酶法在532 nm波長下測定OD值;MDA采用硫代巴比妥酸法在550 nm波長下測定OD值。
1.5 Western blot測定大鼠脊髓組織中mdm2和p53蛋白表達 勻漿后測定蛋白質樣品的濃度。每泳道上樣50 μg后,使用10%十二烷基硫酸鈉聚丙烯酰胺凝膠電泳分離蛋白質。電泳后轉至PVDF膜上。5%脫脂奶粉室溫下封閉1 h后,將膜加入兔抗mdm2多克隆抗體(1∶500)、兔抗p53單克隆抗體(1∶500)于4 ℃過夜,洗膜后繼續二抗室溫下孵育90 min。使用ECL試劑盒和HIPAS-1000型圖像分析系統記錄化學發光結果,以與GAPDH的比值作為表達強度。
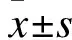
2 結果
2.1 各組大鼠損傷后脊髓神經運動功能評價 術后各觀察點Sham組大鼠后肢運動和反射能力均無明顯異常。與Sham組相比,術后各觀察點(尤以24 h為著),IR組大鼠BBB評分顯著降低,出現運動和反射能力下降(P<0.05),但隨著時間延長略有所恢復;與IR組相比,IPC組各觀察點的BBB評分明顯升高,運動和反射能力有所恢復(P<0.05)。見表1。
2.2 各組大鼠損傷后脊髓組織中MDA和SOD含量的比較 與Sham組相比,IR組和IPC組術后各觀察點脊髓組織中MDA含量均明顯升高,而SOD含量明顯降低,尤以術后24 h變化最為明顯(P<0.05);與IR組相比,IPC組各觀察點的MDA含量明顯降低,SOD含量明顯升高(P<0.05)。見表2、表3。

表1 SCIRI后48 h內大鼠后肢BBB評分的變化
注:*與Sham組比較,P<0.05;#與IR組比較,P<0.05

表2 SCIRI后48 h內大鼠脊髓組織中MDA含量的變化(nmol/mg)
注:*與Sham組比較,P<0.05;#與IR組比較,P<0.05

表3 SCIRI后48 h內大鼠脊髓組織中SOD含量的變化(nU/mg)
注:*與Sham組比較,P<0.05;#與IR組比較,P<0.05
2.3 各組大鼠損傷后脊髓組織中mdm2和p53蛋白含量的比較 Western blot結果顯示,損傷后各觀察點,與Sham組比較,IR組脊髓組織中mdm2蛋白含量明顯下降、p53蛋白含量均明顯升高(P<0.05);與IR組比較,IPC組脊髓組織中mdm2蛋白含量明顯升高、p53蛋白含量明顯下降(P<0.05)。上述變化在術后24 h變化最為顯著。見圖1。

圖1 SCIRI后48 h內大鼠脊髓組織中mdm2(A)和p53(B)含量的變化
3 討論
脊髓神經細胞對缺血、缺氧等因素非常敏感,短暫的SCIRI即可引起廣泛的神經損傷,出現難以逆轉的下肢運動和反射功能障礙。目前尚無有效的監測和預防手段,因此,損傷后有效的治療至關重要。但SCIRI發生和發展的機制復雜,是涵蓋多因素、多機制的綜合性病理過程,目前仍無有效的治療方法。IPC最早發現和應用于心肌損傷過程中,通過在損傷早期及時給予幾個短暫的缺血-再灌注循環,進而降低心肌耗氧量、改善心肌代謝,獲得了良好的治療作用[9]。近年來,隨著對IPC不斷的探索和了解,IPC已逐漸應用于肝、腎、腦等重要臟器中,有研究者提出在再灌注的早期給予IPC治療能獲得更好的效果[10],因此,本研究在再灌注開始5 min即給予IPC治療,結果證實5個循環的IPC能夠明顯提高BBB評分,明顯改善大鼠后肢運動和反射能力。
氧化應激反應是SCIRI進行性發展的關鍵環節[3-4],如何降低氧化應激反應是既往研究的熱點和靶點。Chen等[11]在大鼠大腦中動脈閉塞模型中,通過在再灌注后0、1、3 h分別給予肢體遠端缺血后處理,證實遠端缺血后處理在再灌注0 h可明顯減少NADPH氧化酶活化、降低髓過氧化物酶的含量、抑制氧化應激反應。此外,由于MDA是脂質過氧化反應的最終產物,而SOD也是自身產生的氧自由基清除劑和抗氧化酶,所以除髓過氧化物酶之外,MDA和SOD被認為是另兩種代表性監測氧化應激反應的指標[5]。本研究中在損傷后各觀察點均發現受損脊髓組織中MDA含量明顯升高,而SOD含量明顯降低,提示SCIRI后體內發生了進行性加重的氧化應激反應,自身產生的SOD已不足以完全清除過氧化反應的產物。而再灌注期早期(5 min)給予IPC治療明顯逆轉體內MDA和SOD含量,提示IPC可通過加強自由基清除作用,阻斷氧化應激反應。
此外,既往對IPC保護機制的研究發現,IPC還可以針對應激效應蛋白p53和其下游的信號通路發揮抗氧化應激作用[6-7]。mdm2是p53的靶基因,可與p53形成負反饋環路,因此也是p53信號通路中最重要的調控因子。研究發現,正常情況下,細胞內的mdm2/p53比值相對保持穩定,損傷后給予mdm2抑制劑(Nutlin-3)可顯著下調mdm2表達,從而阻斷p53泛素化降解、促進p53轉錄因子活性和p53介導的多種信號通路活化,最終導致機體發生氧化應激、炎癥等多種病理損傷[7,12]。目前,在離體細胞實驗中已證實糖氧剝離可干擾脊髓神經元內p53和mdm2平衡,促進p53在核內累積,引起神經元發生脂質過氧化反應[6]。針對負反饋環路,本研究也同樣發現IPC可通過增加mdm2的表達、抑制p53活性,改善大鼠后肢運動和反射功能。值得注意的是,mdm2是一種核蛋白,在癌細胞中給予Nutlin-3治療,也可明顯抑制p53-mdm2之間的相互作用,通過增強p53穩定和胞內聚集影響腫瘤的轉歸[13]。綜上所述,IPC可以通過激活p53負反饋通路,在SCIRI中發揮神經保護作用,然而這僅僅是眾多保護機制中的一個環節,探尋能夠針對多因素綜合干預的藥物或方法才能獲得理想的治療效果。

