環孢菌素A早期應用改善腦出血大鼠的神經細胞壞死
張海旺,陳禮剛,張 苓,王藝明,孫素影,張海霞,周長臣,鄭新安,李修龍,李 松
腦出血(intracerebral hemorrhage;ICH)是致殘率和致死率較高的卒中類疾病,發病后1 m內的病死率高達30%~50%,幸存者通常伴有嚴重的神經功能缺失等后遺癥,每年全球約有新發200萬ICH患者[1]。目前,國內外尚無有效治療措施,出血性腦損傷不僅是血腫本身的占位效應和血腫周圍組織直接破壞的原發性損傷,繼發性腦損傷也扮演著重要的角色。本研究探討環孢菌素A(Cyclosporin A;CsA)早期應用能夠改善ICH大鼠的神經功能缺陷,提高ICH大鼠的生活質量。
1 材料和方法
1.1 材料
1.1.1 實驗動物 SD雄性大鼠96只,體重260 g~280 g,實驗動物被隨機分為假手術組(Sham)、腦出血+溶劑組(ICH+Vehicle)、腦出血+CsA 5 mg組(ICH+CsA 5 mg)和腦出血+CsA 10 mg(ICH+CsA 10 mg)共4組,每組各24只。
1.1.2 實驗藥品及試劑 碘化丙啶染色(PI)細胞核熒光染料購自美國ABcam公司;伊文思藍購自上海國藥集團化學試劑公司;CsA購自美國安迪生物R&D Systems。
1.1.3 實驗儀器 腦立體定位儀(淮北正華生物儀器公司);透射電子顯微鏡Hitachi-7500(日本HITACHI公司);BX41型光學顯微鏡(日本Olympus公司)。
1.2 方法
1.2.1 動物模型的制備及給藥方式 采用動物腦立體定向自體血腦內注入法,SD雄性大鼠均經10%水合氯醛(4 ml/kg)經腹腔注射麻醉,動物俯臥固定于立體定位儀上,頭部備皮消毒后,正中矢狀切開,切口長約1.0 cm,充分暴露前囟,前囟右旁3.5 mm、前0.2 mm處用牙科鉆鉆一直徑約1 mm小孔,微量注射器抽取右股動脈血100 μl,沿孔道垂直進針5.5 mm后,注入100 μl自體血,縫合頭部后縫合右股部,回籠飼養,假手術組只進針不注血。腦出血+溶劑組、腦出血+CsA 5 mg組、腦出血+CsA 10 mg大鼠于術后15 min分別經尾靜脈注射生理鹽水、CsA 5 mg/kg、CsA 10 mg/kg,觀察時間超過24 h,每天給藥1次。
1.2.2 電鏡檢測 SD雄性大鼠術后24 h,10%水合氯醛經腹腔注射大鼠麻醉,打開胸腔暴露心臟,剪開右心房,左心室灌注150 ml生理鹽水,4%多聚甲醛和1%戊二醛350 ml~400 ml固定;快速將待檢部位的腦組織用鋒利潔凈的雙面刀片修切成大小1 mm3待檢組織塊;快速將待檢組織塊放入4%戊二醛固定液4℃固定2 h;0.1 mol/LPBS清洗3次;經1%四氧化鋨固定2 h;常規乙醇及丙酮梯度脫水;環氧樹脂浸透、包埋、聚合;制備0.5 μm厚度半薄切片光鏡定位后在制備60 nm厚度超薄切片;醋酸鈾和枸櫞酸鉛染色;行透射電子顯微鏡Hitachi-7500觀察神經元及線粒體情況。
1.2.3 腦水含量測定 術后24 h處死大鼠,迅速斷頭取腦,取血腫周圍腦組織于分析天平稱濕重,測重精確到0.1 mg。置烤箱于110 ℃下烘烤24 h取出,根據Elliott公式(%)=(濕重-干重)/濕重×100%。
1.2.4 血腦屏障通透性檢測 術后24 h時經股靜脈注入2%EB溶液(5 ml/kg)1 h后,打開胸腔暴露心臟,通過左心室灌注生理鹽水,剪開右心耳,直到右心耳流出的液體為清亮為止,迅速斷頭取腦,清洗腦表面雜質,濾紙吸干腦表面水分,取血腫周圍腦組織,稱濕重后置入PBS溶液中研磨,15000 r/min離心30 min,取1 ml上清,加入等體積三氯乙酸乙醇(1∶3)溶液,于4 ℃過夜孵育后,再于4 ℃下15000 r/min離心30 min,取上清液采用分光光度計測定吸光度,測定波長定為620 nm,計算EB的含量。
1.2.5 PI染色 術后24 h,動物麻醉后仰臥固定,取自體血與PI溶液2 μl混勻,快速注入心臟10 min,開胸暴露心臟,從左心室把尖端磨平的16號針頭插至主動脈根部,用絲線結扎,防止脫落,剪開右心耳放血。生理鹽水沖洗至流出液變澄清為止,再以4 ℃的4%多聚甲醛溶液灌注固定。當肢體變硬,肢端及尾部的震顫消失時終止灌注。將腦置于4 ℃上述固定液中避光固定24 h,取出放入30%蔗糖中避光脫水,冰凍切片,片厚10 μm,熒光顯微鏡下觀察。
1.2.6 行為學評分 術后72 h,采用Hua等[2]評分法進行神經功能評分,每只大鼠均進行前肢放置反射試驗(Forelimb Placing Score)、前肢使用不對稱試驗(Forelimb Use Asymmetry Score)、轉角試驗(Corner turn Score)等3項神經功能測評。分值越高代表神經功能損害越輕,反之損傷越重。
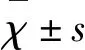
2 結 果
2.1 腦水腫觀察和腦水含量檢測 術后24 h電鏡觀察,ICH+Vehicle組血腫周圍腦組織線粒體腫脹較Sham組明顯,ICH+CsA 10 mg組血腫周圍組織線粒體腫脹較ICH+Vehicle組、ICH+CsA 5 mg組輕,ICH+CsA 5 mg組血腫周圍腦組織線粒體腫脹較ICH+Vehicle組輕(見圖1)。術后24 h腦水含量檢測,ICH+Vehicle組(79.32±0.17)血腫周圍腦組織腦水含量較Sham組(77.55±0.12)高(P<0.05),ICH+CsA 10 mg組(78.57±0.06)血腫周圍組織腦水含量顯著較ICH+Vehicle組、ICH+CsA 5 mg組(78.96±0.10)低(P<0.05),ICH+CsA 5 mg組血腫周圍腦組織腦水含量顯著較ICH+Vehicle組降低(P<0.05)(見圖2)。
2.2 血腦屏障通透性檢測 術后24 h,ICH+Vehicle組(5.53±0.26)血腫周圍腦組織血腦屏障破壞程度較Sham組(2.55±0.13)顯著增高(P<0.05),ICH+CsA 10 mg組(3.24±0.16)血腫周圍腦組織血腦屏障破壞程度較ICH+Vehicle組、ICH+CsA 5 mg組(4.12±0.12)顯著降低(P<0.05),ICH+CsA 5 mg組血腫周圍腦組織血腦屏障破壞程度較ICH+Vehicle組顯著降低(P<0.05)(見圖3)。
2.3 壞死細胞計數 術后72 h PI染色計數,ICH+CsA 10 mg組(69.33±11.31)血腫周圍組織壞死細胞數顯著較ICH+Vehicle組(399.00±12.43)、ICH+CsA 5 mg組(97.00±8.99)減少(P<0.05)(見圖4)。
2.4 神經功能評分 術后72 h 3項神經功能測評方法的結果均提示:假手術組較ICH+Vehicle、ICH+CsA 5 mg、ICH+CsA 10 mg神經功能評分顯著增高(P<0.05),ICH+Vehicle較ICH+CsA 5 mg、ICH+CsA 10 mg神經功能評分顯著降低(P<0.05)(見圖5)。

圖1 術后24 h電鏡掃描,A:Sham組;B:ICH+Vehicle組;C:ICH+CsA 5 mg組;D:ICH+CsA 10 mg組

圖2 術后24 h腦水含量變化示意圖,ICH+Vehicle組顯著較對照組高,藥物處理組顯著較ICH+Vehicle組低。#號代表兩組比較有統計學意義(P<0.05)

圖3 術后24 h伊文思藍變化示意圖,ICH+Vehicle組顯著較Sham組差,藥物處理組顯著較ICH+Vehicle組佳。#號代表兩組比較有統計學意義(P<0.05)


圖4 術后72 h PI染色示意圖及結果示意圖,A:Sham組;B:ICH+Vehicle組;C:ICH+CsA 5 mg組;D:ICH+CsA 10 mg組;A、B、C、D黑色箭頭指示壞死細胞。藥物處理組顯著較ICH+Vehicle組壞死細胞少。**號代表兩組比較有統計學意義(P<0.05)
3 討 論
本實驗研究發現,在大鼠腦出血早期,血腫周圍腦組織含水量顯著增加、血腦屏障顯著破壞、壞死細胞顯著增多,導致大鼠神經功能評分顯著降低;而在腦出血后CsA早期應用能夠降低腦組織含水量、改善血腦屏障通透性、抑制細胞壞死、從而改善大鼠的神經功能評分。這些結果表明,CsA早期應用能夠減輕血腫周圍腦組織的受損程度,改善大鼠腦出血后的生活質量。
在大鼠腦出血實驗中,細胞壞死在早期腦損傷的發病機制中發揮關鍵作用[3]。腦損傷早期壞死會涉及腦細胞(神經元、星形膠質細胞、少突膠質細胞)和腦血管(平滑肌細胞、內皮細胞)的改變[4]。本實驗在腦出血早期血腫周圍腦組織中觀察到細胞壞死的現象(見圖4),PI染色發現腦出血+溶劑組血腫周邊細胞壞死細胞顯著增加,CsA早期應用后能夠顯著減少壞死細胞數,其中腦出血+CsA 10 mg組減輕效應較腦出血+CsA 5 mg組更明顯,表明細胞壞死與早期腦損傷有密切聯系。在神經系統疾病中。細胞壞死程度和腦水腫被視為腦出血預后不佳的兩個主要因素[5]。本實驗中腦出血+溶劑組術后24 h血腫周圍腦水腫明顯加重、腦組織含水量顯著增加、血腦屏障通透性顯著破壞[6]。而CsA早期應用能夠顯著減輕腦水腫、降低腦組織含水量、改善血腦屏障通透性,其中腦出血+CsA 10 mg組減輕腦水腫、降低腦組織含水量、改善血腦屏障破壞的作用均較腦出血+CsA 5 mg組更明顯(見圖2、圖3),即高劑量組能夠達到更佳的治療效果。

圖5 前肢放置反射試驗(F=18.92,P=0.00);前肢使用不對稱試驗(F=117.210,P=0.00);轉角試驗(F=116.960,P=0.00)
CsA通過結合細胞親環蛋白D(Cyclophilin D;CYPD)抑制線粒體膜通透性轉換孔(mitochondrial permeability transition pore,mPTP)的開放,阻止誘導凋亡因子核轉位而誘發染色質凝集、變性、壞死,進而導致神經元壞死。因此,這些級聯反應事件發生,腦實質和腦血管的壞死,最終導致細胞壞死[7]。本實驗電鏡觀察ICH后血腫周圍腦組織神經元中線粒體明顯腫脹(見圖1),CsA早期應用后,治療組線粒體腫脹程度顯著減弱,但高劑量組仍優于低劑量組,表明CsA可能還具有劑量依賴性的相關特性的特點[8]。
CsA作為線粒體靶向保護劑,不同于其他凋亡和壞死抑制劑,它能夠直接結合CypD。CypD是位于線粒體mPTP的一個重要的調節分子,可能是細胞壞死下游的一個靶點分子[9]。CsA通過結合CypD抑制mPTP開放,從而維持線粒體內穩態平衡,保護線粒體膜的完整性[10,11],抑制壞死相關蛋白釋放從而抑制細胞壞死,進而降低血腦屏障通透性,改善腦水腫和神經行為缺陷,達到神經保護作用。
本研究表明CsA早期應用能夠減輕實驗性腦出血大鼠腦水腫,改善血腦屏障通透性,抑制細胞壞死,改善神經功能評分。CsA對腦出血后早期腦損傷的神經保護作用,可能是CsA通過結合CypD抑制mPTP的開放,阻止神經細胞壞死。隨著對這一機制進一步深入的研究,相信對腦出血改善早期腦損傷帶來新的希望。

