miRNA-129-5p通過調控肝素結合生長因子對非小細胞肺癌細胞增殖和遷移能力的影響機制研究
滕樹炎,陳煥文
重慶醫科大學附屬第一醫院胸外科,重慶400060
肺癌是世界上發病率、病死率均最高的惡性腫瘤[1]。非小細胞肺癌(non-small cell lung cancer,NSCLC)包括鱗狀細胞肺癌、肺腺癌和大細胞肺癌,是肺癌的重要病理分型,占所有肺癌的80%~85%[2]。目前NSCLC的治療方法有手術、化療、放療、靶向治療和免疫治療等[3],但由于大多數NSCLC患者診斷時已處于中晚期,臨床治療效果不佳[4],因此對肺癌患者早期診斷及準確預測治療后病情變化就顯得尤為重要。miRNA是一段由18~22個堿基組成的非編碼單鏈RNA,在細胞增殖、凋亡、遷移、侵襲等生物學過程中發揮著重要的調控作用。miRNA在多種腫瘤中差異表達,在腫瘤的發生發展中充當致癌基因或抑癌基因,發揮重要的調控作用[5]。越來越多的研究證實,miRNA與NSCLC細胞的侵襲和轉移密切相關。有研究報道,miRNA-129-5p 在胃癌[6]、膠質母細胞瘤[7],食管鱗狀細胞癌[8]中表達下調,能夠發揮抑癌作用。近年來有研究發現miRNA-129-5p在NSCLC組織中亦表達下調[9],可影響NSCLC細胞的增殖和遷移能力。肝素結合生長因子(heparin binding growth factor,HDGF)是一種具有促分裂活性的肝素結合蛋白,在NSCLC組織中高表達,可影響細胞增殖和侵襲[10-11]、血管生成[12]等生物學過程,表明HDGF在肺癌的發生發展中發揮著重要作用。通過生物信息學分析預測發現HDGF可能是miRNA-129-5p的靶基因,但miRNA-129-5p是否靶向調控NSCLC中HDGF蛋白參與細胞的增殖和遷移過程仍不清楚。因此,本研究旨在研究miRNA-129-5p對NSCLC細胞的增殖和遷移的影響及其可能的分子機制。
1 材料與方法
1.1 組織與細胞
1.1.1 肺癌組織收集2018年3—7月重慶醫科大學附屬第一醫院手術切除并經病理檢查確診為NSCLC的3例NSCLC患者的腫瘤組織(直徑約為1cm)和對應的癌旁組織(距腫瘤外緣3cm外的肺組織)石蠟標本,3例患者均為男性,術前均未接受過放化療。
1.1.2 細胞正常支氣管上皮細胞株16-HBE和NSCLC細胞株A549、H460、H1299均購自美國模式菌種收集中心(American Type Culture Collection,ATCC)。所有細胞采用含10%胎牛血清的DMEM培養基于5%CO2、37℃恒溫培養箱中培養。
1.2 材料
HDGF干擾RNA(si-HDGF)和對照干擾RNA(si-NC)均由上海生物工程有限公司合成構建。DMEM培養基和胎牛血清均購自美國Invitrogen Gibco公司,CCK-8試劑和胰蛋白酶均購自美國Sigma-Aldrich公司,miRNeasy Mini Kit試劑盒、總RNA提取試劑盒和miRNA實時定量聚合酶鏈反應(quantitative real-time polymerase chain reaction,qRT-PCR)試劑盒均購自德國QIAGEN公司,miRNA-NC、miRNA-129-5p mimics均購自廣州銳博生物公司,Cell Lysis Buffer裂解液、結晶紫染色液、蛋白濃度測定試劑盒、蛋白抽提試劑盒及電化學發光(electrochemiluminescence,ECL)試劑盒均購自碧云天生物科技有限公司,HDGF抗體購自武漢博士德公司,pcDNA3.1空載體、HDGF過表達載體pcDNA3.1-HDGF、β-actin抗體、辣根過氧化酶標記的二抗和LipofectamineTM2000均購自賽默飛公司,逆轉錄試劑盒購自大連寶生物公司,熒光素酶報告基因檢測試劑盒購自美國Promega公司,Transwell小室購自美國BD公司。
1.3 實驗方法
1.3.1 qRT-PCR檢測miRNA-129-5p和HDGF表達采用總RNA提取試劑盒和miRNeasy Mini Kit試劑盒提取16-HBE、H460、A549和H1299細胞的總RNA和miRNA,參照對應的逆轉錄試劑盒說明書步驟合成cDNA,按qRT-PCR試劑盒的操作步驟分別檢測細胞中HDGF和miRNA-129-5p的表達情況。HDGF和U6引物來源于miRNA qRT-PCR試劑盒,HDGF-F:5'-ATCAACAGCCAACAAATACC-3',HDGF-R:5'-TTCTTATCACCGTCACCCT-3';βactin-F:5'-GGACCTGACTGACTACCTC-3',β-actin-R:5'-TACTCCTGCTTGCTGAT-3'。
1.3.2 細胞轉染待A549和H1299細胞生長至80%融合度,以適當密度接種至6孔細胞板中,隨機分為7組:control組(未轉染細胞)、miRNA-NC組(轉染miRNA-NC)、miRNA-129-5p mimics組(轉染miRNA-129-5p mimics)、si-NC組(轉染si-NC)、si-HDGF組(轉染si-HDGF)、miRNA-129-5p mimics+NC組(共轉染miRNA-129-5p mimics和pcDNA3.1)、miRNA-129-5p mimics+HDGF組(共轉染miRNA-129-5p mimics和pcDNA3.1-HDGF),按照LipofectamineTM2000轉染試劑使用說明進行轉染,轉染48 h后,qRT-PCR檢測轉染效果,蛋白質印跡法(Western blot)檢測HDGF的蛋白表達情況。
1.3.3 CCK-8法檢測細胞增殖能力將對數生長期的細胞以3×105/孔密度接種至96孔細胞板中,分別于12、24、36、48、60 h時取出細胞培養板,每孔加入20 μl的CCK-8溶液,采用酶標儀檢測各組細胞在490 nm波長下的吸光度值。實驗重復3次,取均值。
1.3.4 Transwell小室檢測細胞遷移能力取對數生長期的細胞加入無血清的培養基調整細胞濃度。以3×104/孔密度接種至Transwell上室中,下室中加入600 μl含10%胎牛血清的培養基,于培養箱內培養24 h后,小心擦去上室中的細胞,以磷酸鹽緩沖液(phosphate buffered saline,PBS)漂洗后,分別用甲醇和0.5%結晶紫對細胞進行固定、染色。倒置顯微鏡觀察A549和H1299細胞的遷移能力,隨機選5個視野計算遷移和侵襲細胞數。
1.3.5 雙熒光素酶報告基因實驗檢測miRNA-129-5p與HDGF基因的靶向關系生物信息學分析預測庫預測miRNA-129-5p與HDGF3'-UTR存在結合位點。參照轉染試劑說明書將構建好的野生型HDGF-3'-UTR-WT和突變型HDGF-3'-UTR-MUT的熒光素酶報告質粒及miRNA-NC、miRNA-129-5p mimics轉染至A549和H1299細胞6 h后,更換新鮮培養液并繼續培養至24 h,按照雙熒光素酶報告基因檢測試劑盒操作步驟檢測各組細胞的熒光素酶活性。實驗重復3次,取均值。
1.3.6 Westernblot檢測蛋白表達情況采用快速蛋白提取試劑盒提取3例NSCLC組織、對應癌旁組織及A549和H1299細胞的總蛋白,并參照二喹啉甲酸(bicinchoninic acid,BCA)蛋白檢測試劑盒檢測總蛋白的濃度。經沸水浴變性后,取20 μg變性蛋白上樣至12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecylsulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝膠孔中進行電泳。經80 V電壓電泳0.5 h后,換成120 V電壓電泳1 h。采用濕轉法將蛋白凝膠轉至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜后,置于含有5%去脂奶粉的封閉液中4℃下孵育過夜。以PBST洗膜后,再在4℃下將PVDF膜轉入1∶2000稀釋的一抗中反應過夜,經TBST洗膜后,加入1∶10 000稀釋的二抗于37℃下孵育1 h。于暗室內滴加化學發光劑顯影,以凝膠成像系統采集圖像,Image J分析目的條帶的灰度值,以β-actin為內參,以目的蛋白條帶灰度值與β-actin灰度值的比值表示目的蛋白的相對表達情況。
1.4 統計學方法
采用SPSS 20.0統計軟件進行數據分析,計量資料以均數±標準差(±s)表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析,以P<0.05為差異有統計學意義。
2 結果
2.1 NSCLC組織、癌旁組織及細胞中miRNA-129-5p表達水平的比較
NSCLC組織中miRNA-129-5p表達水平為(0.41±0.12),低于癌旁組織中的(1.17±0.33),差異有統計學意義(t=7.498,P<0.05)。miRNA-129-5p在16-HBE細胞中的表達水平為(0.97±0.08),A549細胞中為(0.37±.0.04),H1299細胞中為(0.39±0.03),H460細胞中為(0.68±0.06),與正常支氣管上皮細胞株16-HBE相比,細胞株A549、H1299和H460中miRNA-129-5p的表達水平均降低,差異均有統計學意義(t=23.238、23.516、10.046,P<0.05)。因A549和H1299細胞中miRNA-129-5p表達水平更低,故后續選取A549和H1299細胞進行研究。
2.2 過表達miRNA-129-5p對NSCLC細胞增殖和遷移能力的影響
2.2.1 miRNA-129-5p轉染效果將miRNA-129-5p mimics轉染至A549和H1299細胞中,qRT-PCR檢測結果顯示,A549及H1299細胞中,miRNA-129-5p mimics組細胞中miRNA-129-5p表達均高于control組及miRNA-NC組,轉染效果好。
2.2.2 CCK-8法檢測 A549和H1299細胞的增殖情況結果顯示,作用24、48 h后,與同時間miRNA-NC組相比,miRNA-129-5p mimics組細胞吸光度值均降低(P<0.05)。(表1)
2.2.3 Transwell小室檢測細胞遷移情況結果表明,A549及H1299細胞中,miRNA-129-5p mimics組細胞的遷移數目均少于control組及miRNA-NC組。(圖 1)
2.3 HDGF是miRNA-129-5p的靶基因
2.3.1 NSCLC組織及癌旁組織中HDGFmRNA及HDGF蛋白表達情況的比較NSCLC組織中HDGFmRNA及HDGF蛋白表達水平分別為(5.73±1.24)、(4.76±0.28),均明顯高于癌旁組織的(1.30±0.26)、(1.18±0.12),差異均有統計學意義(t=24.724、83.099,P<0.01)。
2.3.2 16-HBE、 A549、H1299細 胞中HDGFmRNA及HDGF蛋白表達情況的比較A549和H1299細胞中HDGFmRNA分別為(5.36±0.54)、(6.33±0.63),均明顯高于正常支氣管上皮細胞株16-HBE的(1.20±0.12),差異均有統計學意義(P<0.01)。A549和H1299細胞中HDGF蛋白表達量分別為(4.71±0.47)、(5.42±0.54),均明顯高于正常支氣管上皮細胞株16-HBE的(1.00±0.10),差異均有統計學意義(P<0.01)。
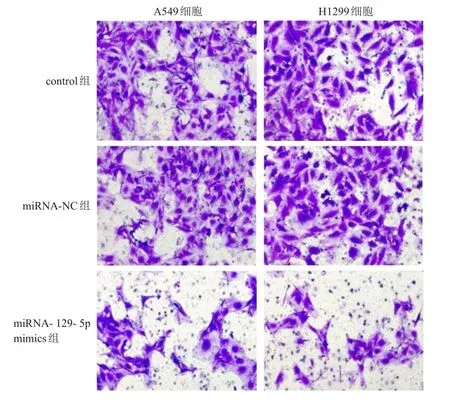
圖1 Transwell法檢測培養24h后control組、miRNA-NC組、miRNA-129-5p mimics組 A549和H1299細胞的遷移情況(結晶紫染色,×200)
2.3.3 雙熒光素酶報告基因實驗檢測雙熒光素酶活性結果顯示,miRNA-129-5p mimics組A549、H1299細胞的HDGF-3'UTR-WT熒光素酶活性均明顯低于miRNA-NC組,差異均有統計學意義(P<0.01),兩組 A549、H1299細胞HDGF-3'UTR-MUT熒光素酶活性比較,差異均無統計學意義(P>0.05)。(表 2)
2.3.4 HDGF蛋白表達水平的比較miRNA-129-5p mimics組A549、H1299細胞中HDGF蛋白表達水平分別為(0.61±0.13)、(0.54±0.15),均明顯低于miRNA-NC組的(1.35±0.12)、(1.26±0.23),差異均有統計學意義(P<0.01)。
2.4 沉默HDGF對NSCLC細胞增殖和遷移能力的影響
2.4.1 si-HDGF轉染效果Western blot檢測發現,與si-NC組相比,轉染了干擾RNA的si-HDGF組A549和H1299細胞,HDGF蛋白表達下調。(圖2)
表1 control組、miRNA-NC組、miRNA-129-5p mimics組 A549及 H1299細胞吸光度值的比較(±s)
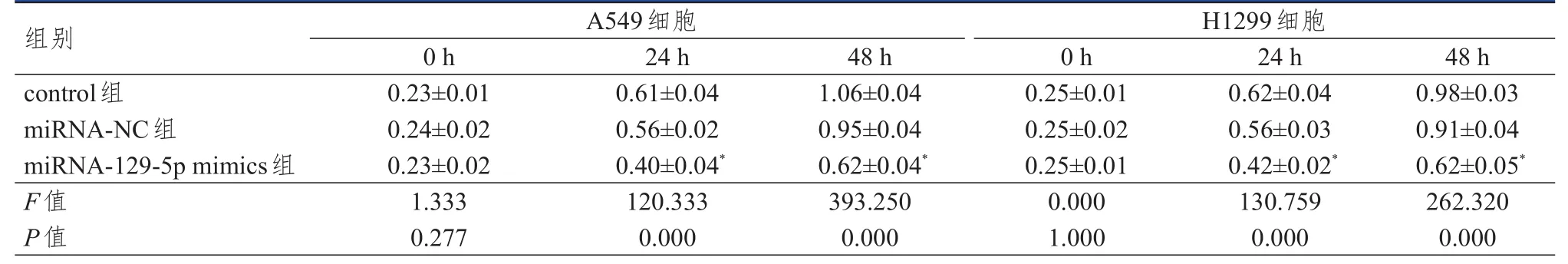
表1 control組、miRNA-NC組、miRNA-129-5p mimics組 A549及 H1299細胞吸光度值的比較(±s)
注:*與同時間miRNA-NC組比較,P<0.05
組別control組miRNA-NC組miRNA-129-5p mimics組F值P值0.23±0.01 0.24±0.02 0.23±0.02 1.333 0.277 0.61±0.04 0.56±0.02 0.40±0.04*120.333 0.000 1.06±0.04 0.95±0.04 0.62±0.04*393.250 0.000 0.25±0.01 0.25±0.02 0.25±0.01 0.000 1.000 0.62±0.04 0.56±0.03 0.42±0.02*130.759 0.000 0.98±0.03 0.91±0.04 0.62±0.05*262.320 0.000 A549細胞H1299細胞0 h 24 h 48 h 0 h 24 h 48 h
表2 miRNA-NC組、miRNA-129-5p mimics組 A549、 H1299細胞雙熒光素酶活性的比較(±s)

表2 miRNA-NC組、miRNA-129-5p mimics組 A549、 H1299細胞雙熒光素酶活性的比較(±s)
組別miRNA-NC組miRNA-129-5p mimics組t值P值0.99±0.04 0.41±0.03 34.800 0.000 1.00±0.06 1.01±0.07 0.325 0.749 0.99±0.07 0.37±0.03 24.423 0.000 1.00±0.04 1.02±0.05 0.937 0.363 A549細胞HDGF-3'UTR-WT HDGF-3'UTR-MUT H1299細胞HDGF-3'UTR-WT HDGF-3'UTR-MUT
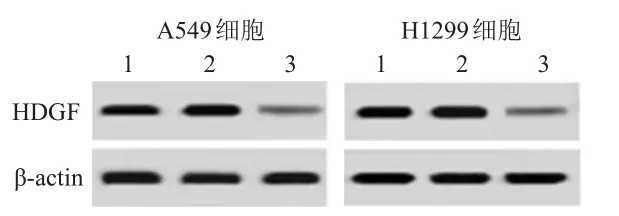
圖2 Western blot檢測control組、si-NC組、si-HDGF組A549、 H1299細胞中HDGF蛋白的表達情況
2.4.2 CCK-8法檢測 A549和H1299細胞的增殖情況結果顯示,作用24、48 h后,與同時間si-NC組相比,si-HDGF組細胞吸光度值均降低(P<0.05)。(表3)
2.4.3 Transwell小室檢測細胞遷移情況結果表明,A549及H1299細胞中,si-HDGF組細胞的遷移數目均少于control組及si-NC組。(圖3)

圖3 Transwell法檢測培養24h后control組、si-NC組、si-HDGF組 A549和 H1299細胞的遷移情況(結晶紫染色,×200)
2.5 miRNA-129-5p負調控HDGF對NSCLC細胞增殖和遷移能力的影響
2.5.1 CCK-8法檢測 A549和H1299細胞的增殖情況作用24、48 h后,與同時間miRNA-129-5p mimics+NC組相比,miRNA-129-5p mimics+HDGF組A549、H1299細胞的吸光度值均明顯增加,差異均有統計學意義(P<0.01)。(表4)
2.5.2 Transwell小室檢測細胞遷移情況用結晶紫對遷移細胞染色,結果發現,與miRNA-129-5p mimics+NC組相比,miRNA-129-5p mimics+HDGF組A549和H1299細胞的遷移顯著增加。(圖4)
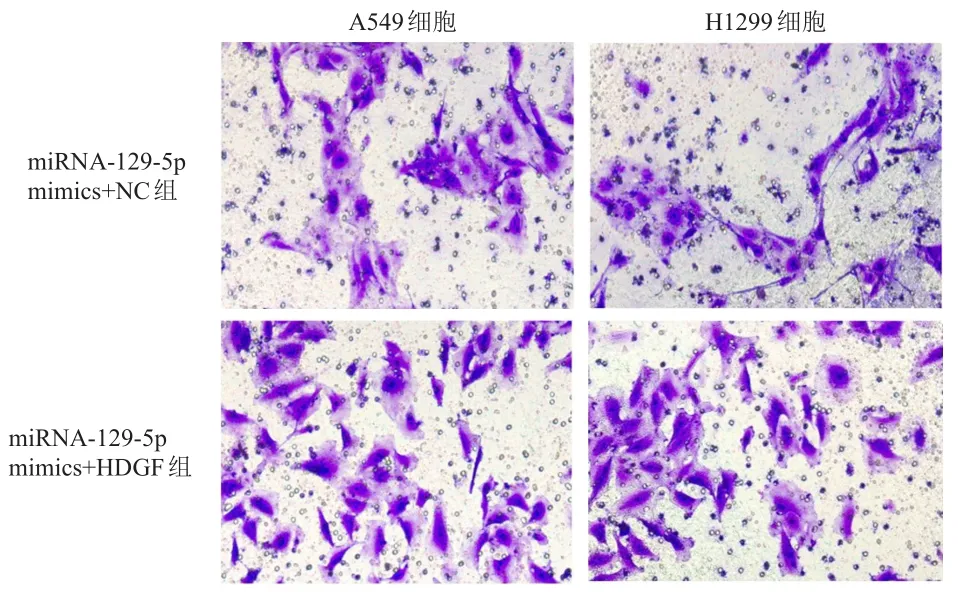
圖4 Transwell法檢測培養24h后miRNA-129-5p mimics+NC組與miRNA-129-5p mimics+HDGF 組 A549和H1299細胞的遷移情況(結晶紫染色,×200)
3 討論
研究表明,miRNA-129-5p在多種腫瘤中能夠發揮抗腫瘤作用,如Diao等[6]發現miRNA-129-5p能夠通過負調控轉化生長相互作用因子2(transformation growth interacting factors 2,TGIF2)的表達抑制膠質瘤細胞的增殖、遷移、侵襲與凋亡;Chen等[13]發現miRNA-129-5p通過溶質載體家族2,促進溶質載體家族2成員3(solute carrier family 2 member 3,SLC2A3)蛋白調節胃癌細胞的糖酵解和細胞增殖;Brest等[14]報道miRNA-129-5p在甲狀腺癌組織中表達降低;路璐等[15]發現miRNA-129-5p可明顯增強紫杉醇抑制乳腺癌MCF-7細胞增殖和誘導細胞凋亡的能力。此外,Ma等[16]發現miRNA-129-5p通過其靶基因delta類似非經典Notch配體1(delta like non-canonical Notch ligand 1,DLK1),抑制NSCLC細胞的耐藥性,并且通過靶向基質金屬蛋白酶 9(matrix metalloprotein 9,MMP9)、微球蛋白1(microspherule protein 1,MCRS1)等調控NSCLC的增殖和侵襲,表明miRNA-129-5p在NSCLC細胞中能夠發揮抑癌作用。本研究通過qRT-PCR檢測發現,3株NSCLC細胞株A549、H460和H1299中miRNA-129-5p均低表達,后續實驗選擇miRNA-129-5p低表達較為顯著的A549和H1299細胞作為研究對象,miRNA-129-5p mimics轉染上調miRNA-129-5p的表達,CCK-8和Transwell實驗檢測其對A549和H1299細胞的增殖和遷移能力的影響,結果發現,過表達miRNA-129-5p可以顯著抑制細胞增殖和遷移能力,提示miRNA-129-5p在NSCLC中能夠發揮抑癌作用。
表3 control組、si-NC組、si-HDGF組 A549、 H1299細胞吸光度值的比較(±s)
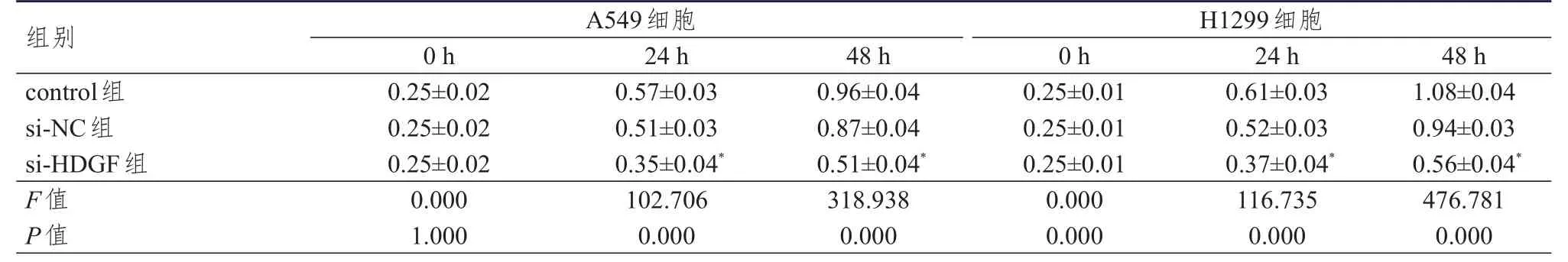
表3 control組、si-NC組、si-HDGF組 A549、 H1299細胞吸光度值的比較(±s)
注:*與同時間si-NC組比較,P<0.05
組別control組si-NC組si-HDGF組F值P值0.25±0.02 0.25±0.02 0.25±0.02 0.000 1.000 0.57±0.03 0.51±0.03 0.35±0.04*102.706 0.000 0.96±0.04 0.87±0.04 0.51±0.04*318.938 0.000 0.25±0.01 0.25±0.01 0.25±0.01 0.000 0.000 0.61±0.03 0.52±0.03 0.37±0.04*116.735 0.000 1.08±0.04 0.94±0.03 0.56±0.04*476.781 0.000 A549細胞H1299細胞0 h 24 h 48 h 0 h 24 h 48 h
表4 miRNA-129-5p mimics+NC 組與miRNA-129-5p mimics+HDGF 組 A549、 H1299細胞吸光度值的比較(±s)

表4 miRNA-129-5p mimics+NC 組與miRNA-129-5p mimics+HDGF 組 A549、 H1299細胞吸光度值的比較(±s)
組別miRNA-129-5p mimics+NC組miRNA-129-5p mimics+HDGF組t值P值0.25±0.03 0.24±0.03 0.707 0.490 0.40±0.06 0.53±0.05 4.993 0.000 0.67±0.03 0.99±0.05 16.464 0.000 0.25±0.03 0.26±0.03 0.707 0.490 0.36±0.05 0.47±0.03 5.3660 0.000 0.61±0.04 0.87±0.05 12.182 0.000 A549細胞H1299細胞0 h 24 h 48 h 0 h 24 h 48 h
有研究報道HDGF廣泛存在于多種正常組織及惡性腫瘤中,具有促進細胞增殖和新生血管生成的作用[17],與多種惡性腫瘤的生長、侵襲、轉移以及預后密切相關。先前有研究發現HDGF在NSCLC組織中高表達,miRNA-195[18]和miRNA-497[19]能夠靶向調控HDGF從而抑制肺癌細胞的增殖和遷移。但是關于miRNA-129-5p是否能夠通過調控HDGF從而進一步影響NSCLC細胞的增殖和遷移,目前仍不清楚。本研究通過靶基因預測軟件檢測發現miRNA-129-5p與HDGF3'-UTR存在互補的核苷酸序列,推測HDGF可能是miRNA-129-5p的潛在靶基因,miRNA-129-5p可能通過靶向HDGF參與NSCLC的發生發展。雙熒光素報告基因實驗證實了HDGF是miRNA-129-5p的靶基因,過表達miRNA-129-5p可以抑制HDGF的表達。沉默HDGF可以抑制NSCLC細胞A549和H1299的增殖和遷移能力,與過表達miRNA-129-5p結果一致,提示HDGF在NSCLC細胞A549和H1299的增殖和遷移過程中具有重要作用。此外,共轉染miRNA-129-5p mimics和pcDNA3.1-HDGF后發現,HDGF可部分逆轉miRNA-129-5p對NSCLC細胞A549和H1299增殖和遷移的抑制作用,提示miRNA-129-5p可以通過負調控HDGF表達參與其中,表明miRNA-129-5p能夠靶向調控HDGF的表達從而影響NSCLC細胞A549和H1299的增殖和遷移能力。
miRNA-129-5p在NSCLC中的作用已有報道[20],但是以miRNA-129-5p為NSCLC治療靶點的理論依據還不充足。miRNA-129-5p調控NSCLC的機制十分復雜,本研究發現miRNA-129-5p可通過下調HDGF的表達抑制NSCLC細胞A549和H1299的增殖和遷移,但其下游可能存在的信號通路仍需進一步研究。本實驗結果為NSCLC的診斷和治療提供了新的科學依據,后期將會繼續致力于miRNA-129-5p對NSCLC調控機制的研究。

