大鼠海馬CA1區-杏仁核大麻素受體信號通路對糖尿病大鼠攝食及胃運動的影響
閆菲 冷慧 王茜 孫向榮 郭菲菲 徐珞


【摘要】 目的:本實驗主要探究了大鼠海馬CA1區-杏仁核(BMA)大麻素受體信號通路對糖尿病大鼠攝食及胃運動的影響。方法:通過免疫組織化學染色方法確定大鼠海馬CA1區是否表達大麻素受體,以及海馬CA1區-BMA是否存在纖維投射;通過向大鼠海馬CA1區注射大麻素、大麻素受體拮抗劑利莫那班(Rimonabant)及GLP-1受體激動劑Exendix-4,測定大鼠0~4 h及4~8 h攝食量改變,以及對胃運動的影響;觀察大麻素及GLP-1受體激動劑Exendix-4對糖尿病大鼠胃牽張(GD)敏感神經元放電活動的影響。結果:免疫組織化學染色結果證實了海馬CA1區存在大麻素受體,且海馬CA1區-BMA之間存在纖維投射;通過向大鼠海馬CA1區注射大麻素、大麻素受體拮抗劑Rimonabant及GLP-1受體激動劑Exendix-4能夠減少食物攝入并抑制大鼠胃運動;海馬CA1區微量注射大麻素后,正常大鼠GD敏感神經元放電頻率顯著增加,該效應可被大麻素受體拮抗劑Rimonabant完全阻斷,Exendix-4可部分阻斷大麻素的促放電效應;與正常大鼠相比,海馬CA1區微量注射大麻素后糖尿病大鼠GD敏感神經元放電頻率均顯著增加(P<0.05);海馬CA1區微量注射大麻素后,大鼠胃運動幅度和頻率均顯著增加,但糖尿病大鼠胃運動增加更加顯著。結論:大鼠海馬CA1區存在大麻素受體,且海馬CA1區-BMA大麻素受體信號通路參與調節大鼠攝食及胃運動。
【關鍵詞】 海馬CA1區; 杏仁核; 大麻素受體; 攝食; 胃運動
doi:10.14033/j.cnki.cfmr.2019.23.001 文獻標識碼 A 文章編號 1674-6805(2019)23-000-06
【Abstract】 Objective:To explore the influence of cannabinoid receptor signaling pathway in rat hippocampal CA1 area-amygdala(BMA) on feeding and gastric motility in diabetic rats.Method:Immunohistochemical staining was used to observe whether the cannabinoid receptor was expressed in the hippocampal CA1 region and whether there was fiber projection from the hippocampal CA1 region to the BMA.The cannabinoid,cannabinoid receptor antagonist Rimonabant and GLP-1 receptor agonist Exendix-4 were injected into the hippocampal CA1 region of rats to determine the food intake during 0-4 h and 4-8 h,and the effects on gastric motility.Administrated cannabinoids and GLP-1 receptor agonist Exendix-4 into the hippocampal CA1 area to observe the effects of gastric distraction(GD)-sensitive neurons in diabetic rats.Result:Immunohistochemical staining showed that cannabinoid receptors expressed in the hippocampal CA1 region,and there was fiber projection from the hippocampal CA1 region to the BMA.Administrated cannabinoids and the GLP-1 receptor agonist Exendix-4 into the hippocampal CA1 region of rats could reduce food intake and inhibit gastric motility in rats.After microinjection of cannabinoids in the hippocampal CA1 area,the discharge frequency of GD-sensitive neurons in normal rats increased significantly.This effect was completely blocked by the cannabinoid receptor antagonist Rimonabant,and Exendix-4 partially blocked the promoting discharge effect of cannabinoids.Compared with normal rats,the discharge frequency of GD-sensitive neurons in diabetic rats was significantly increased after microinjection of cannabinoids in hippocampal CA1 area(P<0.05).After microinjection of cannabinoids in the hippocampal CA1 area,the amplitude and frequency of gastric motility in rats increased significantly,but the diabetic rats gastric motility was increase more significant.Conclusion:Cannabinoid receptors are expressed in the hippocampal CA1 region of diabetic rats,and the hippocampal CA1 region-BMA cannabinoid receptor signaling pathway is involved in the regulation of feeding and gastric motility in rats.
【Key words】 Hippocampal CA1 area; Amygdala; Cannabinoid receptor; Food intake; Gastric motility
First-authors address:School of Basic Medicine,Qingdao University,Qingdao 266021,China
20世紀90年代,研究人員在探究大麻衍生復合物-Δ9-四氫大麻酚的作用機制過程中發現了內源性大麻素系統[1]。大麻素分為三大類,從天然植物中提取的大麻素、人工合成的大麻素和內源性大麻素,該系統失衡與多種中樞神經系統和免疫系統疾病有關[2-3]。先前研究表明,大麻素系統在脂肪形成中發揮重要作用,大鼠及人促脂肪細胞的大麻素受體1(CB1)刺激作用通常伴有大麻素mRNA的上調[4]。而CB1阻斷劑能夠抑制大鼠脂肪細胞的增殖,因此隨著中樞CB1信號的傳遞,大鼠脂肪細胞CB1刺激作用保證了脂肪組織中的脂肪細胞有充足的脂肪儲存[5-7]。
如今,由于糖尿病及肥胖癥患病率的快速增加,糖尿病及肥胖已經成為全球性健康問題[8-10]。研究表明,大鼠中樞神經系統與外周器官之間存在密切的神經聯系,以此調節大鼠攝食及胃運動[11-12]。目前,針對肥胖的更有效的治療方法是胃切除手術,這表明胃腸道信號是調節能量穩態的關鍵因素[13-15]。盡管先前研究主要集中在不同的外周信號對大鼠體重及攝食調節中的相關作用,但尚未闡明控制該作用的中樞調控機制[16-18]。內源性大麻素水平是衡量大麻素系統活性的主要指標[19]。內源性大麻素及其受體在人體內發揮多種代謝調節作用,參與免疫調節、心血管調節、能量代謝等相關疾病的病理過程,然而,對于外源性大麻素對大鼠攝食及胃運動的中樞調控尚不明確[20-23]。此外,胰高血糖素(GLP)系統在糖尿病大鼠中與大麻素系統存在密切聯系,同時在大鼠攝食及胃運動中發揮重要作用[24-26]。GLP-1與大鼠肥胖也存在密切聯系,尤其是GLP-1受體激動劑Exendix-4[27-28]。因此,探究外源性大麻素在中樞調控中對大鼠攝食及胃運動的影響,以及GLP-1信號通路是否參與其中十分重要,這對于進一步研究大麻素系統臨床藥物的研發及肥胖癥的靶向治療具有重要意義。
1 材料與方法
1.1 實驗動物
成年雄性Sprague Dawley大鼠,體質量在220~250 g,所有大鼠均在室溫(25±2)℃、12 h∶12 h晝夜循環光照、實驗室標準飲食及自由進食和飲水的環境中飼養。實驗開始前大鼠禁食24 h,但可自由飲水。海馬CA1區內注射藥物后,大鼠自由攝食和飲水。所有動物實驗均嚴格按《青島大學實驗動物保護和使用管理辦法》執行。
1.2 熒光金逆行追蹤和免疫組織化學染色
大鼠腹腔注射硫代巴比妥醇(100 mg/kg)麻醉并固定在立體定位裝置(Narashige SN-3,Tokyo,Japan)上,將0.2 μl的3%(W/V)熒光金(FG;溶解在蒸餾水中)注射至杏仁核(BMA)中。7 d后,大鼠腹腔注射硫代巴比妥醇(100 mg/kg)麻醉,將麻醉的大鼠固定于操作臺上,先后給予250 ml 生理鹽水和250 ml 4%的多聚甲醛灌注固定。將大鼠斷頭取腦后,置于4%多聚甲醛中4~6 h進行后固定,再置于30%蔗糖溶液脫水(4 ℃)。冰凍切片機連續冠狀切片(Kryostat 1720,Leica,Germany),片厚15 μm,所有切片放于-20 ℃冰箱凍存。
選取海馬CA1區域較大的切片,先后用雙蒸水和0.01 mol/L PBS洗滌各3次,每次5 min,之后浸入檸檬酸修復液中微波修復5 min,至氣泡逸出。用正常羊血清封閉非特異性抗原(室溫孵育1 h),滴加一抗,即抗-CB1R抗體(兔來源,1∶200稀釋,Delaware Ave,Santa Cruz,USA),將加好一抗的標本置于濕盒中,4 ℃過夜。PBS溶液洗滌3次,然后滴加熒光素CY3標記的二抗(山羊抗兔,1∶500稀釋,Abcam,London,UK),室溫孵育2 h(避光操作)。淬滅油封片后,在BX50熒光顯微鏡(Olympus,Tokyo,Japan)下觀察實驗結果并拍照。
1.3 糖尿病大鼠模型制備
SD大鼠,體重220~250 g,適應性飼養1周后,禁食12 h,單次腹腔注射35 mg/kg的鏈脲佐菌素(STZ,sigama)。STZ用滅菌的0.1 mmol/L,pH 4.4的檸檬酸-檸檬酸鈉緩沖液配成2%的溶液,現配現用。72 h后取尾靜脈血測空腹血糖高于7.0 mmol/L和餐后血糖均高于11.1 mmol/L為糖尿病大鼠建模成功。一次注射未成模,立即按原劑量補注一次STZ后,未成模者或成模后緩解者淘汰。
1.4 腦核團置管
大鼠腹腔注射硫代巴比妥醇(100 mg/kg)麻醉后固定于腦立體定位儀,根據Paxinos&Watson大鼠腦圖譜用微量注射儀定位[11],以前囟為零點,定位海馬CA1區(前囟后4.2 mm,旁開2.0 mm,顱骨下2.8 mm)和BMA(前囟后2.2 mm,旁開4.0 mm,顱骨下9.0 mm),用牙科鉆鉆孔,將一不銹鋼套管置于海馬CA1區,用牙科粘固劑固定,不銹鋼管探針封閉導管,縫合頭皮切口[29]。大鼠分籠飼養,自由飲食飲水。手術結束后大鼠連續3 d給予腹腔注射8萬U青霉素以防止術后感染。大鼠恢復1周后開始實驗。
為了檢測核團或側腦室定位是否準確,實驗結束后經套管向大鼠海馬CA1區內緩慢注射滂胺天藍溶液,隨后麻醉大鼠,經心臟灌注固定,斷頭取腦,50 μm冠狀冰凍切片,顯微鏡下觀察藥物注射的位置是否準確。
1.5 攝食量測定
在實驗中選取正常大鼠和糖尿病大鼠,隨機分為6組(每組6只),(1)NS組:海馬CA1區注射0.5 μl生理鹽水;(2)CB1組:海馬CA1區注射0.5 μl 0.2 mg/kg CB1;(3)Rimonabant組:海馬CA1區注射0.5 μl 3 mg/kg Rimonabant;(4)Exendix-4組:海馬CA1區注射0.5 μl 2.5 μg/kg Exendix-4;(5)Rimonabant+CB1組:海馬CA1區注射0.2 mg/kg CB1與3 mg/kg Rimonabant混合液;(6)Exendix-4+CB1組:海馬CA1區注射0.2 mg/kg CB1與2.5 μg/kg Exendix-4混合液。大鼠禁食18 h,在實驗開始前1 h將大鼠放置在攝食測量籠內,使大鼠適應實驗環境。注射藥物或生理鹽水后立即給予大鼠定量食物。給藥后測量大鼠0~4 h和4~8 h攝食量。
1.6 GD敏感神經元細胞外放電記錄
五管玻璃微電極中一管為記錄電極,充有2%的滂胺天藍和0.5 mol/L乙酸鈉,其他四管連接到四通道壓力注射器,分別充以0.5 μl? 0.2 mg/kg大麻素、3 mg/kg Rimonabant、2.5 μg/kg Exendix-4及生理鹽水,通過短脈沖氣體壓力(1 500 ms,5.0~15.0 psi)將藥物噴灑到細胞表面上。使用液壓推進器將微電極送至后,記錄的電信號經MEZ8201型微電極放大器輸入VC-11雙道示波器,經SUMP-PC生物信號系統進行放電頻率處理與分析。當玻璃微電極進入海馬CA1區后,搜尋海馬CA1區內神經元,并開始記錄細胞外的放電活動。待放電頻率穩定后(至少記錄120 s),注入3~5 ml的溫生理鹽水至胃腔薄軟膠氣囊中,持續擴張胃壁10~30 s,觀察神經元放電頻率的變化,鑒別胃牽張(gastric distension,GD)敏感神經元,以神經元放電頻率的變化率超過20%作為神經元興奮或抑制指標,神經元表現興奮的確定為胃牽張興奮型神經元(GD-E),表現為抑制的確定為胃牽張抑制型神經元(GD-I)。
1.7 胃運動記錄
空腹大鼠麻醉后仰臥位固定于手術臺上,腹部皮膚備皮。劍突下行行腹部正中切口,切口長約1 cm,暴露胃部。在幽門向上0.3 cm處,沿胃環行肌方向將應力傳感器縫貼于胃竇的漿膜外,傳感器導線由皮下行至后頸部,經皮膚切口穿出體外(留置2~3 cm導線用于連接記錄儀)并固定。逐層縫合腹壁肌肉和皮膚。術后每日腹腔注射青霉素2萬單位,預防感染。3 d后大鼠恢復正常飲食且無任何疼痛或應激反應,即可實驗。
大鼠禁食18 h,自由飲水。實驗時,首先將大鼠置于記錄用鼠籠內適應環境1 h。胃運動由應力感受器傳至胃腸運動換能器,在此轉變為電信號輸入計算機,由Powerlab多道生物信號采集處理系統對胃腸運動數據進行處理。刺激前穩定記錄大鼠胃運動30~60 min。同一只大鼠兩次記錄至少間隔1天。胃運動變化采用平均為運動指數%(%MI)表示,%MI計算公式為:處理后曲線下面積/處理前的曲線下面積×100%。
1.8 統計學處理
用SPSS 18.0和PPMS 1.5軟件分析數據,所有數據均以(x±s)表示,多樣本均數比較采用單因素方差分析,兩組間樣本均數比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 海馬CA1區-BMA纖維投射及CB1受體的表達
免疫熒光組織化學實驗結果顯示,海馬CA1區與BMA之間存在纖維投射,且海馬CA1區表達CB1R,見圖1。
2.2 海馬CA1區注射CB1對大鼠攝食的影響
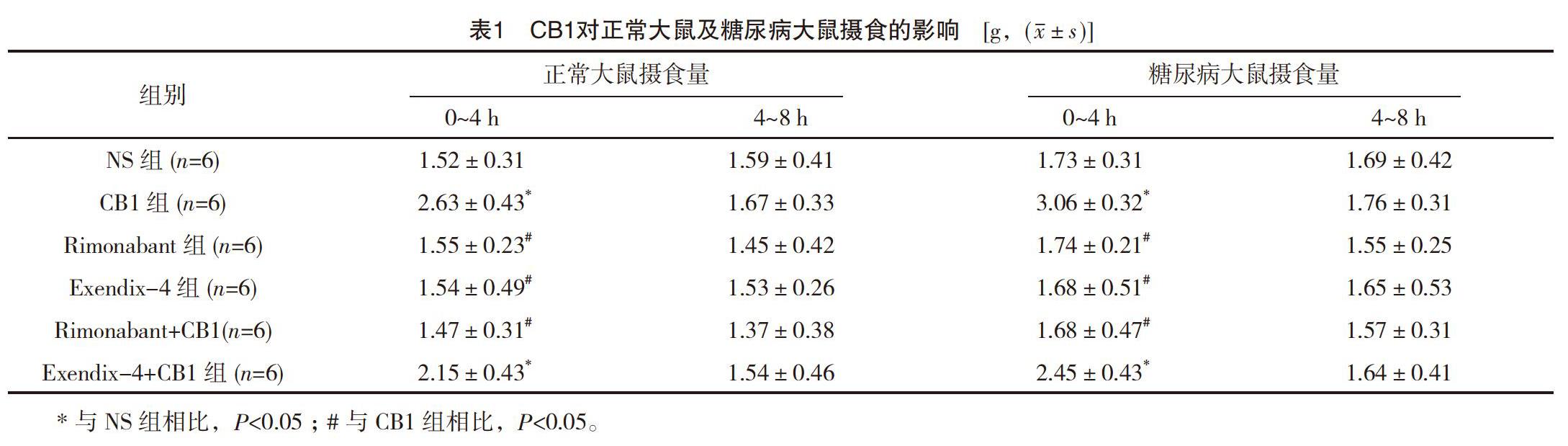
在正常大鼠中,與NS組相比,海馬CA1區注射CB1可顯著促進大鼠0~4 h的攝食量(P<0.05);但對于4~8 h攝食量無顯著改變(P>0.05);而預注射Rimonabant可阻斷CB1的促攝食作用。然而,單獨注射Rimonabant對攝食沒有明顯影響(P>0.05);與NS組相比,海馬CA1區注射Exendix-4可顯著抑制0~4 h的攝食量(P<0.05);海馬CA1區注射CB1和Exendix-4混合液時,與單獨注射CB1相比,0~4 h攝食量顯著降低(P<0.05),見表1。
在糖尿病大鼠中,與NS組相比,海馬CA1區注射CB1后,0~4 h的攝食量顯著增加(P<0.01);與CB1組相比,預先注射Rimonabant可阻斷CB1的促攝食作用(P<0.05);海馬CA1區聯合注射CB1和Exendix-4時,與單獨注射CB1相比,0~4 h攝食量顯著降低(P<0.05),見表1。
在兩組大鼠中,與正常大鼠相比,海馬CA1區注射CB1后糖尿病大鼠0~4 h攝食量顯著增加(P<0.05),且高于正常大鼠,見表1。
2.3 海馬CA1區注射CB1對糖尿病大鼠GD敏感神經元放電活動的影響
在35只糖尿病大鼠中海馬CA1區記錄到127個放電神經元,其中86個(86/127,67.72%)神經元對胃牽張有反應被鑒定為GD敏感性神經元。在86個GD敏感神經元中,48個(48/86,55.81%)神經元放電頻率顯著增加,鑒定為GD-E神經元;而另外38個(38/86,44.19%)神經元被抑制,鑒定為GD-I神經元。
在48個GD-E神經元中,海馬CA1區微量注射CB1,29個神經元(29/48,60.42%)放電活動增加[(3.78±0.67)Hz
vs (6.47±1.21)Hz],平均增加71.16%±4.2%(P<0.01);38個GD-I神經元中有17個(17/38,44.74%)神經元放電頻率顯著增加(2.96±0.58)Hz vs (4.97±1.09)Hz,平均增幅67.91%±2.7%(P<0.01),見圖2。若海馬CA1區內預先注射CB1受體拮抗劑Rimonabant可完全阻斷CB1誘導的促放電作用,表明CB1可能通過作用于其受體CB1R調節GD敏感神經元的活動;單獨注射Rimonabant對GD敏感神經元的活動無顯著影響(P>0.05);此外,預先向海馬CA1區注射Exendix-4,再給予CB1,發現CB1對GD-E或GD-I神經元的促放電作用可被Exendix-4部分阻斷(P<0.05),見表2。
2.4 CB1對糖尿病大鼠胃運動的影響
在糖尿病大鼠中,海馬CA1區直接注射生理鹽水,大鼠胃收縮的幅度和頻率無明顯改變(P>0.05);與NS組相比(n=8),大鼠海馬CA1區微量注射CB1能夠顯著促進大鼠胃收縮的幅度和頻率(P<0.05);而大鼠海馬CA1區中預注射Rimonabant,CB1對胃運動的促進作用可被完全阻斷(P<0.05);此外,預先向海馬CA1區注射Exendix-4,再給予CB1,發現CB1對胃運動的促進作用可被Exendix-4部分阻斷(P<0.05),見表3。
3 討論
在本研究中,筆者探究了大鼠海馬CA1區-杏仁核CB1受體信號通路和GLP-1受體信號通路對正常大鼠及糖尿病大鼠攝食及胃運動的影響,同時探究了對糖尿病大鼠GD敏感神經元的影響。先前研究中發現,糖尿病大鼠攝食量高于正常大鼠,但是具體機制尚不明確[6],因此需要進一步的研究來闡明糖尿病大鼠攝食及胃運動的中樞調控機制。
筆者的研究結果顯示,大鼠海馬CA1區注射CB1可引起該區域中大多數GD-E和GD-I神經元的激活。CB1受體拮抗劑Rimonabant阻斷了CB1引起的這些效應。此外,這些效應可被GLP-1受體拮抗劑Exendix-4調節。CB1與GLP-1受體拮抗劑Exendix-4聯合應用可引起大鼠食物攝入量改變。在研究中,筆者猜測CB1和大腦中的GLP系統可能在大鼠攝食及胃運動中起關鍵作用。
先前研究表明,CB1可促進大鼠攝食、覺醒或應激反應等[30]。在這項研究中,筆者證明大鼠海馬CA1區注射CB1可促進大鼠食物攝入,這與先前研究一致。并且CB1受體拮抗劑Rimonabant可完全阻斷CB1誘導的攝食增加。因此筆者認為CB1可能是通過海馬CA1區CB1受體發揮促攝食作用。此外,免疫組織化學染色結果顯示,大鼠海馬CA1區存在CB1受體,且海馬CA1區以杏仁核之間存在纖維投射,并且海馬CA1區中FG免疫陽性神經元與CB1受體神經元存在共定位,這為筆者的研究提供了重要的解剖學基礎。除此之外,先前研究顯示,GLP-1系統在糖尿病大鼠的攝食及能量代謝過程中發揮重要作用[31],因此,筆者研究發現,向大鼠海馬CA1區注射GLP-1受體拮抗劑Exendix-4可部分阻斷CB1的促攝食作用。
此外,筆者研究發現,向糖尿病大鼠海馬CA1區注射CB1能夠增加海馬CA1區GD敏感神經元的放電活動,且CB1受體拮抗劑Rimonabant可完全阻斷CB1誘導的促放電活動增加,向大鼠海馬CA1區注射GLP-1受體拮抗劑Exendix-4可部分阻斷CB1的促攝食作用,這進一步說明中樞CB1受體信號通路能夠參與調控大鼠胃運動。
糖尿病與肥胖疾病及食欲行為關系密切,這些行為主要是由中樞及外周相關通路參與調控,未來的研究中需要進一步的探究不同劑量肽對中樞系統及能量代謝之間相互作用的影響。在本研究中,觀察到的CB1R受體信號通路和GLP-1系統間的相互作用,這表明,CB1R拮抗劑和GLP-1受體拮抗劑之間可能存在潛在的協同作用,可用于治療糖尿病患者攝食過多和其他肥胖相關疾病。CB1R拮抗劑和GLP-1受體拮抗劑的聯合給藥可能為治療這些疾病提供一種新的藥理學策略。
參考文獻
[1] Drori A,Permyakova A,Hadar R.Cannabinoid-1 receptor regulates mitochondrial dynamics and function in renal proximal tubular cells[J].Diabetes Obes Metab,2019,21(1):146-159.
[2] Alen F,Decara J,Brunori G,et al.PPARα/CB1 receptor dual ligands as a novel therapy for alcohol use disorder:Evaluation of a novel oleic acid conjugate in preclinical rat models[J].Biochem Pharmacol,2018,157(8):235-243.
[3] Kumar V,Kumaresan A,Nag P,et al.Transcriptional abundance of type-1 endocannabinoid receptor(CB1) and fatty acid amide hydrolase (FAAH) in bull spermatozoa:Relationship with field fertility[J].Theriogenology,2018,114(8):252-257.
[4] Iyer M R,Cinar R,Coffey N J.Synthesis of 13 C6-labeled,dual-target inhibitor of cannabinoid-1 receptor(CB1 R) and inducible nitric oxide synthase (iNOS)[J].J Labelled Comp Radiopharm,2018,23(6):3-7.
[5] Xia L,de Vries H,Yang X.Kinetics of human cannabinoid 1(CB1) receptor antagonists:Structure-kinetics relationships(SKR) and implications for insurmountable antagonism[J].Biochem Pharmacol,2018,151(3):166-179.
[6] Caron A,Richard D.Neuronal systems and circuits involved in the control of food intake and adaptive thermogenesis[J].Ann N Y Acad Sci,2017,1391(1):35-53.
[7] Mollica A,Pelliccia S,Famiglini V,et al.Exploring the first Rimonabant analog-opioid peptide hybrid compound,as bivalent ligand for CB1 and opioid receptors[J].J Enzyme Inhib Med Chem,2017,32(1):444-451.
[8] Hwang Y S,Kim Y J,Kim M O,et al.Cannabidiol upregulates melanogenesis through CB1 dependent pathway by activating p38 MAPK and p42/44 MAPK[J].Chem Biol Interact,2017,273(3):107-114.
[9] Blume L C,Patten T,Eldeeb K,et al.Cannabinoid receptor interacting protein 1a competition with β-Arrestin for CB1 receptor binding sites[J].Mol Pharmacol,2017,91(2):75-86.
[10] Jing N,Fang B,Wang Z L,et al.Remote ischemia preconditioning attenuates blood-spinal cord barrier breakdown in rats undergoing spinal cord ischemia reperfusion injury:associated with activation and upregulation of CB1 and CB2 receptors[J].Cell Physiol Biochem,2017,3(6):2516-2524.
[11] Paxinos G,Watson C.The Rat Brain in Stereotaxic Coordinates[M].San Diego,CA:Academic Press,2007.
[12] El-Kharashi O A,Mohamed D I,Khairy E,et al.Exenatide promotes cardiac lncRNAs HOX transcript antisense RNA(HOTAIR) in Wistar rats with liver cirrhosis;a novel role of GLP-1 receptor agonists in cirrhotic cardiomyopathy[J].Eur J Pharmacol,2019,855(4):294-304.
[13] Brunchmann A,Thomsen M,Fink-Jensen A.The effect of glucagon-like peptide-1(GLP-1) receptor agonists on substance use disorder(SUD)-related behavioural effects of drugs and alcohol:A systematic review[J].Physiol Behav,2019,206(2):232-242.
[14] Rasalam R,Barlow J,Kennedy M.GLP-1 receptor agonists for type 2 diabetes and their role in primary care:an australian perspective[J].Diabetes Ther,2019,10(5):5-8.
[15] Inui A.Transgenic approach to the study of body weight regulation[J].Pharmacol Rev,2000,52(1):35-61.
[16] Ueda P,Pasternak B,Eliasson B.Glucagon-like peptide 1 receptor agonists and risk of diabetic retinopathy complications:cohort study in nationwide registers from two countries[J].Diabetes Care,2019,42(6):e92-e94.
[17] Boye K S,Stein D,Matza L S,et al.Timing of GLP-1 receptor agonist initiation for treatment of type 2 diabetes in the UK[J].Drugs R D,2019,19(2):213-225.
[18] Hasan A A,von Websky K,Reichetzeder C,et al.Mechanisms of GLP-1 receptor-independent renoprotective effects of the dipeptidyl peptidase type 4 inhibitor linagliptin in GLP-1 receptor knockout mice with 5/6 nephrectomy[J].Kidney Int,2019,95(6):1373-1388.
[19] Pozzi M,Mazhar F,Peeters G G A M,et al.Systematic review of the antidepressant effects of glucagon-like peptide 1(GLP-1) functional agonists:Further link between metabolism and psychopathology[J].J Affect Disord,2019,28(6):2-8.
[20] Pozo L,Bello F,Suarez A,et al.Novel pharmacological therapy in type 2 diabetes mellitus with established cardiovascular disease:Current evidence[J].World J Diabetes,2019,10(5):291-303.
[21] Tian M J,Wang R F,H?lscher C,et al.The novel GLP-1/GIP dual receptor agonist DA3-CH is neuroprotective in the pilocarpine-induced epileptogenesis rat model[J].Epilepsy Res,2019,154(5):97-106.
[22] Wan S,Sun H.Glucagon-like peptide-1 modulates RAW264.7 macrophage polarization by interfering with the JNK/STAT3 signaling pathway[J].Exp Ther Med,2019,17(5):3573-3579.
[23] Sticht M A,Lau D J,Keenan C M,et al.Endocannabinoid regulation of homeostatic feeding and stress-induced alterations in food intake in male rats[J].Br J Pharmacol,2019,176(10):1524-1540.
[24] Zhang K,Yang Q,Yang L,et al.CB1 agonism prolongs therapeutic window for hormone replacement in ovariectomized mice[J].J Clin Invest,2019,130(3):2333-2350.
[25] Fernandes A R,Mortimer D,Rose M,et al.Recently listed Stockholm convention POPs:Analytical methodology,occurrence in food and dietary exposure[J].Sci Total Environ,2019,678(4):793-800.
[26] Cabral D,Cunha L M,Vaz de Almeida M D.Food choice and food consumption frequency of Cape Verde inhabitants[J].Appetite,2019,139(8):26-34.
[27] Anastasiou K,Miller M,Dickinson K.The relationship between food label use and dietary intake in adults:A systematic review[J].Appetite,2019,138(5):280-291.
[28] Hermine H M,MaesMichael C,NealeLindon J.Genetic and environmental factors in relative body weight and human adiposity[J].Eaves Behavior Genetics,1997,27(4):325-351.
[29] Ye K,Li L,Zhang D,et al.Effect of maternal obesity on fetal growth and expression of placental fatty acid transporters[J].J Clin Res Pediatr Endocrinol,2017,9(4):300-330.
[30] Karlsson C,Aziz A M,Rehman F,et al.Melanin-concentrating hormone and its MCH-1 receptor:relationship between effects on alcohol and caloric intake[J].Alcohol Clin Exp Res,2016,40(10):2199-2207.
[31] Xu G,Li Y,An W,et al.Gastric mammalian target of rapamycin signaling regulates ghrelin production and food intake[J].Endocrinology,2009,150(7):3637-3640.
(收稿日期:2019-07-04) (本文編輯:何玉勤)

