多花黃精多糖對STZ 誘導的Ⅰ型糖尿病小鼠影響作用研究*
王秋麗,童小慧,李小東,韓榮春,彭代銀,俞年軍△
(1. 安徽中醫藥大學 安徽省中醫藥科學院 中藥資源保護與開發研究所,安徽 合肥231200;2. 安徽中醫藥大學中西醫結合學院,安徽 合肥230012)
糖尿病是一種以高血糖為特征的代謝紊亂性疾病,在發展過程中易累及多臟器,比如肝臟脂質的堆積、炎細胞浸潤等[1]。多花黃精Polygonatum cyrtonema Hua 屬百合科黃精屬植物,與滇黃精Polygonatum kingianum Coll.et Hemsl.、黃精Polygonatum sibiricum Red.一同收錄于《中國藥典》(2015 年版一部)。黃精系藥食同源的多年生草本植物,是我國傳統大宗藥材[2],具有補氣養陰、健脾、潤肺、益腎之效[3]。現代研究表明,黃精主要成分多糖具有降血糖、血脂[4-6],抗腫瘤[7-9],抑菌[10],抗炎[11],抗病毒[12],增強免疫[13]等作用。目前,多花黃精多糖的降血糖研究鮮有報道。
STZ 是目前最廣泛的用來誘導I 型糖尿病動物模型的化學物質,通過葡萄糖轉運體2(glucose transporter 2,GLUT2)產生毒性作用,破壞胰島β 細胞,導致胰島素分泌絕對不足[14]。因此,本實驗擬運用STZ 誘導高血糖,探討多花黃精多糖對糖尿病小鼠血糖及肝臟等影響以及相關作用機制。
1 材料和儀器
1.1 材料 多花黃精藥材由安徽省青陽縣九華中藥材科技有限公司提供,經安徽中醫藥大學藥學院俞年軍教授鑒定為多花黃精。鏈脲佐菌素(美國Sigma,批號:S0130-500);血糖試紙(美國強生,批號:4489872);伊紅染液(索萊寶,批號:G1100);蘇木素染色液(博士德生物,批號:AR1180-1);Trizol 試劑盒(Invitorgen,USA,批 號:135404);FastQuant RT kit(天根,批號:KR151125)。6 周齡SPF 級雌性C57 BL/6 小鼠(18.0±1.0 g),購自安徽醫科大學動物實驗中心,動物生產許可證編號:SCXK(皖)2016-001。小鼠適應性飼養1 周。飼養條件為:溫度(25±1)℃,12 h光照/12 h 黑暗,于早晨7:00 開燈。常規飼料飼養,自由飲食。
1.2 儀器 穩豪血糖儀(UltraEasy);真空冷凍干燥機(北京松源華興科技發展有限公司);旋轉蒸發儀(日本EYELA);體重秤(上海光正醫療儀器有限公司);倒置顯微鏡DMIL LED(德國萊卡);超微量核酸蛋白測定儀(德國耶那分析儀器股份公司);熒光定量PCR 儀(上海羅氏診斷產品有限公司)。
2 方法
2.1 多糖的制備 取干燥的多花黃精適量,經研磨粉碎過篩后,加入10 倍量的95%乙醇溶液回流提取1 h,抽濾收集濾渣,干燥。然后將多花黃精濾渣與8倍量水混合均勻,回流提取2 次,回流提取1 h,抽濾并收集濾液,所得濾液在60 ℃條件下減壓濃縮至一定體積,緩慢滴加無水乙醇同時不斷攬拌,至乙醇的終濃度為80%,放入4 ℃冰箱中過夜。次日進行抽濾,濾餅放置于真空冷凍干燥機冷凍干燥,所得粉末即為多花黃精粗多糖[15]。
2.2 分組及給藥 90 只雌性C57BL/6c 小鼠分兩組:正常對照組(n=6)及模型組(n=84)。
模型組小鼠隔夜禁食后,腹腔注射新鮮制備的冷STZ 溶液(溶解于檸檬酸緩沖液中,pH 4.2)。STZ注射劑量為70 mg·kg-1/d,連續5d,監測小鼠血糖變化。于首次注射STZ 1 周后,開始分組給藥。從模型組小鼠中選出72 只血糖水平相近、體重相近的小鼠依次分為:模型組(n=24)、多花黃精多糖低劑量(450 mg·kg-1,n=24)和多花黃精高劑量組(900 mg·kg-1,n=24)。各組小鼠分別灌胃給予相應藥物,空白對照組以及模型組給予等量生理鹽水。
2.3 記錄小鼠死亡率 于首次給藥后,記錄小鼠狀態以及死亡情況。
2.4 記錄小鼠體重以及測定血糖水平 給藥期間監測小鼠體重變化。以首次分組給藥第1 天為D1,于給藥10 d 后采用血糖試紙,尾尖取血測定各組小鼠隨機血糖水平。
2.5 肝臟組織學觀察 于給藥10 d 后,頸椎脫臼處死各組小鼠。肝臟組織樣本迅速浸泡在10%的福爾馬林溶液中固定24 h,脫水、石蠟包埋,切成6 μm 厚的薄片,經蘇木精-伊紅(hematoxylin-eosin,HE)染色后進行組織形態學分析。肝臟病變的程度由專業技術人員進行雙盲評分,評分范圍為0~3。
2.6 qPCR 檢測肝臟IL-6、IL-1β、IRS-1 mRNA 水平如2.5 項下處死動物,取肝臟液氮速凍,-80 ℃保存。采用TRIzol 提取總RNA,500ng RNA 反轉錄合成cDNA,采用qPCR 檢測肝臟中IL-6、IL-1β、IRS-1 mRNA 水平。反應條件為95 ℃10 min,95 ℃10 s,60 ℃10 s,72 ℃10 s,45 次循環。以GAPDH Ct 值校正,采用2-△△CT法計算IL-6、IL-1β、IRS-1 mRNA相對表達水平。引物序列見表1。

表1 qPCR 所需引物序列
2.7 統計學方法 所有實驗結果以均值±標準差表示,采用數據分析軟件Graph Pad Prism 6 采用t 檢驗,生存率曲線顯著性采用Log-rank(Mantel-Cox)檢測。P<0.05 表示差異具有統計學意義。
3 結果
3.1 STZ 誘導T1DM 模型 采用STZ 誘導T1DM 模型。每只小鼠連續5 d 腹腔注射STZ(70 mg·kg-1),并檢測小鼠血糖變化。于首次給予STZ 后檢測血糖,其值變化明顯。如圖1 所示,與正常對照組相比,模型組小鼠的血糖于首次STZ 注射第5 天后開始顯著升高(20.08±3.397 vs.7.25±0.728 mmol·L-1)。并且持續升高至首次STZ 注射第7 天。觀察小鼠發現,正常對照組小鼠飲食、飲水正常,體毛光澤,體重增加明顯。而STZ 注射小鼠出現消瘦、體表皮毛無光澤以及活動減少等現象,同時飼養籠墊料臟濕加速。以上變化符合糖尿病病癥中的“三多一少”(多飲、多食、多尿及體重減少)的特征[16]。
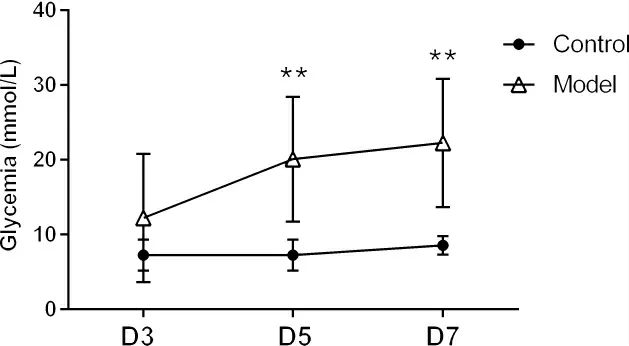
圖1 連續給予5 次STZ(70 mg·kg-1)對小鼠隨機血糖的影響
因此,本實驗采用連續5d 腹腔注射STZ(70 mg·kg-1)并于1 周后進行多花黃精多糖干預的實驗方案。
3.2 多花黃精多糖提高T1DM 模型小鼠的存活率實驗中發現,正常組小鼠在實驗期間內的存活率為100%.與正常對照組相比,模型組小鼠死亡率明顯增加,多數動物出現后肢紅腫、斷足等癥狀。于正式實驗的10 d 內存活率僅為16.67%(4/24)。而與模型組相比,多花黃精多糖高劑量組(900 mg·kg-1)小鼠的死亡率處于較低水平,于實驗10d 后存活率為66.67%(16/24)。并且,動物未出現后肢紅腫、斷足等異常情況。多花黃精多糖低劑量組(450 mg·kg-1)小鼠的存活率與模型組相比無顯著性差異25%(6/24)。結果如圖2 所示。
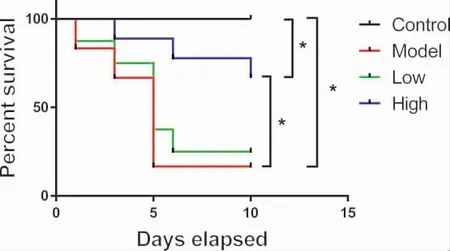
圖2 多花黃精多糖對T1MD 小鼠存活率的影響
因此,該結果提示多花黃精多糖高劑量顯著降低T1DM 模型小鼠的急性死亡率。
3.3 多花黃精多糖對T1DM 模型小鼠體重的影響本實驗同時測定多花黃精多糖對小鼠體重的影響,結果如圖3 所示。與正常對照組相比,模型組小鼠體重下降約40%(19.6±0.945 vs.31.9±1.862 g)。多花黃精多糖低劑量組(450 mg·kg-1)小鼠的體重相比模型組小鼠顯著增加(23.3±1.358 vs.18.9±0.945 g)。并且,與低劑量組相比,多花黃精高劑量組(900 mg·kg-1)有增加小鼠體重的趨勢,但數據檢測無顯著性差異(24.7±0.928 vs.23.3±1.358 g)。
以上實驗結果提示,盡管不能完全逆轉T1DM 小鼠體重的下降,多花黃精多糖低劑量及高劑量均有顯著增加糖尿病小鼠體重的作用。
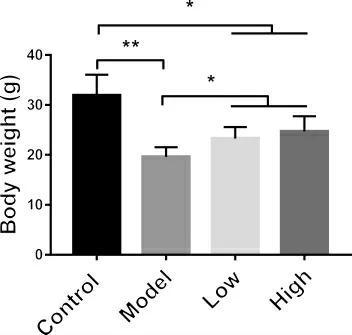
圖3 多花黃精多糖對T1MD 小鼠體重的影響
3.4 多花黃精多糖對T1DM 模型小鼠隨機血糖的影響 根據實驗觀測到的多花黃精多糖顯著增加高血糖小鼠的存活率以及逆轉其體重下降,本研究同時對各組小鼠隨機血糖進行檢測,探究多花黃精多糖以上的作用是否與影響小鼠血糖水平相關。于實驗結束處死小鼠前測定血糖水平,結果如圖4 所示。與正常對照組相比,模型組小鼠血糖顯著升高(8.08±0.3597 vs.30.7±1.664 mmol·L-1)。多花黃精高劑量組(900 mg·kg-1)小鼠與模型組小鼠相比,血糖水平下降有顯著性差異。而低劑量多花黃精多糖對模型小鼠的血糖水平影響較弱。
以上實驗結果提示,多花黃精多糖高劑量(900 mg·kg-1)具有一定程度的降低T1DM 小鼠隨機血糖水平的作用。
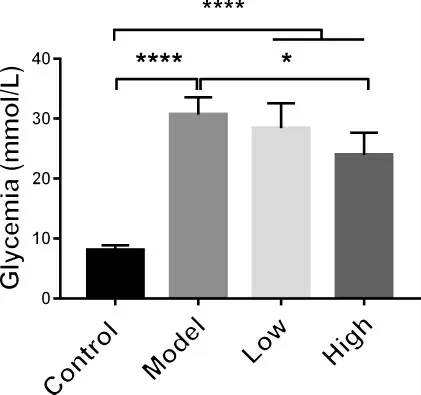
圖4 多花黃精多糖對T1MD 小鼠隨機血糖的影響
3.5 多花黃精多糖改善T1DM 模型小鼠肝損傷 實驗采用HE 染色法檢測多花黃精多糖是否通過影響小鼠肝臟狀態從而改善T1DM 小鼠的生存率。結果如圖5 所示,正常對照組小鼠肝細胞以索狀順序排列,環繞中央靜脈成放射狀。細胞核位于細胞質中央(如圖5A 中寬箭頭所示),肝細胞之間由肝竇連接,肝竇清晰(如圖-5A 中細箭頭所示)。與正常對照組小鼠相比,模型組小鼠肝臟實質局部出現大量單核樣炎癥細胞的浸潤(如圖5B 中方框所示),肝細胞變性明顯:大量的肝細胞出現濃的嗜酸性細胞質和固縮的細胞核(如圖5B 中寬箭頭所示),并且肝細胞排列雜亂、肝竇分辨不清,提示肝臟出現硬化。低劑量多花黃精多糖組小鼠肝臟的仍然存在一定程度的病變:炎癥細胞浸潤明顯、一部分的肝細胞變性以及肝臟細胞排列結構紊亂(如圖5C 所示)。而高劑量多花黃精多糖顯著改善模型小鼠肝臟的病變:炎癥細胞浸潤相對減少、肝細胞變性明顯得到改善以及肝細胞排列整齊等(如圖5D 所示)。

圖5 多花黃精多糖對T1MD 小鼠肝臟病理形態改變的影響(HE,×200)

表2 多花黃精多糖對模型小鼠肝臟病理形態影響的雙盲評分
各組小鼠HE 染色切片隨機選取10 個不同部位拍攝,并對各組小鼠肝臟病變進行雙盲定性評分。評分結果如表2 所示,結果提示黃精多糖高劑量可以顯著改善模型小鼠肝臟炎癥細胞清潤以及肝細胞變性等病理改變。
3.6 多花黃精多糖對T1DM 模型小鼠肝臟IL-6、IL-1β、IRS-1 mRNA 水平 實驗繼續采用qPCR 對小鼠肝臟炎癥因子IL-6 和IL-1β 的基因表達水平進行檢測。結果如圖6A、6B:與正常組相比,模型小鼠肝臟IL-6、IL-1β 表達水平顯著升高,與肝臟組織病變結果(圖5)相吻合。多花黃精高、低劑量均能顯著降低TD1M 小鼠肝臟IL-6、IL-1β 的過表達。由于炎癥是導致肝臟胰島素抵抗的重要原因,我們檢測了胰島素通路中胰島素底物1(IRS-1)的表達水平。結果如圖6C:高血糖顯著降低小鼠肝臟中IRS-1 mRNA 水平,提示胰島素通路受損。而多花黃精劑量依賴性的升高TIDM 小鼠肝臟中的下降的IRS-1 的基因表達。
以上數據表明,多花黃精多糖能夠改善糖尿病肝臟的炎癥和胰島素敏感性。
4 討論
目前全世界有超過3 億人罹患糖尿病,具有流行病學趨勢[17]。糖尿病主要包括Ⅰ型糖尿病以及Ⅱ型糖尿病。T1DM 是一種自身免疫性疾病,由于胰腺胰島β 細胞遭受機體異常免疫的攻擊,導致胰島素分泌障礙及血糖水平上升[18]。
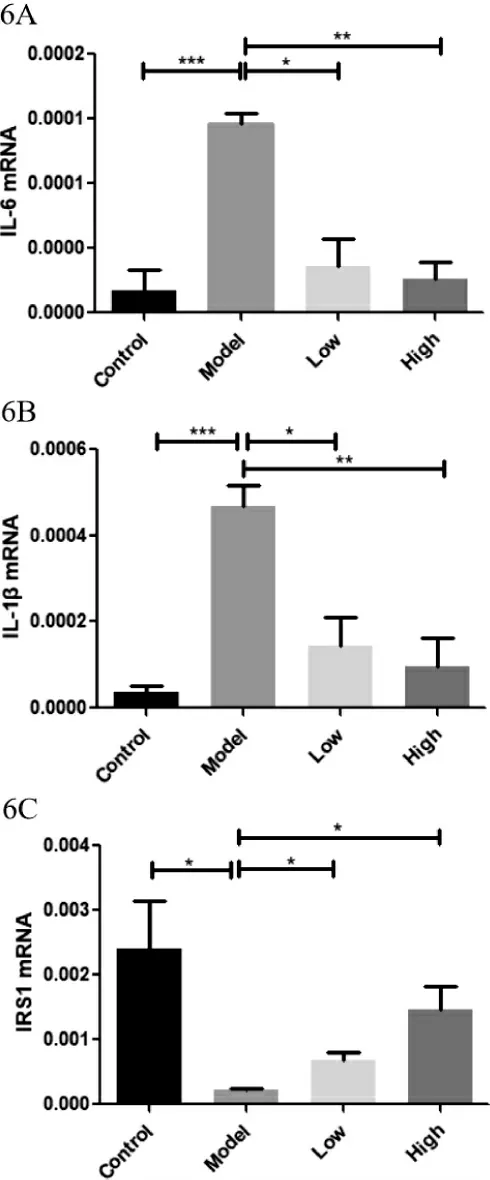
圖6 多花黃精多糖對各組小鼠肝臟IL-6、IL-1β、IRS-1基因水平的影響
由于胰島素對葡萄糖、脂質等營養物質的合成效應,胰島素的缺乏將引起機體一系列的代謝異常,比如肝臟中失控的糖原分解、糖異生、酮體生成以及脂肪組織中甘油三酯的分解。這些變化將導致機體處于持續的能量分解狀態,最終引起體重下降[19],并最終引起死亡率升高。本實驗結果中多花黃精高劑量(900 mg·kg-1)顯著降低T1DM 模型小鼠的急性死亡率,提示多花黃精多糖具有積極干預T1DM 發展的作用。
STZ 誘導模型能夠通過減少胰島素釋放,導致動物體重下降。例如,Viviane El-Helou 等報道,9~11 周齡的雄性SD 大鼠單次腹腔注射STZ(60 mg·kg-1),3周后大鼠的體重下降約34%,同時血糖上升至28 mmol·L-1左右[20]。此外,Sisse A N?rgaard 等報道:6-8周齡的雄性129S2/SvPastCrl 鼠,兩次腹腔注射STZ(100 mg·kg-1/次,間隔3 d),3 周后體重小鼠體重下降約10%[21]。
而相比雄性小鼠,15 周齡雌性C57BL/6 小鼠經STZ 誘導高血糖后,體重下降更加明顯[22]。另外,臨床數據提示糖尿病女性患者較男性患者,某些并發癥的發病率顯著偏高[23]。Harmesh N.Chaudhari 等報道,雌性SD 大鼠較雌性大鼠更容易受高血糖影響。11 周齡SD 大鼠腹腔注射STZ(50 mg·kg-1),兩周后雌性大鼠胰島素水平顯著低于雄性大鼠。另外,雌性小鼠肝臟中抗氧化蛋白DJ1 顯著降低[24]。
推測雌性動物更容易受到胰島素缺乏的影響。本實驗中在首次注射STZ(70 mg·kg-1)第10 天,小鼠的體重下降約40%與文獻報道基本相符合。而450~900 mg·kg-1的多花黃精多糖能夠顯著降低T1DM 模型小鼠的體重下降,900 mg·kg-1的多花黃精多糖顯著抑制T1DM 模型小鼠的隨機血糖水平。提示多花黃精多糖可能具有保護胰島β 細胞免受STZ 誘導的凋亡,或者能夠通過改善T1DM 小鼠代謝紊亂的作用。因此,本實驗采用HE 染色法探究多花黃精多糖對機體中代謝重要器官肝臟的影響。
高血糖會導致臟器損傷,比如肝臟[25]。非酒精性脂肪肝包括硬化和非酒精性硬化性肝炎是糖尿病肝臟主要的病變,并且是肝臟損傷的主要原因[26]。據報道:STZ 誘導的T1DM 大鼠,肝臟超微結構顯著改變。出現細胞核固縮,染色質縮合,線粒體腫大,粗內質網膨脹等病變[27]。本實驗HE 染色結果STZ 誘導的高血糖導致小鼠肝臟出現明顯病變如肝細胞變性、壞死,肝細胞結構紊亂等,與文獻報道相符。并且,肝臟實質中出現大量的炎細胞浸潤。
肝臟在機體固有免疫反應中具有重要作用,肝臟細胞中包含多種免疫細胞,包括單核細胞,巨噬細胞,淋巴細胞,自然殺傷細胞以及肝星狀細胞等[28-29]。高血糖能夠通過促進骨髓中髓系祖細胞的增殖和分化從而升高循環系統中單核細胞以及嗜中性粒細胞的數量[30]。Yong-Sun Lee 等研究證明:STZ 誘導的高血糖通過促進肝臟Treg 細胞遷移,顯著增加小鼠肝臟中單核細胞核嗜中性粒細胞的數量。并且促進單核細胞前炎癥因子如:TNF-α,IL-1β,TFN-γ 及IL-6 等的表達[31]。因此,本實驗采用qPCR 檢測多花黃精多糖對其肝臟炎癥因子IL-1β 和IL-6 mRNA 的表達,結果顯示,450~900 mg·kg-1的多花黃精多糖能夠顯著降低其 基因的表達。此外,多花黃精多糖能夠顯著上調糖尿病肝臟中IRS-1 的基因水平。
綜上所述,本研究表明,多花黃精多糖顯著改善STZ 誘導的雌性T1DM 小鼠的存活率。可能與其有效抑制T1DM 過程中小鼠體重下降,并且抑制肝臟炎癥細胞浸潤、抑制炎癥因子的表達及提高胰島素受體底物的表達,從而改善肝臟免疫反應的作用相關。為進一步研究多花黃精多糖治療血糖代謝紊亂等疾病提供初步的實驗依據。

