藥用黃芪基因組大小的研究?
樊慧杰,柴 智,黃浩楹,殷福棟,陳樂樂,趙建平,周 然
(山西中醫藥大學,山西 晉中 030619)
基因組大小(又稱C值)是指生物體單倍體基因組所含的DNA總量,每種生物的基因組總量是恒定的,其大小可用核苷酸堿基對的數量(Mb)來表示。基因組大小被認為是決定生物體生命特征的一個基本生物學屬性。研究發現,物種的基因組大小與生物形狀和環境因素具有一定的相關性[1-6]。由于許多生物體基因組大小數據空白,這種相關性現象發生的原因目前還不十分明確,所以需要深入研究各物種的基因組大小。
黃芪入藥始載于《神農本草經》,可謂歷史悠久。2015年版《中國藥典》規定藥用黃芪為豆科植物蒙古黃芪Astragalusmembranaceus(Fisch.) Bge. var. mongolicus (Bge.) Hsiao或膜莢黃芪Astragalusmembranaceus(Fisch.) Bge.的干燥根[7]。黃芪也是國家衛生部公布的藥食同源、可用于保健食品的中草藥。現代藥理研究發現,黃芪可以提高機體免疫功能[8],對心臟[9]、神經系統[10]、腎臟[11]、胃[12]等均有保護作用,并具有一定的抗腫瘤作用[13]。但目前對黃芪的研究多集中在藥效及其化學成分等方面,而對其基因組還不甚了解。因此,有必要測定黃芪基因組的大小,可進一步揭示蒙古黃芪和膜莢黃芪在基因組大小方面的區別,同時也為黃芪后續的基因組學、種質資源研究提供科學依據。
1 材料與方法
1.1 實驗材料
蒙古黃芪、膜莢黃芪均來源于山西中醫藥大學校園內種植基地,摘取新鮮葉子作為蒙古黃芪、膜莢黃芪的實驗材料。大豆William 82(由中國科學院東北地理與農業生態研究所孔凡江教授所惠贈)是流式細胞術測定黃芪基因組大小所用的標準植株,在實驗室種植大豆William 82,摘取新鮮葉子作為大豆William 82的實驗材料。
1.2 實驗儀器
BD FACSCalibur流式細胞儀(BD Bioscience Corporation),PHSJ-4 A實驗室PH計(上海儀電科學儀器股份有限公司),電子天平(梅特勒-托利多儀器上海有限公司),磁力攪拌器(北京大龍興創實驗儀器有限公司),HPX-9162MBE電熱恒溫培養箱(上海博訊實業有限公司醫療設備廠)。
1.3 實驗試劑與耗材
碘化丙錠(北京索萊寶科技有限公司,批號326C0428);RNase(北京索萊寶科技有限公司, 批號20170607); 400目尼龍篩網(北京索萊寶科技有限公司, 批號20161111);Tris(北京索萊寶科技有限公司, 批號0922S0714);Triton X-100(BBI Life Sciences,批號D220BA0041);Na2EDTA(BBI Life Sciences,批號D328BA0007);四鹽酸精胺(BBI Life Sciences,批號D512BA0029);β-巰基乙醇(Sigma-Aldrich,批號D124BA0001);NaCl(生工生物工程股份有限公司,批號D710BA0034);KCl(生工生物工程股份有限公司,批號D316BA0025)。
1.4 流式細胞術測定蒙古黃芪基因組大小方法的建立
1.4.1 細胞核制備 分別取20 mg蒙古黃芪葉片、膜莢黃芪葉片、大豆William 82葉片、蒙古黃芪和大豆William 82葉片質量比為1∶1混合的樣品,膜莢黃芪和大豆William 82葉片質量比為1∶1混合的樣品,蒸餾水清洗葉片,濾紙擦干,放入培養皿中。加入1 ml體積的LB01(15 mmol/L Tris, 2 mmol/L Na2EDTA, 0.5 mmol/L四鹽酸精胺,80 mmol/L KCl, 20 mmol/L NaCl, 體積分數0.1% Triton X-100,15 mmol/L β-巰基乙醇,調pH值為7.5),用鋒利單刃刀片將葉片快速切碎,冰上孵育5 min,用預先浸潤在無水乙醇中的400目尼龍網過濾獲得細胞核懸液[14]。先進行3次平行實驗。
1.4.2 DNA染色 取過濾后的細胞核懸液,加入1 mg/L RNase 20 μL和1mg/L碘化丙錠(propidium iodide,PI)20 μL輕輕搖勻,4 ℃避光染色,5 min后上機檢測。
1.4.3 流式細胞儀檢測 上機前各樣品振蕩5 s,用488 nm的藍光激發,檢測FL2范圍內PI發射的熒光強度,低速收集樣品細胞核5000個,數據采用流式細胞儀自帶專用軟件分析。變異系數CV≥5%,表明結果不準確;CV <5%,表明結果基本可信[15]。記錄各樣品的熒光強度均值,代入公式分析黃芪的基因組大小。基因組大小的計算公式為:黃芪的基因組大小=黃芪峰的熒光強度均值/ William 82峰的熒光強度均值×William 82的基因組大小[16]。
2 結果與分析
圖1~5表1、2顯示,對大豆William 82、蒙古黃芪和膜莢黃芪分別進行單獨的流式細胞儀檢測,對比分析單獨測定峰,可見峰形明顯,峰位的通道數值不同,說明可以用大豆William 82作為蒙古黃芪、膜莢黃芪C值檢測的內標植株。流式細胞儀分析蒙古黃芪與大豆William 82混合樣品,樣品混合后的區分度良好,CV均在5%以內,可以保證計算蒙古黃芪C值結果的可行性和準確性。數據結果顯示,蒙古黃芪熒光強度均值是大豆William 82熒光強度均值的1.32倍,而大豆William 82的C值為1.11Gb[17],由此計算出蒙古黃芪C值為1.46Gb。流式細胞儀分析膜莢黃芪與大豆William 82混合樣品,CV均在5%以內,膜莢黃芪熒光強度均值是大豆William 82熒光強度均值的1.37倍,進而計算出膜莢黃芪C值為1.52Gb,由此表明膜莢黃芪的C值大于蒙古黃芪的C值。
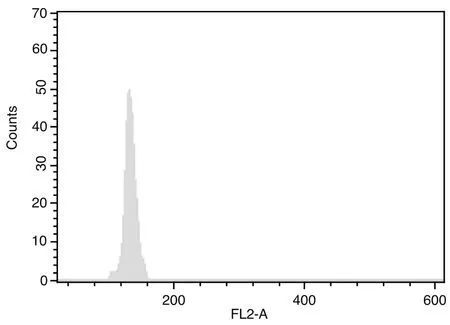
圖1 大豆William 82樣品的流式細胞儀檢測結果
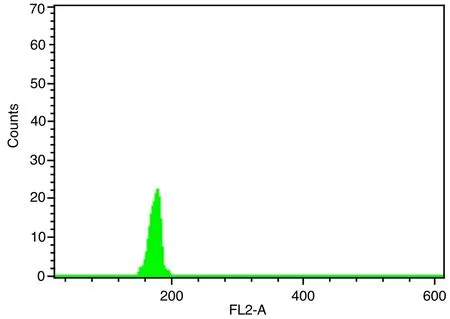
圖2 蒙古黃芪的流式細胞儀檢測結果
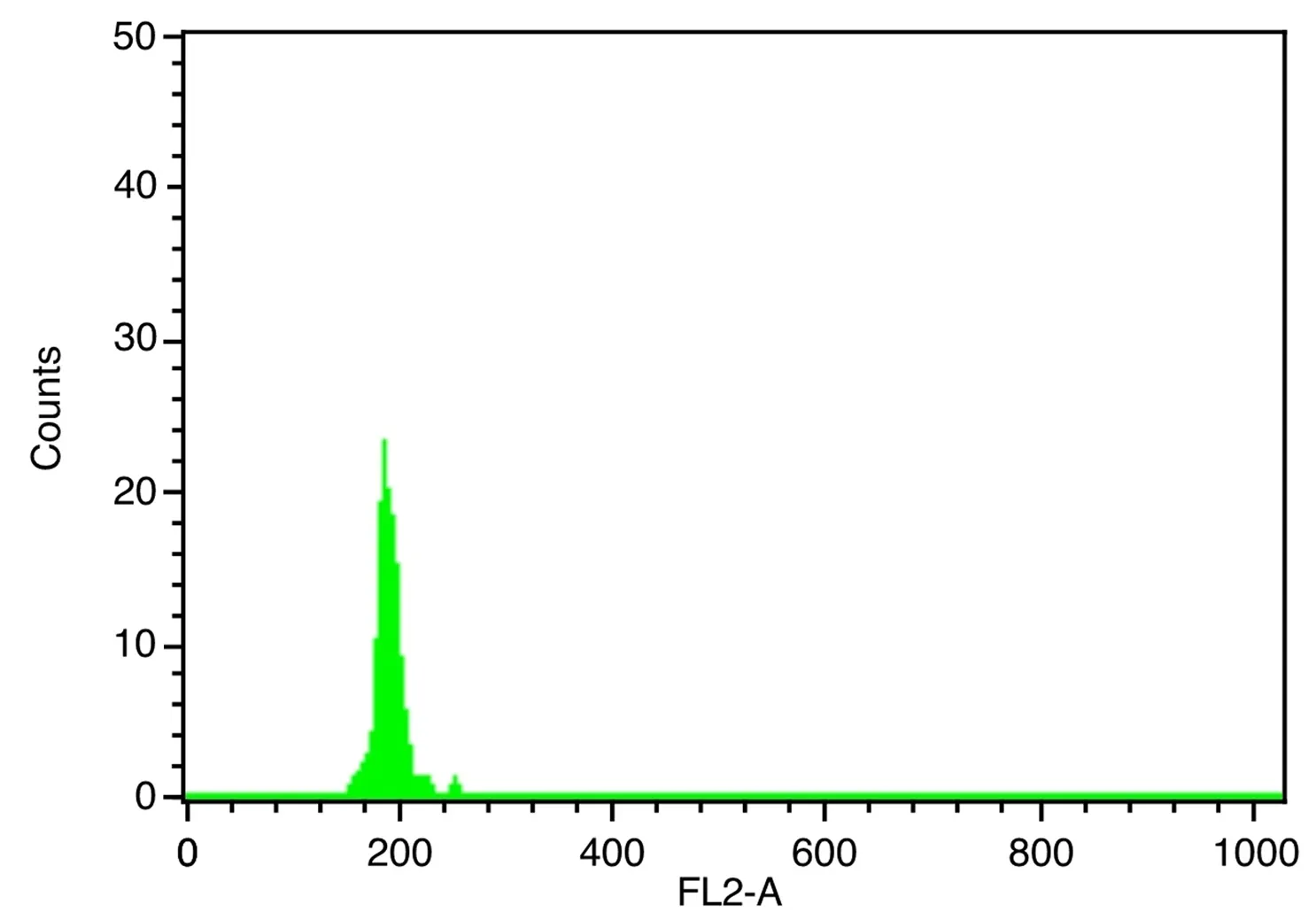
圖3 膜莢黃芪的流式細胞儀檢測結果比較
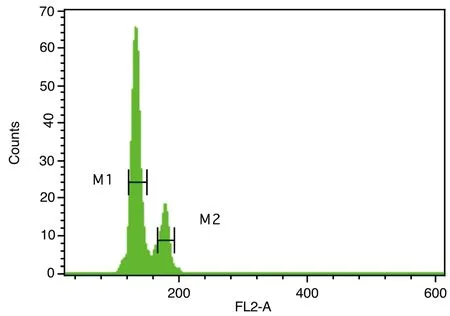
注:M1:內標大豆William 82的峰位;M2:蒙古黃芪的峰位圖4 蒙古黃芪和大豆William 82混合樣品流式細胞儀檢測結果比較
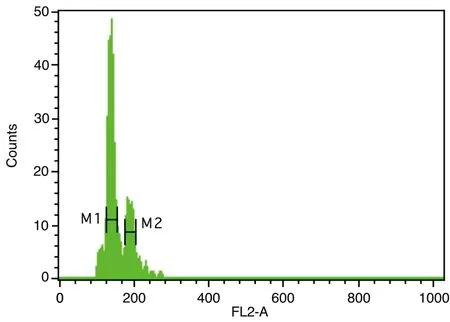
注:M1:內標大豆William 82的峰位;M2:膜莢黃芪的峰位圖5 膜莢黃芪和大豆William 82混合樣品流式細胞儀檢測結果比較
3 討論
蒙古黃芪和膜莢黃芪同為現代《中國藥典》中收錄的藥材。但從南北朝《名醫別錄》開始,入藥黃芪的道地產地和種類均隨朝代的變遷而變化,黃芪的產地由最初的四川蜀郡、白水,陜西漢中及甘肅隴西,到唐代逐漸轉移至甘肅原州和寧夏華州,到宋代以后移至山西,黃芪的種類是在最初的南北朝記載中以膜莢黃芪為主,也逐步過渡到宋代以后的以蒙古黃芪為主[18]。對于蒙古黃芪和膜莢黃芪分類學地位,主要的學術觀點有:包括肖培根院士[19]在內的不少學者主張蒙古黃芪是膜莢黃芪的變種,朱相云[20]認為蒙古黃芪是膜莢黃芪的亞種,另有學者認定蒙古黃芪應為獨立的一個種[21]。其中,經典主流的學術觀點是蒙古黃芪是膜莢黃芪的變種。肖培根[19]通過考證黃芪的變遷歷史以及區分子房和小葉的形態,首先提出蒙古黃芪是膜莢黃芪變種的學術觀點;錢丹等[22]依據葉綠體單倍型繪制的網狀進化樹發現,蒙古黃芪的單倍型是由膜莢黃芪單倍型衍射而來,支持膜莢黃芪是較早的原始類群、蒙古黃芪是逐漸分化出來的變種的觀點;喬永剛等[23]通過研究膜莢黃芪和蒙古黃芪的核型,發現膜莢黃芪染色體核型為2B型,蒙古黃芪染色體核型為2C型,依據Stebbins的核型進化理論分析,蒙古黃芪比膜莢黃芪更加進化,從核型角度同樣支持蒙古黃芪是膜莢黃芪變種進化的結果。
流式細胞術是一種對液流中排成單列的微小顆粒逐個進行快速計數和分選的技術。流式細胞術具有操作簡便、結果相對準確的特點,目前越來越被廣泛應用于基因組大小的測定領域中。流式細胞術利用特定的熒光染料(PI、EB、AO等)與細胞核的DNA 堿基結合,被熒光染料染色的細胞核在激發光照射下發射出熒光,熒光強度與基因組大小成正比,進而可計算出基因組大小。本研究發現,膜莢黃芪的C值大于蒙古黃芪的C值,從基因組的角度進一步提示蒙古黃芪和膜莢黃芪在生物學上的差異。對于C值大小與物種進化的關系,起初認為進化程度越高C值應該越大,但是隨著研究的深入,逐漸發現普遍存在C值的大小與物種的進化程度之間沒有嚴格的對應關系,即“C值悖論”[24]。如非洲肺魚的C值是人類C值的41倍。在進化過程中植物基因組的多倍化和轉座子的積累是基因組增大的可能機制,反轉座子之間的同源不平等重組和非正規重組是基因組丟失的可能機制。如擬南芥基因組中就包含大量不完整的反轉座子序列,其反映了擬南芥DNA的丟失現象[25]。真核生物基因組中的DNA絕大部分是非編碼的DNA序列,非編碼的DNA序列就是指基因組中不編碼蛋白質的DNA序列,這些序列包括轉座子、內含子、啟動子、增強子、沉默子等區域。C值差異主要是源于非編碼DNA序列的差異,這也就解釋了基因組大小與進化程度無直接關系的原因[26]。因此,膜莢黃芪的C值大于蒙古黃芪的C值,并不能否認蒙古黃芪是膜莢黃芪的進化變種,源于可能存在“C值悖論”的現象。
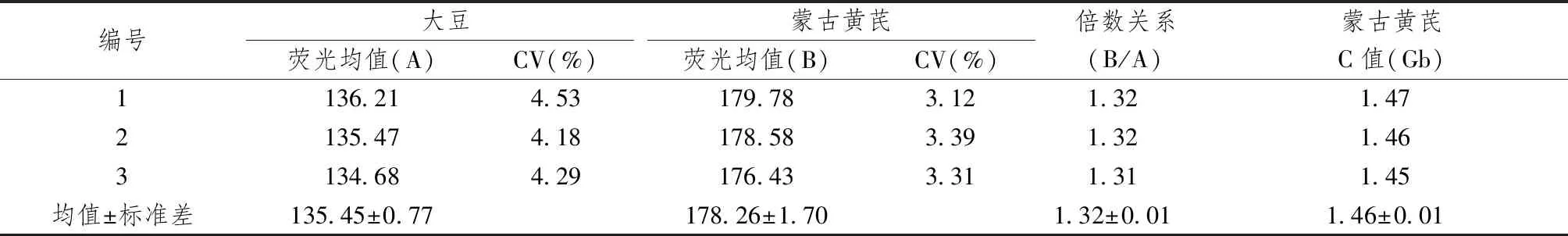
表1 蒙古黃芪C值測定結果比較
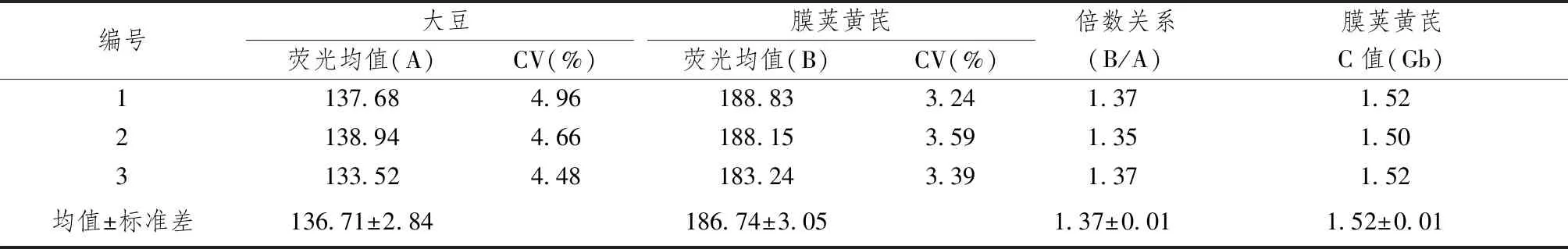
表2 膜莢黃芪C值測定結果比較

