近年化學反應機理圖示題例析
尉言勛 杜松庭
化學反應機理圖示題的考查最早出現在2014年全國卷第9題,考查H2O2的分解機理,后來出現在江蘇、浙江高考試題的非選擇題中,近幾年北京卷、新課標卷對基元反應及反應機理的考查逐年增多,比如2019新課標Ⅰ卷第28題,2018全國卷Ⅰ卷第28題、Ⅱ卷第8題均有考查。這類試題符合新課標的理念,“源于教材而高于教材”,體現了化學核心素養中的宏觀辨識與微觀探析,從不同層次認識物質的多樣性,以及由微觀和宏觀相結合的視角分析和解決實際問題,在備考過程中要給予高度重視與關注。
一、機理簡單介紹
1. 反應機理是用來描述某反應物到反應產物所經由的全部基元反應,就是把一個復雜反應分解成若干個基元反應,以圖示的形式來描述某一化學變化所經由的全部反應,然后按照一定規律組合起來,從而闡述復雜反應的內在聯系,以及總反應與基元反應內在聯系。
2. 反應機理詳細描述了每一步轉化的過程,包括過渡態的形成,鍵的斷裂和生成,以及各步的相對速率大小等。典型的是基元反應碰撞理論和基元反應過渡態理論。
3. 反應機理中包含的基元反應是單分子反應或雙分子反應。完整的反應機理需要考慮到反應物、催化劑、反應的立體化學、產物以及各物質的用量。
4. 認識化學反應機理,任何化合物的每一步反應都應該是在該條件下此類化合物的通用反應。
二、考查類型及典例解析
1. 水煤氣變換能壘圖的考查。
水煤氣變換反應常常借助于催化劑而進行。近年來整體式(構件型)蜂窩狀WGSR催化劑與負載型催化劑引起了人們極大興趣,尤其是負載金超微粒子催化劑。負載型金催化劑的突出特點是具有較高的低溫催化活性、較好的抗中毒性和穩定性,同時作為一種貴金屬催化劑,金催化劑的價格要遠遠低于鉑和鈀。某些性質上的突變使得高分散金催化劑的研究成為催化領域中一個新的熱點。
【例1】(2019·新課標Ⅰ,28節選)水煤氣變換[CO(g)+H2O(g)═CO2 (g)+H2 (g)]是重要的化工過程,主要用于合成氨、制氫以及合成氣加工等工業領域中。回答問題:
(3)我國學者結合實驗與計算機模擬結果,研究了在金催化劑表面上水煤氣變換的反應歷程,如圖1所示,其中吸附在金催化劑表面上的物種用*標注。
可知水煤氣變換的△H___0(填“大于”“等于”或“小于”),該歷程中最大能壘(活化能)E正=______eV,寫出該步驟的化學方程式______________________。

點評:本題涉及焓變大小、E正計算、書寫方程式,題目來源于我國科學家發表在頂級刊物Science中的文章“沉積在α-MoC上單層金原子對水煤氣的低溫催化反應”,試題以文章中的單原子催化能量變化的理論計算模型為情境,增強了試題的陌生度,起點高但落腳點低,讓學生認識、分析催化吸附機理及反應過程中的能量變化。注意:該歷程中最大能壘(活化能)E正,結合坐標信息計算和書寫反應化學方程式。
2. 有效碰撞理論的考查。
在化學反應中,反應物分子不斷發生碰撞,大多數碰撞無法發生反應,只有少數分子的碰撞才能發生化學反應,能發生有效碰撞的分子是活化分子。普通反應物分子形成活化分子所需要的能量叫活化能。而活化分子的碰撞也不一定都能發生有效碰撞。發生有效碰撞不僅有能量的因素,還有空間因素,只有同時滿足這兩者的要求才能發生有效碰撞。
(1)分子運動

解析:A. 第一步反應快,所以第一步的逆反應速率大于第二步的逆反應速率,故A正確;B. 根據第二步和第三步可知中間產物還有NO,故B錯誤;C. 根據第二步反應生成物中有NO2可知NO2與NO3的碰撞僅部分有效,故C正確;D. 第三步反應快,所以第三步反應的活化能較低,故D錯誤。
答案:A C
點評:本題類似于2014年新課標Ⅰ卷第9題,同樣給予了反應的機理,涉及反應速率快慢判斷、中間產物和活化能的分析等知識點,側重考查學生分析判斷能力,注意反應速率由慢反應決定。
3. 催化反應歷程。
化學反應中,反應分子原有的某些化學鍵,必須解離并形成新的化學鍵,這需要一定的活化能。在某些難以發生化學反應的體系中,加入有助于反應分子化學鍵重排的第三種物質(催化劑)其作用可降低反應的活化能。催化劑只能加速反應趨于平衡,不能改變反應的平衡常數。
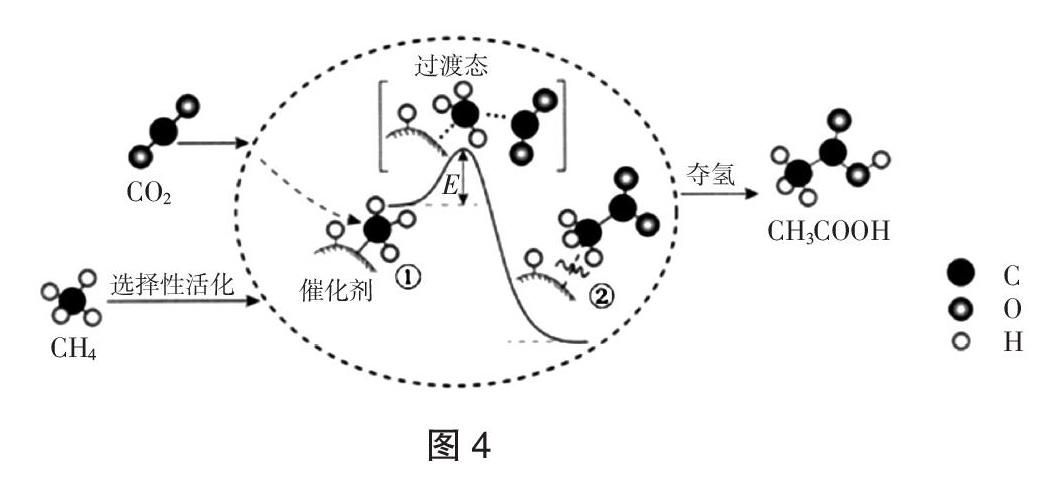
【例3】(2018·北京,7)我國科研人員提出了由CO2和CH4轉化為高附加值產品 CH3COOH的催化反應歷程。該歷程示意圖如圖4所示。

下列說法不正確的是(???? )
A. 生成CH3COOH總反應的原子利用率為100%
B. CH4→CH3COOH過程中,有C-H鍵發生斷裂
C. ①→②放出能量并形成了C-C鍵
D. 該催化劑可有效提高反應物的平衡轉化率
解析:A. 圖中分析,1mol甲烷和1mol二氧化碳反應生成1mol乙酸,原子利用率為100%,故A正確;B. 由圖中信息甲烷在催化劑作用下經過選擇性活化,甲烷分子中碳原子會與催化劑形成新的共價鍵,必有C-H鍵發生斷裂,故B正確;C. ①→②的焓值降低,為放熱過程,有C-C鍵形成,故C正確;D. 催化劑只加快反應速率,不改變化學平衡轉化率,故D錯誤。
答案:D
點評:本題涉及基元反應的過渡態理論,考查學生提取圖表信息的能力,以及轉化信息、應用信息的能力。注意題干信息的理解應用,通過分析化學反應過程,反應過程中催化劑的作用和能量變化、化學鍵的變化,間接實現對化學素養的考查。
4. 霧霾中的反應機理。
所謂灰霾天氣,就是指由于空氣中含有的氮氧化物、顆粒物的總量過大,導致空氣能見度偏低,大氣中出現渾濁。霾的本質則是“細粒子污染”,形成的主要原因則是工業廢氣,汽車尾氣中的污染物質經過一系列化學反應,造成二次污染,散播到大氣中的塵埃、硫酸顆粒、硝酸顆粒、有機碳氫化合物等粒子懸浮在空中,從而使大氣變得混濁,造成能見度偏差。
【例4】(2018·海南,12)(4分)炭黑是霧霾中的重要顆粒物,研究發現它可以活化氧分子,生成活化氧。活化過程的能量變化模擬計算結果如圖5所示。活化氧可以快速氧化SO2 。下列說法正確的是(????? )

A. 每活化一個氧分子吸收0.29eV能量
B. 水可使氧分子活化反應的活化能降低0.42eV
C. 氧分子的活化是O-O的斷裂與C-O鍵的生成過程
D. 炭黑顆粒是大氣中SO2轉化為SO3的催化劑
解析:A. 由圖中信息,最終結果為活化氧,體系能量降低,則每活化一個氧分子放出0.29eV能量,故A錯誤;B. 根據能量圖分析,沒有水加入的反應活化能為E=0.75eV,有水加入的反應的活化能為E=0.57eV,所以活化能降低0.75eV-0.57eV=0.18eV,故B錯誤;C. 根據圖像分析,氧分子活化過程O-O鍵斷裂,生成C-O鍵,故C正確;D. 由題意活化氧可以快速氧化SO2,而炭黑顆粒可以活化氧分子產生活化氧,故D正確。
答案:C D
點評:本題考查催化反應過程機理的分析,催化劑可以改變反應歷程,降低反應活化能,加快化學速率,明確多步反應歷程中最大的活化能為整個反應的活化能是解題關鍵,整體難度中等。
【例5】(2018·新課標Ⅱ,8)研究表明,氮氧化物和二氧化硫在形成霧霾時與大氣中的氨有關(如圖6所示)。下列敘述錯誤的是

A. 霧和霾的分散劑相同
B. 霧霾中含有硝酸銨和硫酸銨
C. NH3是形成無機顆粒物的催化劑
D. 霧霾的形成與過度施用氮肥有關
解析:A. 霧的分散質是水,霾的分散質是固體顆粒,但其分散劑均為空氣,A正確;B. 如圖中信息所示,氮氧化物和二氧化硫轉化為銨鹽形成無機顆粒物,B正確;C. 氨氣是反應物,參與了反應,不符合催化劑的定義,C錯誤;D. 過度施用氮肥會導致大氣中氨氣的含量增加,更利于生成無機顆粒物,因此霧霾的形成與過度施用氮肥有關,D正確。
答案:C
點評:題目以霧霾形成機理的最新研究成果為素材,考查霧霾形成過程中無機顆粒物的化學基本概念,涉及分散系、霧霾成份霧霾的催化過程和機理,圖中展示了氮元素及其化合物的相互轉化。側重考查學生利用所學化學知識分析環境污染的原因,體現化學在生態環境和污染治理的巨大作用,化學在推進生態文明建設、解決生態環境問題等方面的貢獻。
5. Bormi-Haber循環。
玻恩-哈伯循環是一種用于計算反應熱的方法,由德國科學家馬克斯·玻恩和弗里茨·哈伯發明。有時反應熱很難或甚至無法直接測出,但根據蓋斯定律,反應熱的大小與反應物及生成物的初狀態與末狀態有關,與反應的途徑無關,因此如果能夠測出各個反應途徑的反應熱,那么原反應的反應熱也就可以計算出來了。
【例6】(2018·新課標Ⅰ,28節選)Li是最輕的圓體金屬,采用Li作為負極材料的電池具有小而輕、能量密度大等優良性能,得到廣泛應用。回答下列問題:
(4)Li2O是離子晶體,其晶格能可通過圖7(a)的Bormi-Haber循環計算得到。

可知,Li原子的第一電離能為________kJ·mol-1,O=O鍵鍵能為_______kJ·mol-1,Li2O晶格能為________kJ·mol-1。
解析:(4)Li原子的第一電離能為氣體基態鋰原子失去1個電子所需要的能量,所以其第一電離能為kJ/mol=520kJ/mol;O=O鍵鍵能為將1mol O2分(g)解離為2mol 氧原子(g)所需能量,其鍵能等于2×249kJ/mol=498kJ/mol;晶格能是氣態離子形成1mol離子晶體釋放的能量,所以其晶格能為2908kJ/mol。
答案:520;498;2908
點評:本題是2018 年新課標Ⅰ卷結構考查的創新點,題目給出氧化鋰晶體的能量變化圖,考查學生運用所學知識,結合電離能、鍵能以及晶格能等基本概念,閱讀、提取和分析應用 Born-Haber 循環給出的能量變化數據,解答實際問題的能力。
6. 加成反應機理的考查。
有機分子中鍵能小、極性大、位阻小的部分,一般優先發生化學反應,產物以能量最低、最穩定的產物為主。有機分子中官能團能夠體現化學反應的基本原理,所以加成反應中碳碳雙鍵是反應的關鍵所在。
【例7】(原創) 1,3—丁二烯烴與HBr的 1,2 和 1,4 加成是高中有機學習中一個易混淆的概念,學生常把它混淆為2個反應,其實這是一個反應的2種取向,因為它們的反應機理、反應中間體是相同的,只是取向不同而已。其反應機理如圖8所示,下列說法不正確的是(???? )
已知:“游離基”,是指化合物的分子在光熱等外界條件下,共價鍵發生均裂而形成的具有不成對電子的原子或基團。
A. 1,3-丁二烯與H+ 作用后生成了一個具有共軛體系的三中心兩電子的烯丙基型碳正離子
B. 該反應不可能產生 1,3 加成,因為 2,4雙游離基是不穩定產物
C. 無論溫度是否發生明顯變化,2種產物均同時產生,且沒有主次取向
D. 1,3-丁二烯與HI也可以發生1,2 和 1,4 加成
解析:鹵素負離子對共軛的烯丙基型碳正離子的2號位進攻則生成1,2加成產物,鹵素負離子對共軛的烯丙基型碳正離子的 4 號位進攻則生成 1,4 加成產物,不可能發生1,3加成,A、B項正確;1,2-和1,4-加成產物的比例不僅受共軛二烯結構的影響,也隨溫度、溶劑和催化劑體系等的改變而改變,C項不正確;HI與HBr結構相似,可以與1,3—丁二烯發生1,2 和 1,4 加成,得到兩種反應產物,D項正確。
答案:C
點評:有機化學反應的本質是原物質化學鍵的斷裂和新物質化學鍵的生成,遵從質量守恒和能量守恒、能量越低越穩定原則。影響共軛二烯烴加成反應的因素主要有鍵能的大小、極性的強弱以及發生化學反應的空間位阻大小3個方面。本題側重考查學生結合選項對反應機理圖形的分析,引導學生了解兩種加成的反應機理、反應中間體是相同的,只是取向不同,側重考查學生的分析判斷能力。
總之,對反應機理的考查看上去很“高大上”,從而使學生形成畏難情緒。如果學生可以克服畏難心理,憑借扎實的基礎知識和沉著冷靜的心態讀題審題,將題中信息與已有知識緊密結合,學生就會發現問題的落腳點往往是考查讀取圖表信息的能力以及利用題目給予的新信息解決問題的能力。解答時應結合反應歷程示意圖,從題目提取出隱含的信息,進而解決問題。
責任編輯?? 李平安

