枯草芽孢桿菌Prob1822復合抗熱保護劑的研究
肖懷秋 ,李玉珍,林親錄,趙謀明,劉 軍,周 全,姜明姣
(1.湖南化工職業(yè)技術學院 制藥與生物工程學院,湖南 株洲 412000;2.中南林業(yè)科技大學 食品科學與工程學院,湖南 長沙 410004;3.華南理工大學 食品科學與工程學院,廣東 廣州 510640;4.湖南中威制藥有限公司,湖南 株洲 412000)
枯草芽孢桿菌(Bacillus subtilis)具有調(diào)節(jié)腸道菌群失衡、增強免疫和安全性高等優(yōu)點,是一種理想的益生菌[1],其活菌制劑口服液可用于腸炎和腹瀉等疾病及燒傷感染的治療[2-4]。近年來,益生菌固態(tài)制劑因儲存運輸、質(zhì)量控制及生產(chǎn)便捷而受到廣泛關注。然而,關于高生物活性和高存活率的固態(tài)制劑的保存鮮見報道[5]。噴霧干燥因熱干燥時間短、料液溫度低和生物活性損失小而廣泛應用于益生菌菌體干燥[6-7],但噴霧干燥大規(guī)模制備高活性益生菌固體制劑的抗熱性保護研究較少[8],研制高活性益生菌固態(tài)制劑的關鍵就是抗熱保護劑的選擇與使用[9],常用保護劑有低聚糖、糖醇、蛋白質(zhì)、多肽和多糖等[10]。保護劑的使用能減輕噴霧干燥熱損傷和脫水干燥對亞細胞結構與胞內(nèi)生物大分子及細胞器的破壞[6]。低聚糖等小分子保護劑為多羥基化合物,具有很好的親水性,可與細胞膜磷脂或蛋白質(zhì)極性基團形成氫鍵或水化層,保護細胞膜、細胞器膜及胞內(nèi)生物大分子結構的完整性,而蛋白質(zhì)等大分子保護劑則主要通過“包埋”形成天然“隔熱屏障”,兩種保護劑的保護機制不同,可聯(lián)合使用[11]。研究表明,單一保護劑相比未添加保護劑能增強益生菌菌體熱耐受性,復合保護劑抗熱保護效果更好[12]。范娜等[8]研究發(fā)現(xiàn),保護劑之間存在協(xié)同作用,復合使用抗熱保護效果更好;JACQUELINE A等[13]研究發(fā)現(xiàn),蔗糖或海藻糖能提高保加利亞乳桿菌(L.bulgaricus)菌體存活率,復合型保護劑能將菌體存活率提高780倍[14];ZDENEK H等[9,15]等研究表明,蛋白質(zhì)比糖類抗熱保護效果要好,兩者聯(lián)用抗熱保護效果更佳;ANANTA E等[16]也認為復合保護劑能提高益生菌存活率。
本試驗以枯草芽孢桿菌(Bacillus subtilis)Prob1822為研究對象,研究了熱誘激溫度與時間對枯草芽孢桿菌噴霧干燥菌體存活影響,確定了熱誘激處理條件;研究單一抗熱保護劑對菌體存活率的影響,優(yōu)選單一抗熱保護劑;以穩(wěn)定期菌體存活率為評價指標,采用中心組合設計(central composite design,CCD)響應面法優(yōu)化技術對海藻糖、蔗糖和脫脂奶粉復配的復合抗熱保護劑的配方,旨在可為枯草芽孢桿菌的噴霧干燥提供理論與技術支持。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
枯草芽孢桿菌(Bacillus subtilis)Prob1822:湖南化工職業(yè)技術學院生物技術實驗室保藏。
1.1.2 化學試劑
牛肉膏、胰蛋白胨(均為生化試劑):北京博星生物技術有限公司;瓊脂粉(生化試劑):天津市致遠化學試劑有限公司;海藻糖(食品級):海北鵬宇生物科技有限公司;甘露醇、麥芽糖(均為食品級):鄭州百思特食品添加劑有限公司;山梨醇(食品級):江蘇采薇生物科技股份有限公司;乳糖(食品級):鄭州裕和食品添加劑有限公司;脫脂奶粉(食品級):伊利集團;乳清粉(食品級):河北鵬宇生物科技有限公司;大豆分離蛋白(食品級):山西中諾生物科技有限公司;蔗糖(食品級):市售;其他試劑均為國產(chǎn)分析純。
1.1.3 培養(yǎng)基
牛肉膏蛋白胨培養(yǎng)基:牛肉膏3.0 g/L、蛋白胨10.0 g/L、NaCl 5.0 g/L、水1 000 mL,pH 7.0,121 ℃滅菌20 min。
牛肉膏蛋白胨瓊脂培養(yǎng)基:在上述培養(yǎng)基中添加2%瓊脂,121 ℃滅菌20 min。
發(fā)酵培養(yǎng)基:冷榨花生粕蛋白胨(自制)12 g/L、酵母膏5 g/L、NaCl 5 g/L,pH 7.4,121 ℃滅菌20 min。
1.2 儀器與設備
DK-98-11A型電熱恒溫水浴箱:天津市泰斯特儀器有限公司;UV-2500紫外可見分光光度計:日本島津公司;PHS-3C型pH計:上海雷磁儀器廠;AL204分析天平:瑞士梅特勒-托利多公司;BBS-SSC超凈工作臺:濟南騰覽儀器有限公司;DH-360電熱恒溫培養(yǎng)箱:北京科偉永興儀器有限公司;LDZX-50FAS立式壓力蒸汽滅菌器:上海申安醫(yī)療器械廠;KRH-PJ-10L發(fā)酵罐:江蘇鎮(zhèn)江科海生物工程設備有限公司;SP-1500噴霧干燥機:上海順儀實驗設備有限公司。
1.3 方法
1.3.1 噴霧干燥菌體的制備
(1)菌種活化與種子液制備
將冷凍保存(-18 ℃)的枯草芽孢桿菌(Bacillus subtilis)Prob1822轉接于斜面牛肉膏蛋白胨瓊脂培養(yǎng)基中,37 ℃恒溫培養(yǎng)24 h;活化完成后,用接種環(huán)從斜面刮取兩環(huán)菌種接種至牛肉膏蛋白胨培養(yǎng)基中,裝瓶量為100 mL/250 mL,37 ℃、120 r/min恒溫振蕩培養(yǎng)24 h,得菌株Prob1822種子液。
(2)菌體生長曲線繪制
按5%(V/V)接種量將種子液接種于發(fā)酵罐中,補充發(fā)酵罐裝液量至7 L,37 ℃、120 r/min恒溫培養(yǎng)48 h,每間隔2 h取出適量發(fā)酵液于波長600 nm處測定吸光度值,記為A600nm,以培養(yǎng)時間(h)為橫坐標,以吸光度值A600nm為縱坐標繪制菌體生長曲線,確定菌體遲緩期、對數(shù)生長期、穩(wěn)定期及衰亡期。
(3)噴霧干燥菌懸液的制備
收集培養(yǎng)至穩(wěn)定期(26 h)的發(fā)酵液,于4 000 r/min條件下離心15 min,棄上清液,沉淀用無菌水洗滌并重新懸浮,操作重復3次。用無菌水重新懸浮菌體制備噴霧干燥用菌懸液。
(4)噴霧干燥
制備的菌懸液先進行熱誘激預處理(55 ℃熱預處理10 min),根據(jù)抗熱保護劑試驗設計方案,按預定比例加入保護劑,充分溶解后作為噴霧干燥用菌懸液,并將含有抗熱保護劑的益生菌懸液(100 mL)加入到噴霧干燥設備中進行噴霧干燥。噴霧干燥條件為進風溫度90 ℃、進料速率500 mL/h、通風量60 m3/h、出口溫度50 ℃,干燥時間1.5 s,得到枯草芽孢桿菌(Bacillus subtilis)Prob1822益生菌粉劑。
1.3.2 熱誘激處理
為提高菌體熱耐受性和保持較高菌體存活率,取對數(shù)生長早期(8 h)、中期(16 h)、末期(20 h)和穩(wěn)定期(26 h)的菌體100 mL于三角瓶中,分別于50 ℃、55 ℃、60 ℃和65 ℃的恒溫水浴鍋中進行熱誘激處理10 min、30 min和60 min,熱誘激處理完成后隨即進行噴霧干燥。以噴霧干燥后菌體存活率為評價指標,確定最佳熱誘激溫度與熱誘激時間。
1.3.3 活菌總數(shù)測定與菌體存活率計算
噴霧干燥前總活菌數(shù)測定方法:準確移取1.0 mL噴霧干燥用菌懸液,用無菌水進行梯度稀釋(10-4~10-6),吸取0.1 mL菌懸液傾入牛肉膏蛋白胨瓊脂平板上,涂布均勻后于37 ℃倒置培養(yǎng)48 h,記錄培養(yǎng)皿上長出的菌落數(shù)(CFU),計算噴霧干燥的活菌總數(shù)(N)。
噴霧干燥后活菌總數(shù)測定方法:準確稱取1.00 g噴霧干燥后的益生菌菌粉用9 mL無菌水充分混勻溶解,系列梯度稀釋(10-7~10-9)后選取3個相鄰稀釋度的菌液0.1 mL傾入牛肉膏蛋白胨瓊脂平板上,涂布均勻后于37 ℃倒置培養(yǎng)48 h,記錄培養(yǎng)皿上菌落數(shù)(CFU),計算噴霧干燥后活菌總數(shù),其公式如下:
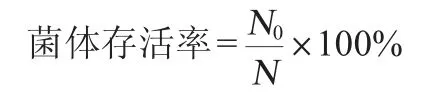
式中:N0為噴霧干燥后活菌總數(shù),CFU/g;N為噴霧干燥前益生菌菌粉中的活菌總數(shù),CFU/g。
1.3.4 抗熱保護劑的優(yōu)選
(1)單一抗熱保護劑優(yōu)化的單因素試驗
在查閱文獻[6,8,17-18]基礎上,選取糖和蛋白質(zhì)作為抗熱保護劑。糖類保護劑包括海藻糖、甘露醇、山梨醇、乳糖、麥芽糖和蔗糖,蛋白質(zhì)類保護劑包括脫脂奶粉、乳清粉、大豆蛋白和蛋清粉。各保護劑均設置2%、5%和8%三個水平,以菌體存活率為評價指標,對每個抗熱保護劑菌體存活最高的組和不加任何抗熱保護劑的對照組(CK)進行均數(shù)差異多重比較。選擇菌體存活率較高的抗熱保護劑繼續(xù)進行響應面優(yōu)化。
(2)抗熱保護劑配方優(yōu)化響應面試驗
利用中心組合設計(CCD)響應面法優(yōu)化復合抗熱劑配方[19],各因素設計5個水平,即±r(上下星號臂),±1(上下水平點)和0(本試驗中心點設置6個)。研究海藻糖添加量(X1)、蔗糖添加量(X2)和脫脂奶粉添加量(X3)對菌體存活率(Y)的影響。響應面優(yōu)化試驗因素、水平與編碼如表1所示。

表1 響應面試驗因素與水平Table 1 Factors and levels of response surface experiments
1.3.5 數(shù)據(jù)處理方法
試驗結果表示為平均值±標準差(±s)(n=3)。采用SPSS Statistics25進行單因素方差分析,選用最小顯著性差異法(least significant difference,LSD)檢驗進行均值多重比較,顯著性水平選用α=0.05;P<0.05為差異顯著,P>0.05為差異不顯著。均數(shù)多重比較僅比較每種單一保護劑中菌體存活率最高的一組與沒有添加保護劑的對照組的差異顯著性。
2 結果與分析
2.1 菌體生長曲線測定
按5%(V/V)接種量將種子液接種于發(fā)酵罐中,37 ℃、120 r/min恒溫培養(yǎng)48 h,每隔2 h取樣測定菌液在波長600 nm處的吸光度值(A600nm),以培養(yǎng)時間(h)為橫坐標、A600nm為縱坐標繪制菌體生長曲線,結果如圖1所示。

圖1 枯草芽孢桿菌Prob1822生長曲線Fig.1 Growth curve of Bacillus subtilis Prob1822
由圖1可以看出,0~4 h內(nèi)菌體數(shù)量增長較為緩慢,為滯后期;6~20 h內(nèi)菌體增長速度較快,為對數(shù)生長期。其中8 h為對數(shù)生長早期,16 h為對數(shù)生長中期,20 h為對數(shù)生長末期。20 h之后菌體增長速率放緩,進入穩(wěn)定期。菌體培養(yǎng)30 h以后數(shù)量呈下降趨勢,特別是培養(yǎng)36 h后菌體進入衰亡期。為系統(tǒng)研究熱誘激處理對不同生長階段菌體的菌體存活率影響,選擇對數(shù)生長早期(8 h)、中期(16 h)、末期(20 h)及穩(wěn)定期(26 h)進行熱誘激處理,以提高菌體的熱耐受性和菌體存活率。
2.2 熱誘激處理對菌體存活率的影響
試驗考察不同熱誘激溫度(50 ℃、55 ℃、60 ℃、65 ℃)和熱誘激時間(10 min、30 min、60 min)對枯草芽孢桿菌對數(shù)早(8 h)、中期(16 h)、末期(20 h)和穩(wěn)定期(26 h)菌體存活率的影響,結果如圖2所示。
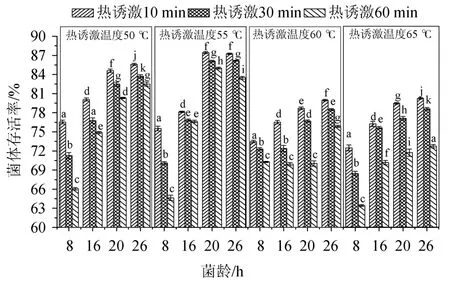
圖2 熱誘激處理對菌體存活率的影響Fig.2 Effect of thermal-inducible shock treatment on cell survival rate
由圖2可以看出,在同一熱誘激溫度條件下,不同菌齡間的菌體存活率均存在顯著差異(P<0.05)。熱誘激溫度為50 ℃時,穩(wěn)定期(26 h菌齡)菌體熱耐受性最好,特別是穩(wěn)定期菌體熱誘激處理10 min的樣本菌體存活率最高(85.59±0.17)%,與熱誘激30 min(83.73±0.26)%和60min(82.50±0.31%)的菌體存活率存在顯著差異(P<0.05);熱誘激溫度為55 ℃時,對數(shù)生長末期(20 h)和穩(wěn)定期(26 h)菌齡熱誘激10 min和30 min時,菌體存活率差異不顯著(P>0.05),但熱誘激處理60 min時,存在顯著差異(P<0.05);對數(shù)生長末期與穩(wěn)定期菌株熱誘激10 min時菌體存活率分別為(87.46±0.15)%和(87.26±0.11)%,差異不顯著(P>0.05);當熱誘激溫度為60 ℃和65 ℃時,熱誘激10 min的穩(wěn)定期菌體存活率均最高,分別為(79.96±0.13)%和(80.27±0.13)%,與對數(shù)生長早、中期的不同熱誘激時間的樣本的菌體存活率均存在顯著差異(P<0.05)。
對于相同菌齡的菌體在不同熱誘激溫度條件下(熱誘激時間相同),50 ℃和55 ℃溫度條件下菌體存活率相對較高,特別是熱誘激溫度為55 ℃時菌體熱耐受性最好,菌體存活率最高(87.26±0.11%)。55 ℃熱誘激30 min和60 min后,菌體存活率分別為降至(86.18±0.06)%和(83.50±0.23)%,差異顯著(P<0.05);當熱激溫度達60 ℃和65 ℃時,菌體熱耐受性變差,菌體存活率較低,該研究結果與TEIXEIRA P等[20]結論一致。因此,熱誘激溫度和熱誘激時間的優(yōu)選對于提高菌體熱耐受性和菌體存活率極為重要。熱誘激處理能增強菌體熱耐熱性主要是由于熱誘激處理可誘導菌體產(chǎn)生高度保守熱應激蛋白,并作為分子伴侶參與蛋白質(zhì)合成、折疊、裝配、運輸和降解等生化過程,激發(fā)益生菌逆境下的熱抵抗力[21-23]。
由圖2還可看出,相同熱激溫度條件下對數(shù)生長末期(20 h)和穩(wěn)定期(26 h)菌體熱耐受性相對較好,對數(shù)生長早期和中期熱耐受性相對較差[24]。可能是因為處于對數(shù)生長早、中期的細胞菌體代謝非常活躍,胞內(nèi)細胞器和生物大分子對熱更趨敏感,特別是在熱誘激溫度較高(如>60 ℃)時,對枯草芽孢桿菌細胞器及胞內(nèi)生物大分子產(chǎn)生熱損傷。考慮到后續(xù)的噴霧干燥過程中熱損傷和脫水干燥可能對益生菌菌體的亞細胞結構和胞內(nèi)生物大分子或細胞器的可逆或不可逆損傷[6,23-24]和保持較高的菌體存活率,本試驗選擇穩(wěn)定期菌株進行熱誘激處理,熱誘激參數(shù)為55 ℃、10 min。
2.3 抗熱保護劑優(yōu)化的單因素試驗
考察了糖類和蛋白質(zhì)類抗熱保護劑對菌體存活率的影響,以未添加抗熱保護劑的菌體存活率作對照,結果如圖3所示。
由圖3可以看出,糖類保護劑與對照相比均存在顯著性差異(P<0.05),說明糖類保護劑對菌體均存在較好的抗熱保護作用。在不同保護劑添加量的對比試驗中,以8%海藻糖、5%蔗糖、8%甘露醇、8%山梨醇和5%麥芽糖試驗條件下菌體存活率相對較高,特別是8%海藻糖和5%蔗糖條件下菌體存活率最高,分別為(80.92±0.17)%和(80.29±0.46)%,差異不顯著(P>0.05),但顯著高于其他糖類保護劑(P<0.05);甘露醇組(8%)、山梨醇組(8%)和麥芽糖組(5%)組間菌體存活率差異不顯著(P>0.05),與乳糖組(5%)有顯著差異(P<0.05)。因此,選擇海藻糖和蔗糖進行后續(xù)響應面法優(yōu)化。糖類保護劑對菌體能實現(xiàn)抗熱保護的原因是因為糖類物質(zhì)主要通過結構中的羥基與細胞膜、細胞器膜或蛋白質(zhì)極性基團形成眾多氫鍵或在蛋白質(zhì)表面形成水化層,從而保護細胞(器)膜及蛋白質(zhì)生物大分子的結構穩(wěn)定性[14,25]。如海藻糖化學結構中的羥基可以極性基團形成氫鍵,代替極性基團周圍丟失的水分子,形成水化層,維持生物大分子天然結構與細胞(器)膜的完整性[8,18],糖類保護劑還可起到滲透保護[25]。

圖3 單一抗熱保護劑對枯草芽孢桿菌Prob1822菌體存活率的影響Fig.3 Effect of single anti-thermal protectant on cell survival rate of Bacillus subtilis Prob1822
由圖3還可知,蛋白質(zhì)類抗熱保護劑與對照組相比也存在顯著差異(P<0.05),其中,以脫脂奶粉(5%)菌體存活率最高(81.36±0.23)%,與其他蛋白質(zhì)類保護劑存在顯著性差異(P<0.05);乳清粉組(5%)、大豆蛋白組(5%)和蛋清粉組(5%)組間差異不顯著(P>0.05)。因此,選擇脫脂奶粉進行后續(xù)響應面優(yōu)化。蛋白質(zhì)類保護劑對菌體實現(xiàn)抗熱保護的原因主要是通過“包埋”在菌體表面形成“隔熱屏障”實現(xiàn)抗熱保護[11]。脫脂奶粉的多孔結構可使菌體干燥過程中失水更容易[26]。
糖類保護劑與蛋白質(zhì)類保護劑相比,脫脂奶粉(5%)與海藻糖(8%)和蔗糖(5%)差異不顯著(P>0.05),均可以對枯草芽孢桿菌實現(xiàn)較好的抗熱保護并保持較高的菌體存活率。糖類和蛋白質(zhì)類抗熱保護劑的抗熱保護機制不同,兩者聯(lián)用能起到更好的抗熱保護[6,8,22]。鑒于脫脂奶粉、蔗糖和海藻糖組菌體存活率相對較高,且糖類與蛋白質(zhì)類保護劑的抗熱保護機制不同,為充分發(fā)揮復合抗熱保護劑的保護效果,選擇海藻糖、蔗糖和脫脂奶粉聯(lián)用作為復合抗熱保護劑,以進一步提高對菌體的抗熱保護效果。
2.4 復合抗熱保護劑的響應面優(yōu)化
基于單因素試驗結果,以菌體存活率(Y)為響應值,應用響應面法優(yōu)化技術對海藻糖添加量(X1)、蔗糖添加量(X2)和脫脂奶粉添加量(X3)進行配方優(yōu)化。響應面試驗設計與試驗結果見表2,方差分析結果見表3。

表2 響應面優(yōu)化試驗設計與結果Table 2 Design and results of response surface methodology
對表2數(shù)據(jù)通過Design-Expert 10.0分析軟件進行響應面分析,建立多元二次回歸方程:Y=94.22+6.53X1+3.80X2+2.01X3-3.56X1X2+0.22X1X3-2.09X2X3-8.01X12-5.32X22-0.89X32。

表3 回歸模型方差分析Table 3 Variance analysis of regression model
由表3可看出,模型極顯著(P<0.01),失擬項P=0.835 1>0.05,不顯著,表明回歸方程擬合程度良好,可用此模型對響應值進行分析和預測。模型信噪比(signal to noise ratio,SNR)是評價和應用模型進行數(shù)據(jù)擬合和評價結果預測受干擾的程度,常要求SNR>4[19]。本模型SNR=45.497>4,說明模型抗干擾較好;模型變異系數(shù)(coefficient of variation,CV)是衡量模型精密度和可靠性的重要評價指標,數(shù)值越小表示模型精密度越高,本模型=1.27%,表明模型可靠。模型決定系數(shù)R2=0.994 8,表明模型在99.48%程度上能夠解釋菌體存活率與各因素變量之間的關系,而調(diào)整決定系數(shù)R2adj=0.990 1,表明模型預測值與實際值具有較好的相關性。各階系數(shù)顯著性分析發(fā)現(xiàn),模型一次項X1,X2,X3、交互作用項X1X2,X2X3以及二次項X12,X22對結果影響極顯著(P<0.01),交互項X1X3影響不顯著(P>0.05),二次項X32影響顯著(P<0.05)。
觀察兩因素交互作用對響應值的影響可采用降維分析(dimension reduction analysi,DRA),即其他因素保持在零水平情況下,觀察兩個因素交互作用對響應值的影響并得到其響應面及等高線見圖4。由圖4可以看出,交互作用項X1X2,X2X3影響顯著,而X1X3影響不顯著。

圖4 海藻糖、蔗糖和脫脂奶粉添加量交互作用對菌體存活率影響的響應面及等高線Fig.4 Response surface plots and contour lines of interaction between trehalose,sucrose and skimmed milk powder addition on cell survival rate
將回歸方程分別對各自變量求偏導數(shù)并令其等于零,聯(lián)立可得到三元一次方程組,通過規(guī)劃求解可求出回歸方程編碼水平最優(yōu)解,即X1=0.41,X2=0.02,X3=1.00,對應因素實際水平為海藻糖8.975 8%、蔗糖5.023 8%及脫脂奶粉6.78%。為操作方便,將各保護劑添加量修正為海藻糖9.0%、蔗糖5.0%和脫脂奶粉6.8%。在此最優(yōu)條件下進行3次驗證試驗,菌體存活率為(95.24±0.84)%,與模型預測值96.762 1%接近。
3 結論
研究發(fā)現(xiàn),熱誘激處理能提高菌體的熱耐受性和菌體存活率,最佳熱誘激條件為穩(wěn)定期菌體55 ℃熱處理10 min;糖類保護劑中以8%海藻糖與5%蔗糖抗熱保護效果較好;蛋白質(zhì)類抗熱保護劑以5%脫脂奶粉抗熱保護效果較好。采用中心組合設計響應面優(yōu)化技術研究了海藻糖(X1)、蔗糖(X2)和脫脂奶粉(X3)聯(lián)用作為復合抗熱保護劑對菌體存活率的影響,并對復合抗熱保護劑配方進行了優(yōu)化,獲得了優(yōu)化的抗熱保護劑組分,即海藻糖添加量9.0%、蔗糖添加量5.0%和脫脂奶粉添加量6.8%。在此最優(yōu)條件下,菌體存活率為(95.24±0.84)%,與模型預測值96.762 1%接近。研究結果表明,糖類保護劑與蛋白質(zhì)類保護劑聯(lián)用作為復合抗熱保護劑比單一保護劑抗熱保護效果更好,可較好的實現(xiàn)對益生菌枯草芽孢桿菌的抗熱保護,能較好的提高菌體的熱耐受性。

