2019年高考含量類計算題剖析
云南
通過對2019年全國卷Ⅰ、全國卷Ⅱ、全國卷Ⅲ、北京卷、天津卷、江蘇卷六套高考化學試卷上含量類型計算題的分析可以看出,這種類型的計算題是高考必考的綜合類核心計算題。含量類計算題對化學系統知識的掌握和綜合計算能力要求較高,但分值也就是2~3分,被稱為高考化學中的“雞肋”——棄之可惜,食之無味。本文對含量類型的綜合計算題從所需的化學系統知識和綜合計算能力的培養兩個方面進行剖析,望對讀者有所幫助。
一、2019年含量類計算高考真題
【例1】(2019·全國卷Ⅰ·27·節選)硫酸鐵銨[NH4Fe(SO4)2·xH2O]是一種重要鐵鹽。為充分利用資源,變廢為寶,在實驗室中探究采用廢鐵屑來制備硫酸鐵銨,具體流程如下(略)。回答下列問題:
(5)采用熱重分析法測定硫酸鐵銨晶體樣品所含結晶水數,將樣品加熱到150℃時失掉1.5個結晶水,失重5.6%。硫酸鐵銨晶體的化學式為________。
【例2】(2019·全國卷Ⅱ·26·節選)立德粉ZnS·BaSO4(也稱鋅鋇白),是一種常用白色顏料。回答下列問題:

【例3】(2019·全國卷Ⅲ·27·節選)乙酰水楊酸(阿司匹林)是目前常用藥物之一。實驗室通過水楊酸進行乙酰化制備阿司匹林的一種方法如下:
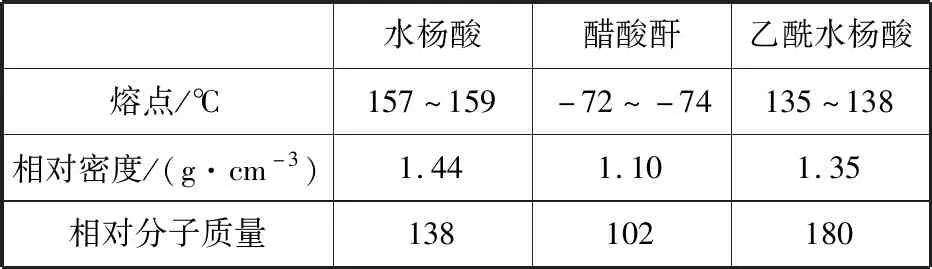
水楊酸醋酸酐乙酰水楊酸熔點/℃157~159-72~-74135~138相對密度/(g·cm-3)1.441.101.35相對分子質量138102180
實驗過程:在100 mL錐形瓶中加入水楊酸6.9 g及醋酸酐10 mL,充分搖動使固體完全溶解。緩慢滴加0.5 mL濃硫酸后加熱,維持瓶內溫度在70℃左右,充分反應。稍冷后進行如下操作。
①在不斷攪拌下將反應后的混合物倒入100 mL冷水中,析出固體,過濾。
②所得結晶粗品加入50 mL飽和碳酸氫鈉溶液,溶解、過濾。
③濾液用濃鹽酸酸化后冷卻、過濾得固體。
④固體經純化得白色的乙酰水楊酸晶體5.4 g。
回答下列問題:
(6)本實驗的產率是________%。
【例4】(2019·北京卷·26·節選)化學小組用如下方法測定經處理后的廢水中苯酚的含量(廢水中不含干擾測定的物質)。
Ⅰ.用已準確稱量的KBrO3固體配制一定體積的amol·L-1KBrO3標準溶液;
Ⅱ.取v1mL上述溶液,加入過量KBr,加H2SO4酸化,溶液顏色呈棕黃色;
Ⅲ.向Ⅱ所得溶液中加入v2mL廢水;
Ⅳ.向Ⅲ中加入過量KI;
Ⅴ.用bmol·L-1Na2S2O3標準溶液滴定Ⅳ中溶液至淺黃色時,滴加2滴淀粉溶液,繼續滴定至終點,共消耗Na2S2O3溶液v3mL。
已知:I2+2Na2S2O3=2NaI+Na2S4O6
Na2S2O3和Na2S4O6溶液顏色均為無色
(7)廢水中苯酚的含量為________g·L-1(苯酚摩爾質量:94 g·mol-1)。
【例5】(2019·天津卷·9·節選)Ⅱ.環己烯含量的測定
在一定條件下,向ag環己烯樣品中加入定量制得的bmol Br2,與環己烯充分反應后,剩余的Br2與足量KI作用生成I2,用cmol·L-1的Na2S2O3標準溶液滴定,終點時消耗Na2S2O3標準溶液vmL(以上數據均已扣除干擾因素)。
測定過程中,發生的反應如下:



(5)滴定所用的指示劑為淀粉溶液。樣品中環己烯的質量分數為________(用字母表示)。
【例6】(2019·江蘇卷·18·節選)聚合硫酸鐵[Fe2(OH)6-2n(SO4)n]m廣泛用于水的凈化。以FeSO4·7H2O為原料,經溶解、氧化、水解聚合等步驟,可制備聚合硫酸鐵。

②計算該樣品中鐵的質量分數(寫出計算過程)。
以上六題為2019年不同省份高考試卷中的含量類計算題,通過比對可以發現:
1.六套考卷中的含量類計算題都出于工藝流程大題或實驗大題;
2.除江蘇卷要求寫計算過程外,其他五卷都是要求直接寫結果的填空題;
3.全國卷Ⅰ、全國卷Ⅲ和江蘇卷是純數值的計算,全國卷Ⅱ是數值和字母的混合計算表達,北京卷和天津卷是純字母的計算表達;
4.除全國卷Ⅰ是用一句話說明題意(初看上去好像有點條件不足的感覺)外,其他五卷都是系統地描述實驗過程,并在實驗過程中又衍生出滴定終點、誤差分析等常見的實驗問題,稍不留神就會掉入陷進;
5.全國卷Ⅰ和全國卷Ⅲ中化學知識點的設計比較簡單、直觀,主要考查學生對實驗數據的處理能力,而全國Ⅱ卷、北京卷、天津卷和江蘇卷在化學知識點的設計上綜合性較強,除考查學生對實驗數據的處理能力外,還考查學生發現問題、解決問題的能力;
6.全國卷Ⅰ、全國卷Ⅲ和天津卷對考查“陌生”反應的化學方程式的書寫要求不高,題中直接給出化學方程式,只需要掌握計算原理即可,而全國卷Ⅱ、北京卷和江蘇卷不但考查計算原理的掌握情況,還著重考查“陌生”化學方程式的書寫情況。
二、知識點剖析
1.含量計算題的常見類型
含量就是指特定物質中所包含的某種微粒成分的量。中學化學中常見含量類型的計算有:
(1)百分含量:某種微粒成分的百分含量等于該微粒成分的質量與特定物質總質量的比值,如例2、例5、例6。
(2)濃度含量:單位體積溶液里所含微粒成分的物質的量或質量,如例4。
(3)結晶水含量:晶體中所含結晶水的質量與晶體總質量的比值,如例1。
(4)產品含量:實際所得產品質量與理論可得產品質量的比值,如例3。
2.含量計算的常用方法
化學計算的核心思維過程是依據化學式或化學方程式找到物質之間的特定關系,然后根據關系式求出所需物質的質量,再用含量公式進行計算得出結果。
(2)熟練掌握化學方程式中各物理量之間的當量計算

2×27 2 2 3×Vm
m10-3cV1nV2
若Al的質量為m,NaOH溶液的濃度為c,體積為V1,生成NaAlO2的物質的量為n,生成標準狀況下H2的體積為V2。則
(3)準確確定物質轉換之間的數量關系。
①依據化學方程式確定
如:確定Na、Mg、Al與鹽酸反應產生H2的數量關系
②依據元素原子跟蹤法確定
如:確定用硫鐵礦(FeS2)生產硫酸的數量關系
FeS2~2SO2、SO2~SO3、SO3~H2SO4,
所以得FeS2~2H2SO4。
③依據氧化還原反應中得失電子守恒確定
如:確定Na、Mg、Al與鹽酸反應產生H2的數量關系
1 mol Na在反應中失去1 mol e-,產生1 mol H2需要得到2 mol e-,據得失守恒得:2Na~H2。
1 mol Mg在反應中失去2 mol e-,產生1 mol H2需要得到2 mol e-,據得失守恒得:Mg~H2。
1 mol Al在反應中失去3 mol e-,產生1 mol H2需要得到2 mol e-,據得失守恒得:2Al~3H2。
3.含量計算題中數值的處理方法
化學中的計算問題也可看成是對實驗數據的處理,在處理實驗數據時應該注意以下幾個問題:
(1)注意單位的換算;
(2)根據題意合理保留有效數字,如果題目沒有直接說明,通常根據題中的有效數字位數進行處理;
(3)計算時注意使用約分、化簡等技巧對計算進行簡化。
4.含量計算題的解題思路
(1)審題
①認真審清題中所問含量:是某種元素的含量,還是某種微粒或物質的含量;是某種微粒物質的量的含量,還是質量或體積的含量;是反應物轉化為產物的量所占反應物總量的百分含量(轉化率),還是實際生成的產物所占理論生成的產物的百分含量(產率)等。
②認真審清題中所給信息:是物質被溶解,還是物質被沉淀;是物質被氧化,還是物質被還原;是物質一步轉化,還是物質分兩步或多步轉化;是同一物質連續轉化,還是不同物質交叉轉化等。
(2)構建物質間的定量轉換關系進行當量計算
①寫出物質變化過程中的化學方程式(或離子方程式)確定物質間的定量轉化關系。
②根據原子守恒(原子跟蹤法)確定物質間的定量轉化關系。
③根據氧化還原反應中化合價升降總數相等(得失電子守恒法)確定物質間的定量轉化關系。
(3)利用公式計算得出結果


三、2019高考真題剖析
1.例1的解析

2.例2的解析


32 g 1 mol 2 mol 1 mol
xgn1mol 0.1×V×10-3moln2mol

3.例3的解析
(6)設理論上生成乙酰水楊酸的質量為x,則有:

4.例4的解析


n2b×v3×10-3
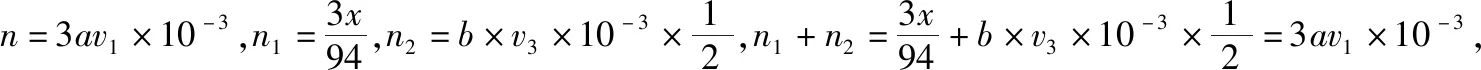
5.例5的解析
(5)此題與北京卷非常相似,但題干描述比較直白,并且直接給出所涉及的三個化學方程式,所以難度較小。根據三個化學方程式可以確定物質之間轉化的定量關系。設ag環己烯樣品中含環己烯的質量為xg,反應消耗Br2的物質的量為n1,I-消耗Br2的物質的量為n2,則可得:


6.例6的解析




