微凍貯藏蝦仁的水分遷移與品質變化
楊帆,萬金慶,2,3*,厲建國,2,3
1(上海海洋大學 食品學院,上海,201306)2(上海水產品加工及貯藏工程技術研究中心,上海,201306)3(農業部水產品貯藏保鮮質量安全風險評估實驗室(上海),上海 ,201306)
南美白對蝦腐敗過程分為內源性和外源性2個階段,前一階段內源酶類水解作用占主導,后期微生物分解產生三甲胺等腐敗物質。針對水產品的腐敗問題,目前水產品市場的低溫貯藏主要分四類:冷藏(4 ℃)、冰藏(0 ℃)、微凍(低于冰點1~2 ℃)、凍藏(-18 ℃)。微凍(super-chilling,sub-chilling,partial freezing)是一種讓食物中水分部分凍結的方法,通常是指低于食物初始冰點的1~2 ℃,導致產品中5%~30%的自由水形成冰晶[1]。與凍藏相比,微凍能夠減少凍結過程中冰晶對產品造成的機械損傷,減少解凍過程中的汁液流失率,保持食品原有的鮮度,降低能耗。MAGNUSSEN等[2]認為,微凍條件下產品貨架期與冷藏相比,延長1.4~5倍。在冷藏過程中,產品表面不會凍結,因此對于較厚產品來說,導熱系數低,內部傳熱緩慢,在工業生產中非常耗時。KAALE等[3]認為,微凍過程中食品表面從內部吸收熱量,在表面會形成一層1~3 mm的凍結層。能夠在冷鏈運輸或貯藏過程中保持一定的熱負荷存于物料內部,維持物料溫度平衡,同時避免溫度波動過大引起重結晶現象。李衛東等[4]通過對南美白對蝦微凍條件下的品質的研究,發現在-3 ℃條件下,K值被抑制,第18天僅為23.5%,且細菌總數一直呈較小幅度的增加,樣品保質期達26 d。
目前,微凍對蝦仁品質的影響仍存在一些爭議,大多數關于微凍的研究主要集中于感官分析和微生物腐敗等方面,對于蛋白質和結構變化及水分遷移等特性研究較少。本文通過對蝦仁在微凍條件下的新鮮度、持水力、水分遷移、肌原纖維蛋白、微觀結構等幾個方面進行研究。旨在為蝦仁微凍貯藏提供理論基礎。
1 材料與方法
1.1 材料與試劑
活體南美白對蝦:購于上海市南匯新城蘆潮港農貿市場,挑選同一批次且規格大小一致的產品,單個重約(15±0.8) g;用碎冰猝死后,在低溫條件下,進行剝殼,去頭,挑蝦線處理。處理好的樣品經真空包裝后,貯藏于(-3±0.5)℃的恒溫恒濕箱內。
試劑:改良型Bradford蛋白濃度測定試劑盒;二甲苯、無水乙醇、10%福爾馬林、蘇木精-伊紅染液。三磷酸腺苷(adenosine triphosphate,ATP)、二磷酸腺苷(adenosine diphosphate,ADP)、腺苷一磷酸(adenosine monophosphate,AMP)、肌苷單磷酸(inosine monophosphate,IMP)、次黃嘌呤核苷(hypoxanthine riboside,HxR)、次黃嘌呤(hypoxanthine,Hx)標準品(純度均不小于 99%)、氨基酸混合標準溶液等美國Sigma-Aldrich 公司。
1.2 儀器與設備
高效液相色譜儀(Waters 600 Controller pump、Waters 2487紫外檢測器、Millenium 32數據處理軟件),Waters公司;DS-5M 型Nikon數碼相機,日本Nikon公司;BX41 型Olympus光學顯微鏡,日本Olympus光學儀器有限公司;Kjeltec 2300凱氏定氮儀,丹麥福斯公司;UV 1102紫外可見分光光度計,上海天美儀器有限公司。
1.3 方法
1.3.1 蝦仁冰點測定
稱取1 cm×10 cm的蝦仁,溫度采集儀的熱電偶固定于蝦仁體表下約0.5 cm處,放入-18℃冰箱,采集間隔10 s,歷時3 h,3組平行,取平均值繪制凍結曲線。
1.3.2 揮發性鹽基氮(TVBN)測定
采用凱氏定氮儀,參照半微量定氮法原理,測定蝦仁TVBN含量變化,平行3次。
1.3.3 菌落總數(total viable count,TVC)測定
參考GB 4789.2—2016[5-7]《食品微生物學檢驗菌落總數測定》方法,每個稀釋度2個平行。
1.3.4K值測定
樣品處理參考LI等[8]方法略有改動。稱5 g蝦肉,加入10%高氯酸(預冷)10 mL,均質,在10 000 r/min,4 ℃條件下,離心15 min。10 mL 5%高氯酸沉淀再次離心(條件同上),過程重復2次,合并上清液,6 mol/L KOH調pH為6.5,靜置30 min,取上清液定容至50 mL,經0.22 μm濾膜過濾后,2 mL注射器打入1.5 mL進樣瓶。
參數設置:ODS-3色譜柱:(4.6 ID×250 mm);流動相:A為甲醇溶液,B為0.02 mol/L磷酸緩沖溶液溶液(pH 6.5),等梯度洗脫;柱溫28 ℃;進樣10 μL;流速1 mL/min;檢測波長254 nm。
(1)
式中:M1,ATP含量,mg/100 g;M2,ADP含量,mg/100 g;M3,AMP含量,mg/100 g;M4,IMP含量,mg/100 g;M5,Hx含量,mg/100 g;M6,HxR含量,mg/100 g。
1.3.5 肌原纖維蛋白含量的測定
參考NIU等[9]方法略改動,稱取2 g樣品,加入18 mL蒸餾水,均質后冷凍離心(10 000 r/min,4 ℃)10 min,過濾后獲取沉淀,再加入18 mL,30 g/l%的NaCl溶液,同上,離心后取得上清液。采用改良型Bradford蛋白濃度試劑盒染色后,酶標儀進行測定,平行3次。
1.3.6 持水率測定
參照LAKSHMANAN等[10]方法略改動。稱取5 g樣品,雙層濾紙包裹后,(1 500 r/min,10 min)條件下離心。干燥法測量水分含量。持水力計算如式(2)所示。
(2)
式中:W2,樣品離心后的質量,g;W1,樣品離心前的質量,g。
1.3.7 低場核磁共振分析(Low field nuclear magnetic resonance, NMR))
NMR橫向弛豫時間T2用CPMG(carr-purcell-meiboom-gill sequence)序列測量。參數設置:SW=200 kHz,RG1=20,P1=18.00 s,DRG1=3,TD =399 950,PRG=2,TW=2 500 ms,NS=8,P2=37.00 s,TE=0.250,NECH=8 000。參照CAO等[11]方法略改動。稱取2 mm×2 mm×1 mm的立方體樣品,擦干表面水分,保鮮膜包裹后,將其置于LF-NMR直徑為70 mm的檢測管內,弛豫時間T2通過MultiExp Inv分析軟件獲得。
1.3.8 核磁成像分析(magnetic resonance imaging, MRI)
參考LIU等[12-13]方法略改動,將樣品保鮮膜包裹后放入直徑70 mm的核磁管內,隨后通過核磁共振成像軟件測定蝦肉的質子密度圖譜。參數設置:TR=500 ms,TE=18.2 ms。由拉莫爾定律選擇成像層面,調節信噪比及圖像清晰度,8次掃描重復累加得到的成像圖譜。隨后進行統一映射和偽彩處理。
1.3.9 光學顯微鏡觀察(light microscopy observation)
參考文獻[14-15]方法。樣品切成3 mm×5 mm×5 mm的小塊,放入質量分數為5%的福爾馬林溶液中固定24 h,用乙醇溶液梯度洗脫(間隔1 h),乙醇體積分數依次為70%、80%、90%、95%、100%。二甲苯透明處理后,石蠟包埋,切成厚度為10 μm的切片,伊紅-蘇木精染色,經乙醇和二甲苯進行洗脫處理后,光學顯微鏡倍數10×10進行觀測,拍照保存。
2 結果與分析
2.1 蝦仁冰點的測定
蝦仁凍結曲線如圖1所示。冰點為-2.1 ℃,冰溫帶范圍0~2.1℃,蝦仁貯藏在微凍條件下,恒溫恒濕箱溫度應低于冰點1~2 ℃,設為(-3±0.5)℃。

圖1 蝦仁凍結曲線Fig.1 Freezing curve of shrimp
2.2 TVBN的變化
隨著貯藏時間的延長,蝦仁在內源酶和微生物的作用下會分解產生胺類等堿性化合物。通過對TVBN含量的測定能夠反映水產品的新鮮程度。圖2顯示,新鮮蝦仁的初始TVBN為6.01 mg/100 g左右,TVBN含量總體呈現上升趨勢。從第5天開始,TVBN增長速度緩慢,穩定在11.98 mg/100 g左右。可能是因為在微凍條件下,蝦仁表面形成一層約1 mm厚的冰層,表層微生物細胞內水分被部分凍結,微生物生長活動被抑制,酶活性降低,產生的胺類物質減少[16]。在第24天時,蝦仁TVBN含量為21.32 mg/100 g,超出國標[17]規定的淡水蝦TVBN上限(TVBN≤20 kg/100 g)。
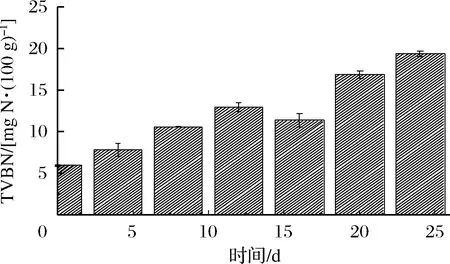
圖2 蝦仁微凍貯藏過程中TVBN含量變化Fig.2 Changes in TVBN content of shrimpduring superchilling storage
2.3 菌落總數變化
微生物分解作用是水產品腐敗的重要原因,一般鮮蝦的初始菌落總數在4~5 lg CFU/g[18]。由圖3可知,鮮蝦仁初始細菌總數(TVC)為(4.04±0.05)lg CFU/g,菌落總數呈緩慢增長趨勢。是因為在低溫條件下,大部分微生物活動被抑制,嗜冷菌(革蘭氏陰性菌,假單胞菌等)成為優勢菌屬,利用蛋白質,氨基酸等肌肉組織分解成分進行增殖。在貯藏至24 d時,菌落總數為(6.89±0.04)lg CFU/g,并未達到腐敗的標準107CFU/g。這一研究結果與李衛東等[4]一致,微凍貯藏26 d時,細菌總數達6.2 lg CFU/g,并未達到腐敗標準。可能是由于微凍形成的表面凍膜,有效組織了微生物的入侵。
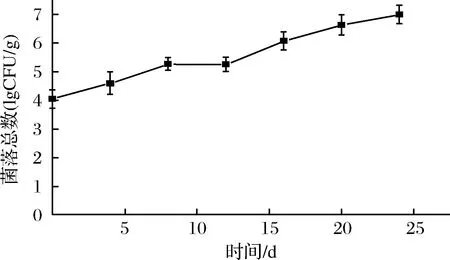
圖3 蝦仁微凍貯藏過程中菌落總數的變化Fig.3 Changes in TVC of shrimp during superchilling storage
2.4 K值變化
微凍貯藏過程中,肌肉細胞內ATP的水解是維持肌節松弛與收縮的一個重要生化過程。隨著糖酵解的進行,糖原水平下降,ATP在內源酶類作用下,迅速降解為ADP,AMP和IMP。隨后IMP在酸性磷酸酶(acid phosphatase,ACP)作用下分解為HxR和Hx,ATP濃度降低。肌束開始在一定程度上縮短,一旦肌肉內ATP嚴重不足,肌球蛋白便開始與肌動蛋白永久性地結合,形成肌動蛋白復合物,導致肌肉失去伸展能力,肌絲間水分流失,樣品逐漸自溶,最終腐敗變質。因此,K值是判斷水產品鮮度的一個重要指標。
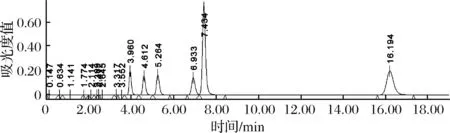
圖4 K值標準品峰圖Fig.4 K value standard peak spectrum
圖4為6種核苷酸混合標準品濃度為200 μmol/g生成的圖譜,且出峰順序依次為:IMP(3.960 min),ATP(4.612 min), ADP(5.264 min),AMP(6.933 min),Hx(7.434 min),HxR(16.194 min)。
由圖5可知,鮮蝦仁的K值為6.71%,貯藏前期(0~15 d),K值增長緩慢,處于平穩狀態。ANDO等[19]研究表明,日本對蝦在5 ℃和0 ℃條件下,K值達到一級鮮(20%),分別需要4 d和12 d,貯藏期相對微凍較短。本實驗在-3 ℃微凍條件下,在18 d左右超出一級鮮度。且在腐敗期(24 d),K值為47.53%,并未達到腐敗的標準(K>60%)。吳依蒙等[20]通過研究牙鲆ATP降解物,提出魚類在低溫貯藏過程中IMP含量下降,是肌體內源性AMP-脫氨酶(AMP-deaminase,ADA)和微生物源的ADA降解酶疊加作用的結果,且在貯藏后期,微生物是影響ATP降解的重要因素。這一研究解釋了K值前期含量較低的現象,因為在微凍條件下,微生物沒有達到最適生長環境,體內的ACP活性被抑制,IMP的降解速度下降,導致K值的增長速度比較緩慢,延長了蝦仁貯藏期[19-20]。由圖3可知,在貯藏后期,菌落總數接近腐敗水平時,K值含量也隨之增加。因此,微生物與K值含量呈正相關(P<0.05)。
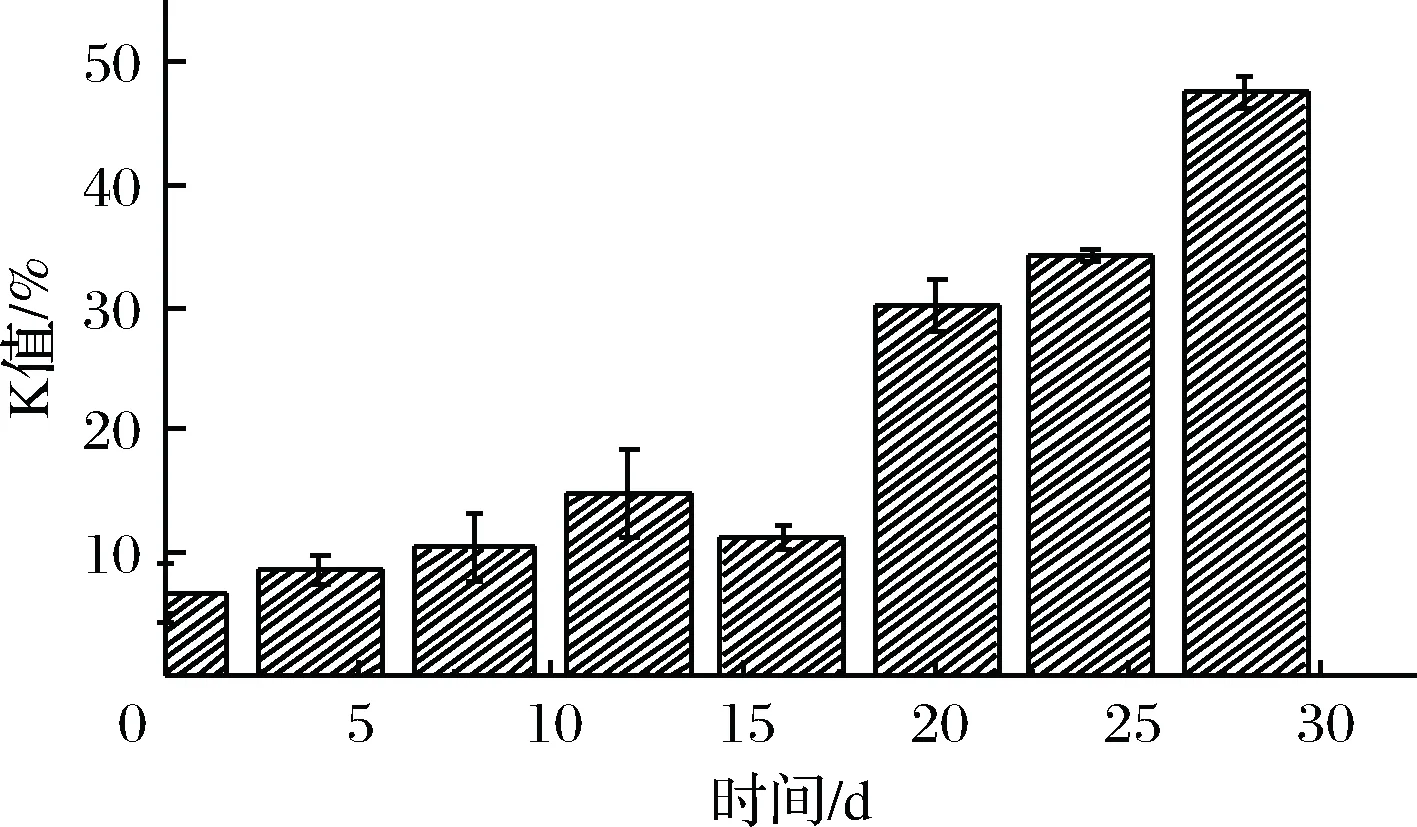
圖5 蝦仁微凍貯藏過程中K值變化Fig.5 Changes in K value of shrimp duringsuper-chilling storage
2.5 持水力變化
持水力能夠反映肌肉對水分的維系能力,經干燥法測得,鮮蝦仁初始含水率為79.8%。由圖6可知,微凍條件下,蝦仁的持水力呈下降趨勢。在整個貯藏過程中,蝦仁持水率下降了4%左右。可能因為在微凍(-3 ℃)條件下,樣品對溫度波動比較敏感,微小的溫度變化可能導致重結晶現象。當產品中一些水分部分結晶后,未冷凍的溶液中溶質濃度增加,引起酶活性增加,肌肉蛋白質變性,細胞膜結構損傷,導致肌肉持水力下降[16]。
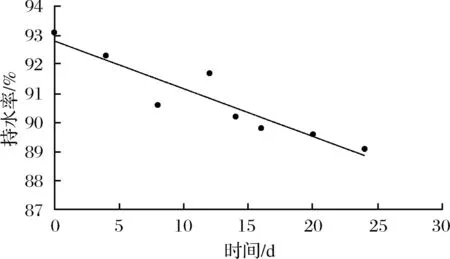
圖6 蝦仁微凍貯藏過程中持水率變化Fig.6 Changes in water holding capacity of shrimp duringsuper-chilling storage
2.6 微凍對南美白對蝦水分遷移的影響
低場核磁共振技術(low field nuclear magnetic resonance, LF-NMR)能夠直接提供蛋白質中的水質子和可交換質子之間的相互作用信息,從而快速且非破壞性地提供樣品中水的理化狀態。LF-NMRT2弛豫時間已成功用于研究豬肉,蝦,鱈魚和鮭魚等在冷藏和凍藏期間的水分分布與流動特性。NMR弛豫時間測量過程,即排列在磁場中的原子核被射頻脈沖從平衡狀態被擾亂至脈沖停止返回的過程[21]。弛豫時間越長說明底物與水分結合程度越松散,水分越自由。T21(0~2 ms)位于肌原纖維內肌漿中與蛋白質分子緊密結合的結合水;T22(2~20 ms)表示位于肌原纖維粗絲和細絲之間的不易流動水;弛豫時間最慢的T23(20~1 000 ms)表示位于肌原纖維外部的自由水,這部分水對食品品質保持起決定性的作用,可用于微生物生長活動,可溶性溶質溶解以及酶促反應的發生[22]。由圖7可知,隨著貯藏期的延長,結合水(T21)信號強度和峰面積幾乎保持不變。這一結果與PEARCE等[21]的觀點一致。這種蛋白質結合水通常一般與周圍水分子(包括不易流動水在內)進行交換,具有非常低的遷移率,即使在施加外力(例如冷凍和加熱)的條件下,也不會移動到其他區域,并保持緊密結合狀態。在貯藏前期(0~5 d),T22所代表的不易流動水信號強度增加,隨后又逐漸保持穩定。在整個微凍條件下,T23自由水的含量一直在下降,自由水所占比例,從初始的1.08%,降至0.17%。且弛豫時間也逐漸延遲,表明自由水的遷移率高。肌原纖維結構碎片化程度越深,蝦仁中水分流失越嚴重。

圖7 蝦仁在微凍貯藏過程中弛豫時間T2的變化Fig.7 Changes in T2 relaxation time of shrimpduring super-chilling storage
2.7 微凍蝦仁的核磁成像分析
核磁共振圖像(magnetic resonance imaging, MRI)通過呈現二維的質子密度圖,能夠直觀地檢測到肌體內水分的空間分布狀態。樣品不同區域的信號強度與水分子含量成正比,一般來說,圖像中顏色越亮(即MRI質子密度加權成像偽彩圖顏色趨近于紅色),代表此區域的水質子信號越強,表明蝦仁體內的水分含量就越高[23]。在初期階段(0~6 d)蝦仁質子密度圖整體色澤呈紅色,表明蝦仁體內水分含量較多,且分布均勻。在第10 天,蝦仁表面顏色變暗,呈現與底色相近的藍色,是因為微凍在蝦仁表面形成一層冰層,冰晶破壞了原生質和細胞膜結構,導致蝦仁表面失水。此外,也可能是因為部分水結冰,導致未冷凍溶液溶質濃度增加,導致酶活性增加,肌肉蛋白質變性,細胞膜結構被破壞,保水性下降[24]。在貯藏后期,蝦仁整體顏色逐漸偏暗(偽彩圖紅色減少,藍色增多接近底色),表明蝦仁體內水分流失嚴重,結構被嚴重破壞,品質發生嚴重的劣變。
2.8 肌原纖維蛋白含量變化
水產品中肌肉蛋白質的主要成分是鹽溶性的肌原纖維蛋白。研究表明,對蝦體內肌原纖維蛋白的含量占總蛋白含量的52.07%,肌原纖維蛋白主要包括肌球蛋白(由2條分子質量為220 kDa的重鏈和2條130 kDa的小亞基輕鏈組成的大蛋白,是肌原纖維粗絲的主要成分)和肌動蛋白(肌原纖維細絲的主要成分)[25]。由圖8可知,新鮮蝦的肌原纖維蛋白的含量最高417.28 μg/mL,在整個貯藏(-3 ℃條件下)過程中,肌原纖維蛋白含量變化呈下降趨勢,其中肌原纖維蛋白含量在前期(2~10 d)保持緩慢下降趨勢,隨后(10~15 d)呈明顯較快的下降趨勢。在整個貯藏過程中,肌原纖維蛋白含量與初始值相比下降了89.92%。肌原纖維蛋白溶解性下降有如下3種解釋[26-27]:(1)肌原纖維蛋白質變性后產生堿溶性蛋白質,該蛋白在高離子強度下不能溶出,導致肌動球蛋白溶解度降低;(2)微凍條件下,肌原纖維蛋白中的部分結合水形成冰晶,肌動球蛋白分子間相互作用形成疏水鍵和氫鍵等非共價鍵,聚合成不溶性凝聚物,導致鹽溶性蛋白溶解度降低;(3)巰基殘基和其他硼氫化合物聚合形成不穩定的共價鍵,降低鹽溶性蛋白的溶解性[25]。
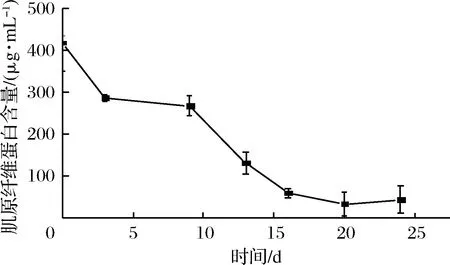
圖8 蝦仁在微凍貯藏過程中肌原纖維蛋白含量的變化Fig.8 Changes of myofibrillar protein content in shrimpduring super-chilling storage
2.9 微觀結構
蝦仁的微觀結構能夠比較直觀地反映肌肉組織細胞結構的完整性。蝦仁通過光學顯微鏡觀察到的肌肉組織縱向切面結構的變化如圖9所示。第10天,新鮮蝦仁的肌束呈縱向排列,肌纖維排列致密,肌節豐滿,僅有少量間隙,肌內膜完整,沒有出現肌原纖維斷裂的情況,肌肉組織結構完整。到第9天,可明顯地觀察到蝦仁肌肉細胞的完整性逐漸喪失,肌肉結構出現部分斷裂。第10天的核磁成像圖能夠解釋驗證這一現象,在微凍條件下,蝦仁的表面產生的冰晶凍層,破壞了細胞組織結構,造成了蝦仁表面水分的流失。這一結果與DUY等[28-31]研究微凍三文魚理論相一致。微凍條件下,冰晶首先在細胞間產生,當溫度低于物料冰點時,細胞內的水也會結晶,細胞內外壓力差過大,產生膨脹,會對細胞造成機械損傷。在貯藏后期,隨著纖維結構不斷地斷裂和小片化,肌原纖維束間空隙逐漸增大,肌纖維結構更加稀疏。在腐敗階段(第24天),肌原纖維和細胞外基質中的結構蛋白以及肌原纖維連接至肌膜質的Z-盤相關結構被不斷降解,肌原纖維的損傷更加嚴重,成碎片化狀態,肌肉組織結構完整性完全喪失。
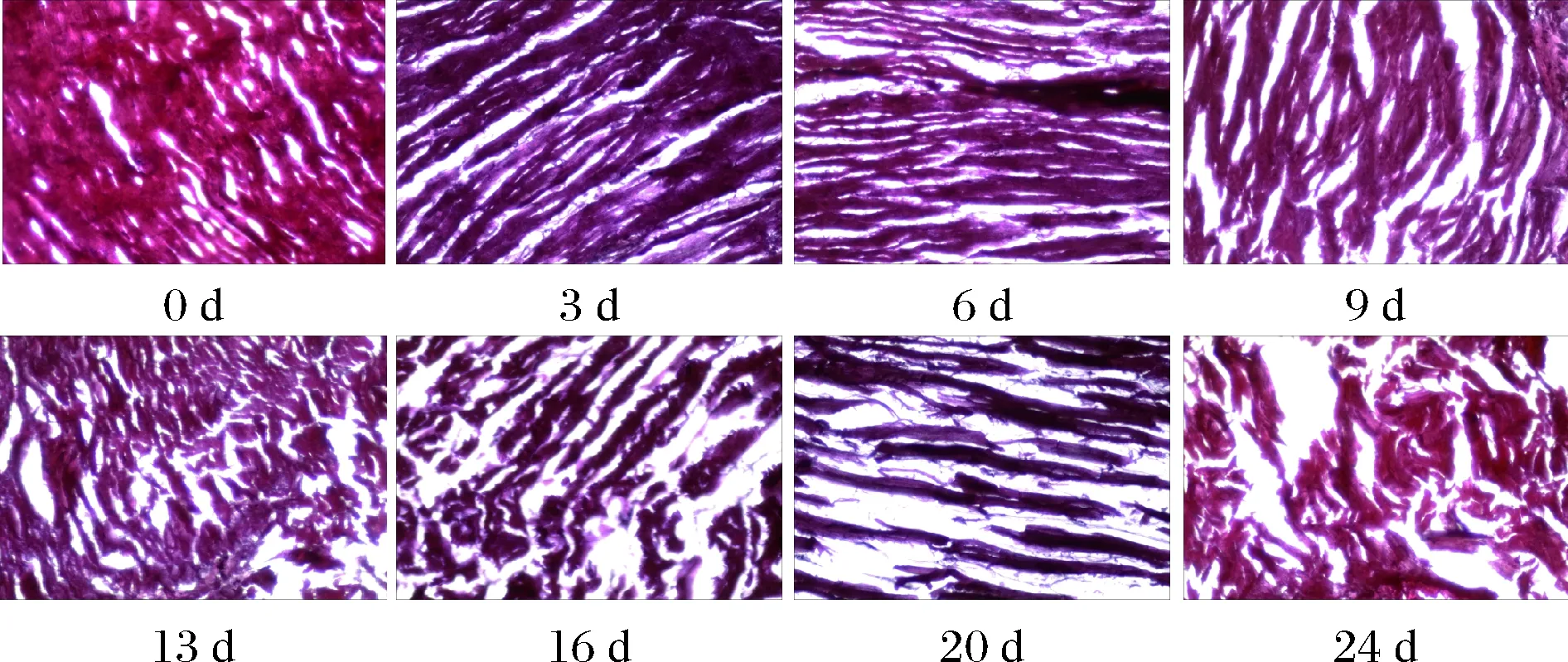
圖9 蝦仁在微凍貯藏過程中肌肉微觀組織結構的變化Fig.9 Changes of muscle microstructure in shrimpduring super-chilling storage
2.10 相關性分析
由表11可看出,各個指標之間存在著一定的相關性。蝦仁的TVBN和K值等指標與菌落總數顯著相關,表明微生物活動產生的腐敗胺類物質是水產品腐敗的重要原因。肌原纖維蛋白含量與持水力顯著相關,表明隨著肌原纖維蛋白含量與水分含量關系密切,肌原纖維蛋白降解導致蝦仁組織結構被破壞,蝦仁的持水力隨之降低,造成嚴重的水分流失現象。
3 結論
本文通過對蝦仁在微凍條件下的新鮮度、水分遷移、肌原纖維蛋白、微觀結構等幾個方面進行研究。結果表明,微凍能夠明顯抑制蝦仁TVBN、K值、菌落總數的增長速度。在-3℃條件下,蝦仁表面形成一層凍結層,抑制了微生物內IMP酶的活性,延緩了腐敗胺類物質的產生速度。通過LF-NMR技術能夠準確分辨蝦仁在微凍條件下的水分遷移狀態,橫向弛豫時間T21結合水的含量相對穩定,T22不易流動水含量先增加后減少,T23自由水的含量呈持續下降趨勢。核磁成像水分質子密度圖也能明顯看出水分的分布狀態,蝦仁表面由于冰晶的影響水分最先流失,后期隨著貯藏時間的延長,蝦仁成像顏色逐漸變暗(接近底色藍色),表明后期蝦仁水分流失嚴重,持水力下降。從蝦仁微觀組織結構圖直觀地觀察到,隨著肌原纖維蛋白含量的降低,蝦仁組織結構逐漸斷裂,成碎片化,肌肉間隙增大,直至腐敗變質。表明低場核磁共振,核磁成像和微觀組織切片能夠很好地觀測到微凍條件下蝦仁的品質變化情況,為蝦仁微凍貯藏保鮮提供了一定的理論基礎。
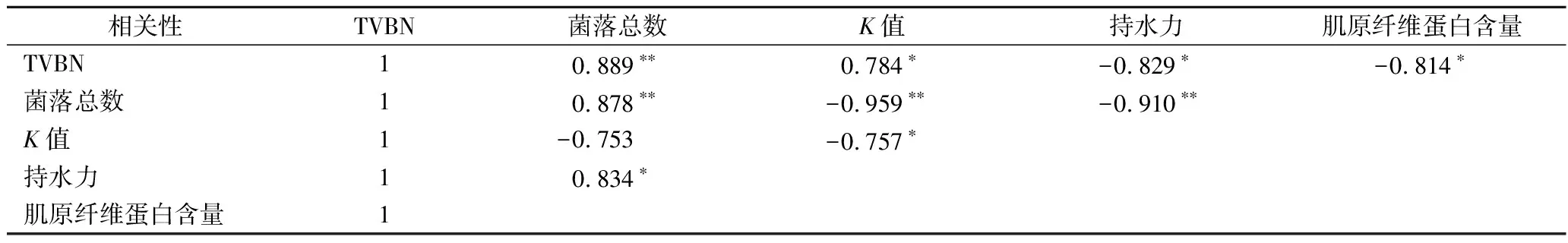
表11 南美白對蝦流化冰貯藏各指標間相關性分析Table 11 Correlation analysis between different indexes of shrimps under slurry ice storage
注: **表示在0.01 水平(雙側)上顯著相關; *表示在 0.05 水平(雙側)上顯著相關。

