3株釀酒酵母發酵過程中有機酸含量變化分析
裴芳藝 姜 明 馬巖石 陳 雪 劉振艷 劉 溪 陳曉婷
(齊齊哈爾醫學院科研處衛生檢驗中心,黑龍江 齊齊哈爾 161000)
酵母菌是人類文明史上利用最早的微生物,為兼性厭氧菌,其中屬釀酒酵母(Saccharomycescerevisiae)利用得最為普遍[1]。S.cerevisiae又稱面包酵母或者出芽酵母,是一種公認的與人類關系最廣泛的GRAS(Generally Regarded As Safe)微生物,廣泛用于制作面包和饅頭等食品,在工業生產中,主要應用于發酵谷類釀造酒類[2-4]。
不同的S.cerevisiae種因其獨特的代謝方式直接影響發酵過程中有機酸的分泌,而有機酸是發酵食品中酸味的重要組成部分,與發酵食品的質量評價和品質管理有著密切的關系[5-6]。對酸味起主要作用的有機酸為檸檬酸、乳酸、乙酸等[7],其中檸檬酸有清爽宜人的味道,給人一種持續的味覺刺激,檸檬酸含量越高,風味越好[8]。總酸含量偏高,會出現口感粗糙、不協調;總酸含量偏低則會出現口感黏稠、不爽口;適宜的總酸,能夠賦予釀造食品尤其是酒精飲料的平衡協調、柔和清爽、活潑的口感[9-10]。由于有機酸種類、含量及其比例關系對釀造食品的風味、pH值等都有重要的影響[11]。目前對于發酵食品中有機酸的研究主要集中在乳酸菌等益生菌上[12],并未對S.cerevisiae發酵過程中有機酸含量變化進行研究。此外,當前的研究焦點是利用基因工程手段提高乙醇[13]、2,3-丁二醇等醇類物質產量[14],忽略了酵母菌有機酸代謝途徑的研究,及其在食品、酒精飲料中的作用。
有機酸及代謝產物的分析方法有氣相色譜法(Gas chromatography, GC)、高效液相色譜法(High performance liquid chromatography, HPLC)及核磁共振法(Nuclear magnetic resonance, NMR)。其中,GC法在揮發性代謝產物的研究方面具有一定的優勢,然而操作過程中需要對樣品進行衍生化處理,使得產物大量損失。NMR由于價格昂貴,分析較復雜,在常規檢測中應用較少。HPLC因其操作簡便,檢測靈敏,是目前有機酸及食品風味物質研究的主要手段。因此,試驗擬利用HPLC對3株S.cerevisiae發酵過程中葡萄糖、甘油、乙醇及有機酸含量進行測定分析,力求找尋能夠提高食品、酒類產品風味品質的優勢菌株,為酵母菌代謝途徑研究提供依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
S.cerevisiae1946(CICC 1946)、S.cerevisiae32788(CICC 32788):中國工業微生物菌種保藏管理中心(CICC);
S.cerevisiaeP1:實驗室自行分離。
1.1.2 試劑
硫酸:色譜純,天津科密歐有限公司;
無水檸檬酸、α-酮戊二酸、琥珀酸、L-乳酸、甲酸、乙酸標準品:色譜純,上海源葉生物科技有限公司。
1.1.3 培養基
酵母浸出粉胨葡萄糖瓊脂培養基(YPD)(貨號HB5193)、YPD液體培養基(貨號HB5193-1):青島海博生物技術有限公司。
葡萄糖單碳源發酵培養基:葡萄糖80 g,酵母提取物5 g,(NH4)2SO42.5 g,KH2PO42.5 g,MgSO4·7H2O 0.25 g,無水CaCl20.25 g,蒸餾水1 L,調pH至5.0,108 ℃ 高壓濕熱滅菌20 min,用于S.cerevisiae發酵培養。
1.1.4 儀器與設備
高效液相色譜儀:WatersTMe2695型,美國Waters公司;
高速離心機:5804R型,上海艾研生物科技有限公司;
生化培養箱:BSP-400型,上海博訊有限公司;
往復式恒溫震蕩水域培養搖床:SPH-110X12型,上海世平實驗設備有限公司。
1.2 方法
1.2.1 菌株活化 將甘油管保藏的菌株S.cerevisiae1946、S.cerevisiae32788和S.cerevisiaeP1分別接種于20 mL YPD液體培養基中,30 ℃、140 r/min振蕩培養24 h,活化菌株。將活化后的菌液分別三區劃線于YPD固體平板上,30 ℃、靜置培養48 h。連續傳代培養3代后,挑取生長狀況優良的單菌落分別接種于100 mL/250 mL YPD液體培養基中,制備種子液。
1.2.2 制備發酵液 將種子液以5 mL/100 mL的接種量接種于葡萄糖單碳源發酵培養基中,30 ℃、200 r/min培養60 h,每隔6 h取適量發酵液,待測。
1.2.3 高效液相色譜分析 AminexHPX-87H有機酸分析柱(300 mm×7.8 mm;Bio-Rad;Hercules)。流動相:0.005 mol/L H2SO4,流速0.6 mL/min,進樣量20 μL,柱溫35 ℃,檢測波長210 nm。配置不同濃度標準品(0.2,0.4,0.6,0.8,1.0,1.2 g/L),取稀釋后標準品1 mL,13 000 r/min 離心10 min后取上清液,過0.22 μm濾膜后進樣,進樣量20 μL/針,測定得到相應濃度的峰面積與出峰時間,以濃度為橫坐標,峰面積為縱坐標繪制標準曲線。取發酵液1 mL進行梯度稀釋100倍,13 000 r/min離心10 min后取上清液,過0.22 μm濾膜后進樣,進樣量20 μL/針,根據各組分出峰面積和標準曲線,計算各組分含量。
1.3 數據處理
每個試驗重復3次,結果以(均值±標準差)表示,統計檢驗的顯著水平設定為0.05。利用JMP(Version 9.0.2,SAS,Inc)軟件進行方差分析及多重比較,并用Sigmaplot(Version 10.0,Systat Software,Inc)軟件繪圖。
2 結果與分析
2.1 標準溶液的色譜分析及回歸方程
通過HPLC色譜圖可知標準品出峰效果良好,按照出峰時間順序依次為檸檬酸(7.6 min)、α-酮戊二酸(8.0 min)、葡萄糖(8.6 min)、丙酮酸(9.0 min)、蘋果酸(10.9 min)、琥珀酸(11.4 min)、L-乳酸(12.0 min)、甘油(12.9 min)、甲酸(13.4 min)、乙酸(14.6 min)、乙醇(21.4 min)。以進樣量(mg/mL)為橫坐標,峰面積(mAU·min)為縱坐標,繪制標準曲線,進行線性回歸,建立回歸方程,如表1所示。由表1可知,相關系數符合試驗預期要求(R2>0.99),表明該色譜工作條件測定性能穩定、重現性高。
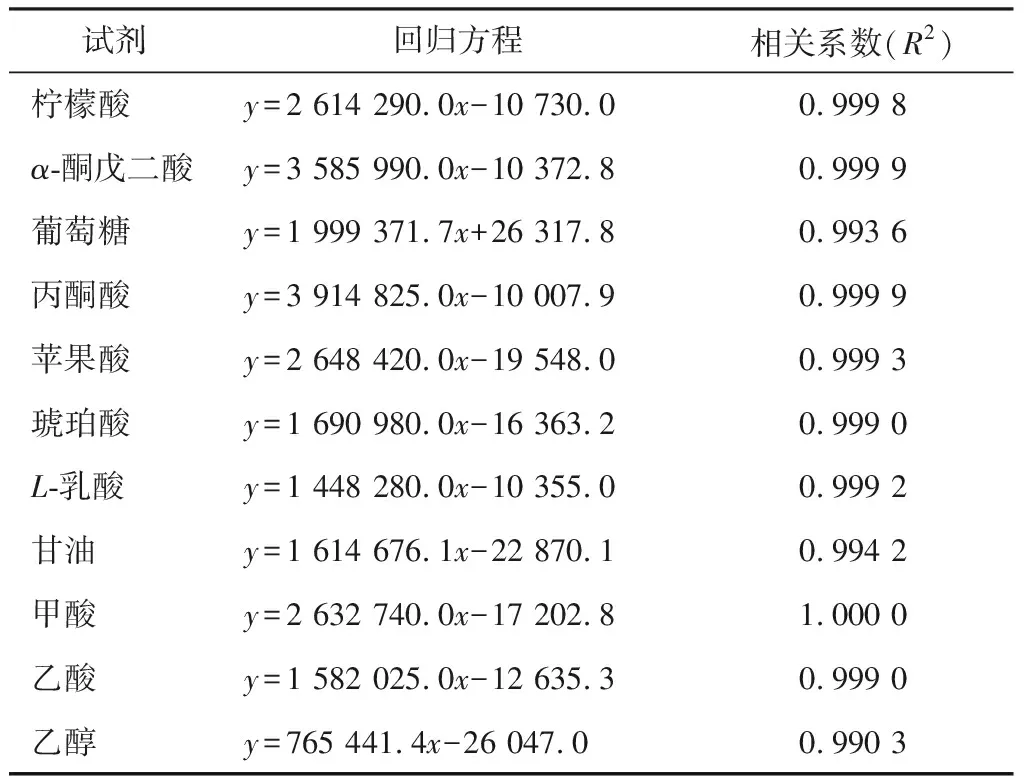
表1 各種試劑的回歸方程及相關系數
2.2 葡萄糖、甘油和乙醇含量變化
2.2.1 葡萄糖 由圖1可知,隨著發酵的進行葡萄糖被不斷消耗,在發酵12 h時,葡萄糖均被消耗殆盡。在發酵6 h時,3種發酵體系中葡萄糖的剩余量分別為(10.01±2.50)(S.cerevisiaeP1),(5.73±0.71)(S.cerevisiae1946),(8.54±0.93)(S.cerevisiae32788) g/L,S.cerevisiae1946對葡萄糖的利用速度大于S.cerevisiae32788和S.cerevisiaeP1。

圖1 3株S. cerevisiae發酵體系中葡萄糖含量變化曲線
2.2.2 甘油 由圖2可知,隨著葡萄糖的不斷消耗,菌體大量繁殖,甘油呈現先急速上升后保持穩定的趨勢。在整個發酵過程中(除發酵24 h外),S.cerevisiae1946發酵體系中甘油的含量顯著高于S.cerevisiae32788和S.cerevisiaeP1發酵體系(P<0.05),而S.cerevisiae32788和S.cerevisiaeP1發酵體系中甘油的含量無顯著差異(P>0.05)。在發酵末期,3種發酵體系中甘油的含量分別為(3.25±0.14)(S.cerevisiaeP1),(3.51±0.03)(S.cerevisiae1946),(3.30±0.10)(S.cerevisiae32788) g/L。甘油作為中性代謝物質在維持細胞內外滲透壓均衡的基礎上,起到調節氧化還原的作用[15-16]。
2.2.3 乙醇 由圖3可知,隨著發酵的進行乙醇的含量呈現先急速上升后略有下降最后保持平穩的趨勢。在發酵24 h時,乙醇含量最高,在3個發酵體系中分別為(32.85±0.54)(S.cerevisiaeP1),(35.82±0.67)(S.cerevisiae1946),(32.00±2.64)(S.cerevisiae32788) g/L。從整個發酵過程來看,在S.cerevisiae1946發酵體系中,乙醇的含量始終高于S.cerevisiae32788和S.cerevisiae1946發酵體系。在發酵末期,S.cerevisiae1946發酵體系中乙醇的含量最高,為(29.88±1.28) g/L。相較于S.cerevisiaeP1和S.cerevisiae32788,S.cerevisiae1946可以有效地將葡萄糖轉化成乙醇。

圖2 3株S. cerevisiae發酵體系中甘油含量變化曲線
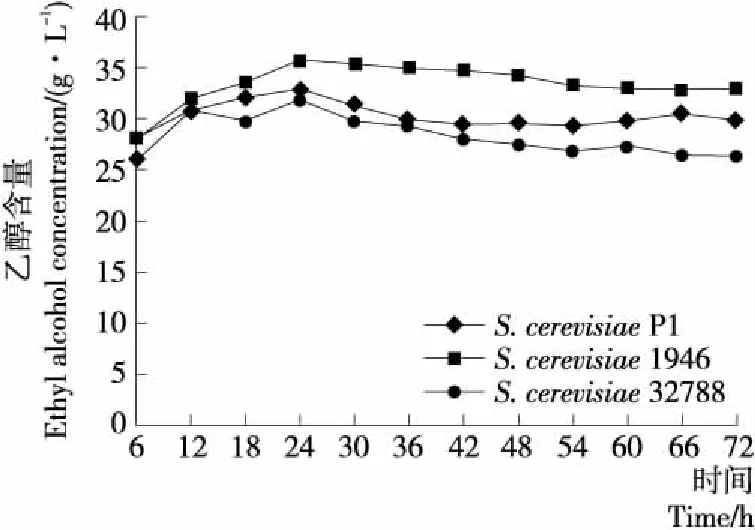
圖3 3株S. cerevisiae發酵體系中乙醇含量變化曲線
綜上研究表明,酵母菌在發酵過程中將α-酮戊二酸、丙酮酸和乳酸逐漸轉化為乙醇代謝中間產物,隨著發酵時間的延長,乙醇和甘油的濃度逐漸增加。在發酵后期,由于營養物質消耗殆盡,酵母菌生長代謝活性降低,導致甘油含量穩定,乙醇含量略有減少[17],與試驗結果相符。然而,隨著乙醇發酵的進行,發酵液中酒精度不斷增加,較高的酒精度會抑制酵母細胞的生長[18]。因此S.cerevisiae1946雖然可以有效地代謝葡萄糖產生乙醇,但其生長狀況不如S.cerevisiaeP1和S.cerevisiae32788。
2.3 有機酸含量變化
2.3.1 有機酸總量 由圖4可知,隨著發酵的進行有機酸含量呈現先升高后保持平穩的趨勢,而在S.cerevisiae1946發酵體系中,有機酸的含量上升較快,在前48 h 時,始終高于S.cerevisiae32788和S.cerevisiaeP1發酵體系。發酵48 h后,S.cerevisiae1946體系中有機酸含量保持穩定,而S.cerevisiae32788和S.cerevisiaeP1體系中有機酸含量繼續快速升高,在66 h時趨于穩定。在發酵末期,3種發酵體系中有機酸的含量分別為(4.05±0.02)(S.cerevisiaeP1),(2.88±0.04)(S.cerevisiae1946),(4.02±0.03)(S.cerevisiae32788) g/L。S.cerevisiae1946中有機酸的含量積累的速度大于S.cerevisiaeP1和S.cerevisiae32788發酵體系,但在發酵末期有機酸含量較低。因此可以看出,S.cerevisiaeP1可以快速地利用葡萄糖產生甘油、有機酸,但與S.cere-visiae32788和S.cerevisiaeP1相比,S.cerevisiae1946轉化率較低,可能是菌株在生長代謝過程中,利用葡萄糖產生其他代謝產物。酸類物質是酒精飲料中重要的風味物質,在酒精飲料中有增加濃厚感和減少甜味的作用,但酸含量要適中,否則會影響酒精飲料的口感和風味[19]。
有機酸總量為每一發酵體系中各種有機酸的總量
2.3.2 各有機酸含量 由圖5可知,在整個發酵過程中,共檢測到7種有機酸。隨著發酵的進行各有機酸含量不斷升高。發酵12 h時,在S.cerevisiaeP1中,琥珀酸含量最高,為(0.18±0.05) g/L,其次為丙酮酸[(0.15±0.04) g/L];在S.cerevisiae1946中,乙酸的含量最高,為(0.52±0.01) g/L,其次為丙酮酸[(0.37±0.08) g/L];在S.cerevisiae32788中,丙酮酸的含量最高,為(0.19±0.01) g/L,其次為琥珀酸[(0.14±0.03) g/L]。此時,S.cerevisiae1946發酵體系中,無論是有機酸種類還是有機酸含量均與S.cerevisiae32788、S.cerevisiaeP1發酵體系不同。隨著發酵時間的延長,S.cerevisiae1946體系中有機酸種類減少,但有機酸含量逐漸升高。在S.cerevisiaeP1體系中,乙酸、丙酮酸、琥珀酸的含量顯著增加(P<0.05),檸檬酸、甲酸含量不斷減少。而在S.cerevisiae32788體系中,除L-乳酸含量減少外,其余有機酸均呈不斷增長的趨勢。發酵72 h時,3個發酵體系中,乙酸含量最高,其次為丙酮酸;而在S.cerevisiae1946發酵體系中未檢測到L-乳酸,故S.cerevisiae32788與S.cerevisiaeP1的代謝過程較為相似,不同于S.cerevisiae1946。琥珀酸是糖類和大部分氨基酸代謝過程中的重要中間產物[20]。在3個發酵體系中,琥珀酸的含量逐漸增加,發酵末期,仍保持較高水平。在S.cerevisiaeP1發酵前12 h檢測到低量檸檬酸,其余發酵體系均未檢測到檸檬酸,是由于S.cerevisiae在三羧酸循環中產生的檸檬酸較少,且會被S.cerevisiae利用[21]。
綜上可知,S.cerevisiae32788與S.cerevisiaeP1能將丙酮酸轉換成乙酸,同時伴有L-乳酸的生成,而S.cerevisiae1946則將丙酮酸轉換成乙酸,并不產生乳酸。低產酸水平的酵母可促使更多的葡萄糖轉化成乙酸,減少乙醇產量,酵母菌的產酸水平與產乙醇能力呈負相關關系[18]。袁文杰等[17]研究發現,發酵的主要產物為乙醇,主要副產物為乙酸、甘油和琥珀酸。乙酸是酵母菌發酵產乙醇過程中的伴生產物,其變化趨勢及含量與乙醇呈正向耦合。梁璋成等[22]研究結果表明,乳酸、乙酸和琥珀酸是發酵的主要產物,其含量均隨酒精發酵的進行而增加。故3株S.cerevisiae的產酸能力與產乙醇能力一一對應。

圖5 3株釀酒酵母發酵過程中不同有機酸的含量變化
3 結論
利用HPLC對3株S.cerevisiae發酵過程中葡萄糖、甘油、乙醇及有機酸含量進行測定分析。結果表明:S.cerevisiae1946發酵體系中甘油、乙醇的含量顯著高于S.cerevisiaeP1和S.cerevisiae32788發酵體系(P<0.05);S.cerevisiaeP1和S.cerevisiae32788發酵體系中有機酸的含量顯著高于S.cerevisiae1946發酵體系(P<0.05);3個發酵體系中,乙酸的含量最高,其次為丙酮酸,S.cerevisiae的產酸水平與產乙醇能力呈負相關。故菌株S.cerevisiaeP1和S.cerevisiae32788具有應用于工業生產的潛力。下一步應重點研究S.cerevisiaeP1和S.cerevisiae32788在發酵過程中氨基酸及其他重要代謝產物的變化情況,并將菌株應用于食品或釀酒發酵,探究其發酵功能。

