青春雙歧桿菌的耐氧馴化及不同低聚糖對其增殖效果的影響
黎雁澤 陳夏菁 張士昂 徐 磊
(黑龍江八一農墾大學食品學院,黑龍江 大慶 163319)
目前,多數人群處于亞健康狀態,主要原因是膳食、腸道菌群失衡的共同影響[1-4],如菌群多樣性降低、單一化等,便會使有害菌數量增加[5-6],菌群結構改變同樣可導致機體發生免疫抑制,對環境應激能力下降,進而引發代謝問題,如便秘、過度肥胖、糖尿病、腫瘤、心血管疾病、結腸癌等[7-8]。
青春雙歧桿菌作為一種益生菌,可治療慢性腹瀉、便秘,還具有抗衰老作用。可以使人體腸道內酸性增強,減少有害菌群數量,調節腸道菌群向良性方向發展[9]。青春雙歧桿菌在腸道中起到了生物屏障的作用,供給營養,促進代謝[10-11];代謝產物主要是乙酸和乳酸,還可產生多種有機酸,如丙酸、異丁酸和丁酸等短鏈脂肪酸[12],青春雙歧桿菌的代謝物和抗菌物質對致病菌有著很強的拮抗作用[13]。腸道菌群在正常情況下可以保持相對平衡,在失衡情況下功能性低聚糖可以改善腸道菌群。有研究[14]證明,持續攝入低聚糖短期內可大量繁殖益生菌并抑制有害菌,幫助腸道恢復原有平衡狀態。近年來國內外學者向無害、無毒的益生菌制劑方向展開研究,目的就是為了獲得能夠維持腸道內菌群平衡的益生菌產品[15-16]。
青春雙歧桿菌是一種嚴格厭氧菌,這使其在益生菌發酵產品的應用方面存在局限。目前有關青春雙歧桿菌的研究主要集中在青春雙歧桿菌生長條件的優化、青春雙歧桿菌抑菌機理等方面,而對青春雙歧桿菌耐氧馴化前后生理特性的變化及其對青春雙歧桿菌增殖因子的影響等方面的研究還未見報道。試驗擬以青春雙歧桿菌(ATCC 15703)為出發菌種,通過對馴化前后青春雙歧桿菌各項指標的測定和不同低聚糖對青春雙歧桿菌增殖效果的影響,探討青春雙歧桿菌在耐氧馴化前后的變化情況,旨在為青春雙歧桿菌的進一步開發利用提供參考依據。
1 材料與方法
1.1 材料與儀器
1.1.1 菌種來源
青春雙歧桿菌(ATCC15703):中國微生物菌種保藏管理委員會普通微生物中心。
1.1.2 試劑及培養基
蛋白胨、牛肉浸粉、酵母浸粉、MRS培養基:青島海博生物技術公司;
低聚木糖、木聚糖、D-木糖、半胱氨酸鹽酸鹽:北京陸橋生物技術公司;
葡萄糖、磷酸氫二鉀、檸檬酸氫二胺、乙酸鈉、硫酸鎂、硫酸錳、吐溫80、NaOH、HCl等:分析純,天津大茂化學試劑廠;
CMRS培養基:在MRS培養基中加入0.01%的半胱氨酸鹽酸鹽制得;
改良MRS培養基:基于MRS培養基用大豆低聚糖、低聚麥芽糖、低聚木糖分別等量代替MRS培養基中的葡萄糖而制得。
1.1.3 儀器設備
紫外—可見光分光光度計:A360型,上海翱藝儀器有限公司;
立式壓力蒸汽滅菌器:LDZM-80KCS型,上海甲安醫療器械廠;
電熱恒溫培養箱:DNP-9052型,上海精宏實驗設備有限公司;
電熱恒溫培養箱:DHG-9145A型,上海一恒科學儀器有限公司;
離心機:H1650-W型,長沙湘儀離心機儀器有限公司;
厭氧培養箱:YQX-Ⅱ型,上海新苗儀器有限公司;
厭氧培養盒:2.5 L,日本三菱氣體化工有限公司;
pH計:PHS-C型,上海儀電科學儀器股份有限公司;
高效液相色譜:U3000型,賽默飛世爾科技(中國)有限公司。
1.2 試驗方法
1.2.1 青春雙歧桿菌的活化 將厭氧青春雙歧桿菌在MRS培養基中活化,37 ℃厭氧培養48 h,之后繼續在厭氧條件下連續傳3代,活化后的青春雙歧桿菌進行耐氧馴化。
1.2.2 青春雙歧桿菌的馴化 將活化后的青春雙歧桿菌先在厭氧條件下連續傳代,而后通過逐步增加液體培養基中的氧分壓,使青春雙歧桿菌漸漸適應有氧環境。具體操作:取存于螺口試管液深10 cm的CMRS培養基,接種10 μL青春雙歧桿菌菌液,37 ℃下厭氧培養24 h;取菌液10 μL接種于液深16 cm的MRS培養基,37 ℃下有氧培養24 h;之后取菌液10 μL接種于液深10 cm的CMRS培養基,37 ℃下厭氧培養24 h;再取菌液10 μL接種于液深13 cm的MRS培養基,37 ℃下有氧培養24 h;之后取菌液10 μL接種于液深10 cm的CMRS培養基,37 ℃下厭氧培養24 h;再取菌液10 μL接種于液深10 cm的MRS培養基,37 ℃下有氧培養24 h;如此反復5次,最后將有氧培養下液深10 cm的MRS培養基連續傳代培養,得耐氧馴化青春雙歧桿菌。
1.2.3 菌株特性檢測
(1) 革蘭氏染色和鏡檢:參考張苓花等[17]的方法,對馴化過程中的青春雙歧桿菌采用革蘭氏染色法和鏡檢,觀察菌體的大小、顏色、分叉狀態等是否符合雙歧桿菌屬的基本形態特征。
(2) 青春雙歧桿菌菌液吸光度的測定:用紫外—可見分光光度計在600 nm波長下測定青春雙歧桿菌菌液吸光度,記錄青春雙歧桿菌馴化過程中吸光度的變化情況。
(3) 測定青春雙歧桿菌菌液pH值:用pH計對青春雙歧桿菌馴化過程中的pH值進行測定。
(4) 青春雙歧桿菌的菌體形態和16S rRNA測序鑒定:對青春雙歧桿菌進行革蘭氏染色并鏡檢,觀察馴化前后的菌體形態變化,同時對其16S rRNA基因進行PCR擴增[18],擴增后的產物進行測序和對比分析。
1.2.4 菌液有機酸含量測定 取馴化前后青春雙歧桿菌培養液,10 000×g離心5 min,取上清液,過0.22 μm濾膜后進樣,色譜柱為syncronis C18,Dim 250 mm×4.6 mm,5 μm,梯度淋洗程序共持續30 min,前10 min和后3 min的流動相為2%的乙腈和98%的磷酸二氫鉀水溶液(流速0.5 mL/min),10~27 min時流動相為20%的乙腈和80%的磷酸二氫鉀水溶液(流速0.8 mL/min),柱溫30 ℃,在210 nm波長下檢測吸收峰[19]。
1.2.5 還原糖含量測定 采用DNS比色法,在紫外分光光光度計560 nm波長下作出葡萄糖標準曲線,根據標準曲線求得青春雙歧桿菌培養液中還原糖的含量[20]。
2 結果與分析
2.1 耐氧馴化前后青春雙歧桿菌的吸光度和pH值
2.1.1 菌液吸光度 由表1可以看出,馴化前的青春雙歧桿菌在有氧培養條件下OD600 nm不足0.10,而在厭氧條件下OD600 nm可達1.75。經5次耐氧馴化后,青春雙歧桿菌菌液吸光度值達到了1.07,說明較馴化前青春雙歧桿菌菌數有大幅度提升。同時,有氧培養和厭氧培養下菌液的吸光度值之比不斷增大,表明在馴化過程中青春雙歧桿菌的耐氧能力也在不斷提升。
2.1.2 pH值 在循環馴化過程中,隨著傳代次數的增加,菌液pH值不斷下降,青春雙歧桿菌的耐酸能力也在不斷提升,從表1可以看出在馴化結束前菌液pH值已經穩定至4.5附近,這有助于青春雙歧桿菌作為益生菌通過胃部酸性環境,從而作用于腸道,并且馴化后的耐氧青春雙歧桿菌可為發酵食品的生產提供優良菌株。
表1青春雙歧桿菌馴化過程中吸光度和pH值的變化情況
Table1ChangesofabsorbanceandpHvalueintheacclimatedprocessofB.adolescentis

循環傳代次數OD600 nm有氧培養厭氧培養有氧培養/厭氧培養pH值第1次0.0941.7540.0536.55±0.08第2次0.2741.6940.1625.93±0.23第3次0.5561.7210.3235.58±0.18第4次0.8731.6440.5315.29±0.12第5次1.0741.6830.6384.50±0.17
2.2 耐氧馴化前后青春雙歧桿菌形態特征的比較
耐氧馴化前后青春雙歧桿菌的菌落和菌體形態對比結果如表2和圖1、2所示,可以看出青春雙歧桿菌在耐氧馴化前后的形態保持一致,且馴化前后菌體的16S rRNA 基因序列一致,可以確定青春雙歧桿菌菌株在耐氧馴化后未發生變異。
2.3 馴化前后青春雙歧桿菌菌液中的有機酸含量
厭氧菌的培養一般以糖類或醇類為碳源,在青春雙歧桿菌的生長代謝中,會將碳源分解成乳酸、乙酸、丙酸、丁酸等有機酸,因此,研究測定耐氧馴化前后青春雙歧桿菌代謝不同有機酸含量的變化情況。圖3為乳酸、乙酸、丙酸、丁酸混合標準品的紫外吸收峰譜圖,圖4、5分別為耐氧馴化前后青春雙歧桿菌代謝有機酸吸收峰譜圖。對比圖3~5可以看出,馴化前后青春雙歧桿菌代謝產生的乳酸、乙酸、丙酸、丁酸的出峰時間符合標準品出峰時間,確定青春雙歧桿菌馴化前后有機酸種類無顯著變化。
表2耐氧馴化前后青春雙歧桿菌菌體形態特征
Table2MorphologicalcharacteristicsofB.adolescentisbeforeandafteraerobicdomestication

培養條件鏡檢形態菌落形態革蘭氏染色厭氧多為棒狀桿菌,有Y型、V型,兩端不規則乳白色或白色、不透明、圓形、邊緣完整陽性有氧體積較厭氧培養時小、菌體較短、兩端規則乳白色或白色、菌落較小、不透明、圓形、邊緣完整陽性

圖1 耐氧馴化前青春雙歧桿菌菌體形態

圖2 耐氧馴化后青春雙歧桿菌菌體形態

圖3 4種有機酸標準品色譜圖
根據各標準品峰面積繪制標準曲線,根據標準曲線計算有機酸含量,結果如表3所示。由表3可以看出,馴化后青春雙歧桿菌代謝乙酸和乳酸的含量下降幅度較大,丙酸含量變化不明顯。經耐氧馴化后,青春雙歧桿菌代謝的4種有機酸總量下降,而乙酸與乳酸的摩爾數之比上升,青春雙歧桿菌生長的最佳摩爾比為2.0~4.0[17],而馴化后的青春雙歧桿菌代謝乙酸與乳酸摩爾比為3.74,在最佳范圍之間,有利于青春雙歧桿菌的生長繁殖,在發酵食品的生產方面具有一定優勢。

圖4 馴化前青春雙歧桿菌不同有機酸色譜圖

圖5 馴化后青春雙歧桿菌不同有機酸色譜圖
表3青春雙歧桿菌馴化前后有機酸含量
Table3ContentoforganicacidsbeforeandafterthedomesticationofB.adolescentisg/L
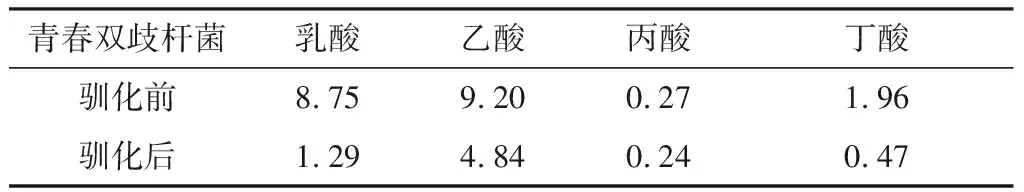
青春雙歧桿菌乳酸乙酸丙酸丁酸馴化前8.759.200.271.96馴化后1.294.840.240.47
2.4 不同低聚糖對馴化前后青春雙歧桿菌增殖效果的影響
2.4.1 青春雙歧桿菌在不同低聚糖培養基中OD600 nm和pH 青春雙歧桿菌在3種低聚糖培養基中的OD600 nm值和pH值如表4所示,總體上馴化后比馴化前OD600 nm值稍有下降,主要是由于青春雙歧桿菌為專性厭氧菌,雖然經過耐氧馴化但生長狀況和厭氧培養下的菌株仍存在差距;馴化后比馴化前pH值降低,主要源于耐氧馴化的青春雙歧桿菌提高了自身的耐酸、產酸能力。并且低聚木糖培養基中的青春雙歧桿菌生長情況和產酸能力均強于大豆低聚糖、低聚麥芽糖培養基中的。
表4青春雙歧桿菌在不同低聚糖培養基中吸光度和pH的變化情況
Table4ChangesintheabsorbanceandpHofB.adolescentisindifferentoligosaccharidecultures
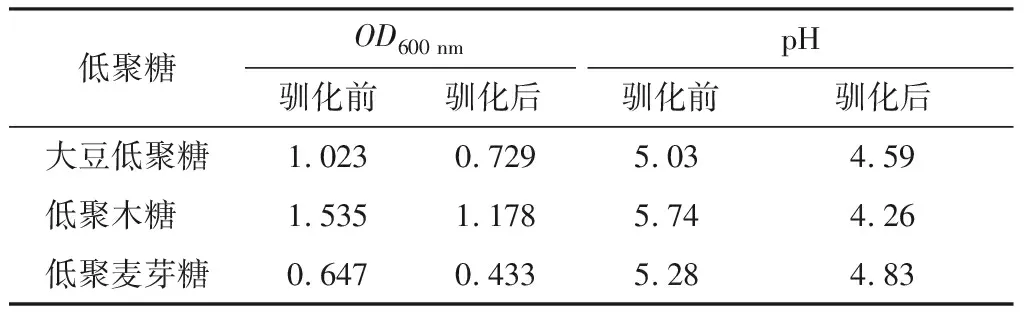
低聚糖OD600 nm馴化前馴化后pH馴化前馴化后大豆低聚糖1.0230.7295.034.59低聚木糖 1.5351.1785.744.26低聚麥芽糖0.6470.4335.284.83
2.4.2 馴化前后青春雙歧桿菌在不同低聚糖培養基中的還原糖含量 通過DNS比色法繪制葡萄糖標準曲線,將試驗中測得的OD560 nm值,代入葡萄糖標準曲線方程(y=0.012 5x-0.139 3,R2=0.995 2)計算葡萄糖含量,在3種低聚糖培養基中青春雙歧桿菌菌液還原糖含量如表5。
表5馴化前后青春雙歧桿菌在不同低聚糖培養基中還原糖含量
Table5ReducingsugarcontentofB.adolescentisindifferentoligosaccharideculturesbeforeandafterdomestication g/L

低聚糖種類馴化前馴化后大豆低聚糖13.33215.692低聚木糖 7.4928.612低聚麥芽糖16.49217.852
從表5中也可以看出:在低聚木糖培養基中青春雙歧桿菌生長后,菌液還原糖含量最低,碳源利用率最高,由此可知低聚木糖是良好的促雙歧桿菌生長因子。龔芳紅等[21]研究表明人體每天食用0.7 g低聚木糖17 d后,雙歧桿菌所占比例由8.5%提高到17.9%,21 d后提高到26.2%;徐海燕等[22]研究了低聚木糖對雙歧桿菌及腸道菌群生長的影響,結果表明,低聚木糖是對青春雙歧桿菌有明顯增殖效果的低聚糖,同時也印證了Crittenden等[19]比較多種低聚糖對厭氧菌發酵特性的研究。不同低聚糖對雙歧桿菌都有著一定的增殖效果,但低聚木糖是其中最優良的一種,適合作為雙歧因子。
3 結論
試驗探討了青春雙歧桿菌的耐氧馴化及低聚糖對青春雙歧桿菌增殖的影響,通過改變氧分壓,逐步提高青春雙歧桿菌對氧氣的耐受力。同時培養基中添加低聚糖可以對青春雙歧桿菌的增殖起到促進作用;馴化后的青春雙歧桿菌在有氧條件下生長能力達標,產酸能力得到提升,菌體馴化前后形態一致,耐氧青春雙歧桿菌代謝產生的乙酸與乳酸比值較厭氧青春雙歧桿菌更適宜發酵,因此,耐氧青春雙歧桿菌特性良好。后續可進一步對多種低聚糖共同影響青春雙歧桿菌的增殖效應,以及改善耐氧青春雙歧桿菌生長條件進行研究。

