白細胞介素-35在潰瘍性結腸炎中的作用
潘治平,崔焌輝,沈鋒
(1.浙江中醫藥大學第二臨床醫學院,浙江 杭州 310053;2.浙江省立同德醫院肛腸外科,浙江 杭州 310012)
潰瘍性結腸炎(ulcerative colitis, UC)是炎癥性腸病的一種亞型,其特征在于腸道的慢性炎癥。近幾十年來,UC的發病率在世界范圍內有所增加,特別是在發展中國家[1]。由2個亞基Epstein-Barr病毒誘導基因3(epstein-barr virus induced gene 3, EBI3)和白細胞介素-12(Interleukin-12, IL-12)p35亞基的異二聚化組成的白細胞介素-35(Interleukin-35, IL-35)具有通過調節性T細胞(regulatory T cells, Tregs)和調節性B細胞(regulatory B cells, Bregs)介導的免疫抑制作用,使其成為治療UC的候選者[2]。本文深入討論IL-35的表達和生物學功能,并為將來的臨床試驗和藥物開發提供理論依據。
1 IL-35的組成
IL-12家族由IL-12、白細胞介素-23(Interleukin-23, IL-23)、白細胞介素 -27(Interleukin-27, IL-27)和IL-35組成,屬于造血細胞因子的I型家族(見表1)。與大多數具有單體、同源二聚體或同源三聚體功能的細胞因子不同,IL-12細胞因子是少數幾種具有異構體功能的細胞因子之一[3]。IL-12相關細胞因子是由α鏈(p19、p28或p35)和β鏈(p40或Ebi3)組成的異二聚體蛋白質。α鏈具有4個α螺旋束結構,典型的細胞因子有IL-6、粒細胞/巨噬細胞集落刺激因子,而β鏈與可溶性細胞因子受體鏈具有同源性。因此,IL-12是p35(IL-12α)/p40(IL-12β)異二聚體,IL-23是p19(IL-23α)/p40(IL-12β)異二聚體,IL-27是p28(IL-27α)/EBI3異二聚體。IL-35是由p35α亞基和EBI3β亞基組成的異源二聚體。Ebi3僅含有3個蛋氨酸和4個半胱氨酸殘基,而IL-12 p35含有10個蛋氨酸和7個半胱氨酸殘基,據推測兩者之間不存在二硫鍵[4]。IL-12家族細胞因子的受體也共享亞基。IL-35受體由IL-12Rβ2/gp130異二聚體或同源二聚體組成。IL-12Rβ2是IL-12受體的組成部分,而gp130是多種細胞因子受體的組成部分,包括IL-6、IL-11、IL-30、腫瘤抑制因子M和白細胞抑制因子[5]。
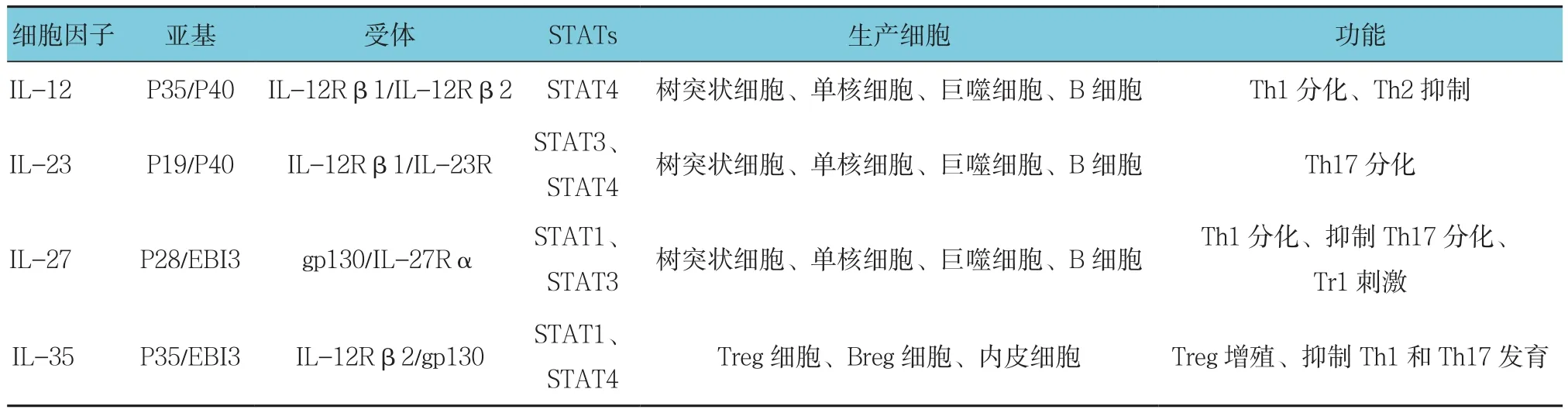
表1 IL-12細胞因子家族的結構和特征
2 IL-35的表達和分泌
EBI3與IL-12的p35亞基結合形成EBI3/p35異二聚體IL-35,EBI3與p35的體內關聯最初在人胎盤提取物中得到證實。p35基因在許多類型的細胞中以低水平組成型表達,因此幾乎無所不在[6]。IL-35由小鼠CD4+CD25+Foxp3+Tregs組成型表達[7]。BARDEL等[8]發現在非刺激的人體胸腺、脾、淋巴結、扁桃體、腸和血液Treg細胞中未檢測到IL-35。有研究還發現IL-35在IL-35誘導的CD4+Treg細胞群中表達,定義為iTr35[9]。除了CD4+Tregs之外,IL-35還被證明在前列腺癌患者的CD8+Treg細胞群中表達,并介導抗原特異性抑制[10]。IL-35的表達在體內和體外都能有效地調節CD4+和CD8+T細胞的應答。
與其他成員不同,IL-35不是由抗原呈遞細胞產生,如巨噬細胞、單核細胞和樹突細胞,其主要由CD4+Foxp3+Tregs分泌[7]。Tregs對IL-35的最大表達和分泌需要與效應性T細胞(effective T cell, Teff)接觸,這增強了Tregs的抑制能力[11]。此外,在較小程度上活化的B細胞、內皮細胞、平滑肌細胞和單核細胞也是IL-35的來源[12]。IL-35對干擾素-γ有分泌作用,可作為Toll樣受體3和4的激動劑。IL-35還可誘導常規T細胞轉化為CD4+Foxp3-分泌iTr35,這種正反饋級聯放大效應極大地抑制了多種效應細胞和細胞因子的作用。LI等[13]發現只有在脂多糖或炎癥細胞因子的熱原擾動下,才能在單核細胞、平滑肌細胞和血管內皮細胞中檢測到IL-35 mRNA的存在,揭示了IL-35只在炎癥刺激反應中分泌。
3 IL-35的信號轉導
IL-35不符合大多數細胞因子特有的典型高親和力及低親和力受體復合物信號轉導模式[14]。IL-35的信號通路似乎與IL-12、IL-27的信號通路重疊。這可以通過其與IL-12Rβ2的同二聚體(即IL-12Rβ2∶IL-12Rβ2和gp130∶gp130)或異二聚體,以及分別由IL-12R和IL-27受體(即gp130∶IL-12Rβ2和IL-12Rβ2∶wsx-1)組成的gp130的非優先結合來證明信號的部署[15]。gp130受體是包括IL-6、IL-11和IL-27在內的多種細胞因子受體的組成部分。另一方面,IL-12Rβ2是一種嚴格意義上的IL-12細胞因子家族受體[16]。IL-35與包含gp130和/或IL-12Rβ2的同二聚體或異二聚體結合后開始信號轉導。受體結合后,信號轉導通過Janus激酶/信號轉導子和轉錄激活子進行。信號轉導子和轉錄激活子 1(signal transducers and transcriptional activators 1,STAT1)的磷酸化在IL-35與gp130受體結合后發生,而STAT4的磷酸化在IL-35與IL-12Rβ2結合后發生。將IL-35與缺乏STAT1或STAT4的T細胞共孵育,發現其抑制能力顯著降低,因此,STAT1和STAT4的協同作用對于IL-35介導的抑制至關重要。
COLLISON等[15]結果表明,與全功能IL-12Rβ2/gp130異二聚體受體復合物的信號傳導相比,通過同源二聚體受體對傳遞的信號是由STAT1和STAT4調節的,從而導致IL-35抑制活性的部分喪失。通過同二聚體受體介導的信號轉導在抑制Teff細胞增殖的同時不能誘導其轉化為iTr35,原因是信號轉導途徑中只有1支(包括同源二聚體)是開啟的。相反,WU等[17]報道由IL-12Rβ2∶gp130組成的同源二聚體受體對的信號轉導既能介導iTr35的誘導,又能介導Teff的抑制。有證據表明,IL-12Rβ2能被B細胞和樹突狀細胞表達,影響IL-35在免疫系統中的生物活性[18]。SHEN等[2]的研究說明IL-35在B細胞中的信號轉導是通過IL-12Rβ2∶wsx-1組成的異二聚體受體復合體來調節的。
4 IL-35的免疫抑制作用
IL-35活性相關的主要抑制機制是抑制T細胞增殖和效應功能。有關IL-35活性的基礎研究利用白細胞介素-12 p35亞基-/-和Ebi3-/-小鼠,發現缺乏IL-35表達的CD4+Tregs抑制T細胞增殖的能力顯著降低,這一發現在許多模型中被重復[9,18-19]。重組 IL-35(recombinant IL-35, rIL-35) 抑 制 T細 胞反應的能力也在研究中得到了清楚的說明,其可以降低T細胞增殖和T細胞因子的表達這些研究由于難以生成活性的IL-35異二聚體形式而變得有些復雜[20]。IL-35的抑制活性不僅限于CD4+Tregs,因為CD8+CTLA-4+Tregs也以非接觸IL-35依賴的方式抑制自體T細胞的增殖[10]。
雖然對IL-35機制的研究集中在抑制CD4+和CD8+T細胞增殖的能力上,但是IL-35也在抑制輔助性T細胞17(helper T cell 17, Th17)反應中發揮作用。表達IL-35的Tregs可抑制CD4+T細胞向Th17效應細胞的分化,而缺乏EBI3的小鼠IL-17的產生明顯增加[21]。有研究發現,rIL-35降低了Th17的分化及Th17細胞的功能[22]。除了其對Th17免疫的影響外,一份報告甚至提出rIL-35可以導致抗體滴度降低[20]。雖然體外研究已經清楚地表明IL-35能夠直接作用于效應T細胞,但IL-35抑制抗體反應的能力可能表明IL-35也能夠作用于其他細胞群,也可能有助于體液免疫的輔助性T細胞應答的抑制[22]。研究進一步發現體外免疫也被rIL-35抑制,其誘導人B細胞轉化為產生IL-35和IL-10的Bregs[2]。
最近,LI等[23]首次提出IL-35及其IL-12細胞因子家族成員是具有抗炎功能的穩態相關分子模式和具有促炎功能的危險相關分子模式。IL-35不是特異性地與一種受體結合,而是松散地具有一種模式特征,被不同的IL-12家族受體雜亂地識別,這些家族受體為穩態相關分子模式受體。IL-35作為穩態相關分子模式結合同二聚體和異二聚體受體的潛在優勢可能包括以下幾個方面:①IL-35在不同的炎癥過程中,無論哪種受體在不同的細胞中表達和發揮作用,均可抑制廣泛的炎癥反應和免疫反應;②IL-35阻斷和干擾IL-6、IL-12和IL-27受體信號轉導;③IL-35以高度敏感和有效的方式維持全身和組織穩態。
5 IL-35與潰瘍性結腸炎的相關性
UC以大腸黏膜和黏膜下層的潰瘍和炎癥為特征,被認為與過度侵襲性T細胞介導的對腸道微生物群的免疫反應有關,由環境觸發因素引起和重新激活[24]。目前,UC的藥物治療包括糖皮質激素,免疫抑制劑和新興的生物療法(抗TNF-α單克隆抗體)。然而,仍有一大批患有難治性或復發性疾病的患者無法忍受目前可用的藥物治療。對UC患者腸道中免疫炎癥通路的分析表明,組織損傷是由免疫細胞和非免疫細胞之間復雜而動態的相互作用所驅動,其中細胞因子是這種相互作用的關鍵介質[25]。白細胞介素是相關細胞因子譜的關鍵成分,因此被確定為潛在的未來治療靶點。
LI等[26]首次證明活動性的UC患者血清IL-35水平顯著低于健康對照組,與UC活動性成反比。TAKAHASHI等[27]報道Tregs頻率在UC活動期降低,與疾病活動呈負相關,結果表明Tregs的缺乏與潰瘍性結腸炎的進展有關,Tregs是IL-35的主要來源,因此可導致外周血中IL-35的減少。在結腸黏膜中,IL-35的過度表達和分泌增強可能在UC的炎癥過程中起一定作用。與正常結腸相比,Treg細胞在結腸炎區域的固有層中高度浸潤。通過浸潤免疫細胞遞送的IL-35增加,以對抗UC中的黏膜炎癥。
巨噬細胞是體內重要的吞噬和抗原提呈細胞,根據表型可分為M1(經典激活)和M2(替代激活)2種極化類型。M1型巨噬細胞介導了結腸炎的炎癥反應,而M2型巨噬細胞抑制炎癥、維持腸道免疫平衡。與正常人相比,UC患者的結腸組織表現為巨噬細胞高浸潤。隨著病情的發展,巨噬細胞浸潤率也逐漸升高。WANG等[28]研究表明,IL-35重組蛋白可以顯著減少大腸組織中巨噬細胞的數量。盧戰軍等[29]研究發現IL-35可能通過調控SHIP1的表達,抑制M1型巨噬細胞極化,緩解腸道炎癥。此外,免疫熒光染色顯示,IL-35重組蛋白能明顯抑制CD4+T細胞和CD8+T細胞的浸潤。Tregs組成性地存在于腸黏膜中,通過抑制效應T細胞的增殖來抑制免疫反應。有研究證實IL-35可以誘導Tregs的產生,Tregs的比例在IL-35重組蛋白處理后顯著上調[30]。
腸道炎癥主要由Th1、Th2和Th17細胞的免疫反應介導。這些細胞與炎癥黏膜中的其他細胞之間的相互作用由多種細胞因子介導,包括促炎和抗炎細胞因子。IL-10能拮抗Th1細胞因子,穩定腸黏膜免疫平衡,是一種重要的抗炎細胞因子,對UC的發生起到保護作用[31]。近期研究表明IL-10在IL-35重組蛋白處理后上調;相比之下,血清和結直腸組織中的幾種促炎細胞因子,包括IL-6、IL-17和TNF-α均下降[31]。盡管炎癥細胞因子和免疫細胞之間存在復雜的相互作用網絡,但IL-35在Th17細胞與Tregs的平衡中起著重要作用。一方面,IL-35能夠誘導iTr35細胞產生,更多的iTr35細胞進一步分泌更多的IL-35。另一方面,IL-35通過Tregs的擴張和IL-10的分泌有效地抑制Th1和Th17細胞。此外,IL-10在抑制巨噬細胞時可進一步降低IL-6水平。總之,IL-35可通過調節炎癥相關細胞因子的分泌來誘導抗炎環境的產生。
針對腫瘤壞死因子的藥物已被認為是緩解嚴重UC的首選藥物[32],然而,也提高了不良事件的風險,如感染、狼瘡樣自身免疫反應和超敏反應。因此,需要一種靶向結腸的新型給藥方法,副作用較少,局部藥物濃度較高。最近ZHANG等[33]首次構建了表達IL-35的靶向改造大腸桿菌(大腸桿菌/IL-35),并研究口服大腸桿菌/IL-35對小鼠模型中實驗性結腸炎的治療效果,結果顯示IL-35治療組的疾病活動指數顯著降低,中性粒細胞和CD3+細胞在結腸內浸潤更少;此外,大腸桿菌/IL-35治療組小鼠脾臟和腸系膜淋巴結的CD4+IL-17A+Th17細胞減少,CD4+CD25+Foxp3+Tregs升高,結腸和血清IL-10、IL-35水平升高,IL-6水平降低。該研究表明,大腸桿菌/IL-35作為一種新型口服IL-35遞送系統減輕了結腸組織的炎癥損傷[33]。
UC與Treg/Th17的失衡密切相關,Tregs上調和/或Th17抑制可以對UC提供積極干預。IL-35在體外促進Tregs的抑制功能和在體內控制內環境穩定的增殖中起重要作用,同時IL-35能抑制Th17的分化和功能。因此,增加IL-35的表達可用于控制UC中黏膜炎癥的范圍,為UC的治療提供新的靶點。而利用靶向改造大腸桿菌編碼免疫調節細胞因子的基因治療方法,可能提供了一種潛在的途徑[33]。IL-35水平可高度指示UC中Treg穩定性的程度。血清IL-35水平降低可能是體內抗炎活性不足的表現,有望成為監測UC疾病活動的生物標志物[26]。
綜上所述,筆者發現12年來IL-35的作用仍然知之甚少。IL-35是一種免疫抑制細胞因子,是自身免疫和傳染病期間免疫力的關鍵調節因子。IL-35主要通過減少巨噬細胞、CD4+T和CD8+T細胞的浸潤,以及提高Tregs的比例來減緩結腸炎的發病。此外,IL-35可以通過調節多種炎癥相關因子來達到抑制炎癥的作用。IL-35可能是臨床上重要的診斷指標,然而,作為潰瘍性結腸炎的合適治療策略,需要進一步研究IL-35在UC免疫和炎癥調節網絡中的確切作用。

