腦微出血影像學分類與血漿血管內皮生長因子水平及載脂蛋白E基因分型的關系研究
白家赫,于永鵬,劉麗君,鄭亞利,李鑫,譚蘭
腦微出血(cerebral microbleeds,CMBs)是以微小出血為主要特征的一種腦小血管病變[1]。不同類型的卒中患者CMBs的發生率波動在19.4%~68.5%[2]。腦出血患者CMBs的發生率為38%~66%,腦梗死患者為21%~26%,而在健康人群為5%~6%。CMBs是急性腦梗死后發生出血轉化的獨立危險因素,也是腦梗死患者接受溶栓、抗凝藥物治療發生癥狀性出血轉化的重要因素。有研究發現抑制血管內皮生長因子(vascular endothelial growth factor,VEGF)信號通路能抑制腦梗死患者接受rt-PA溶栓治療的出血轉化[3]。VEGF與基質金屬蛋白酶(matrix metalloproteinase,MMP)-9過表達在腦轉移瘤相關性顱內出血中發揮促進作用[4]。VEGF增高是急性腦梗死患者CMBs發生的獨立危險因素,VEGF水平與CMBs嚴重程度相關[5-6]。推測VEGF可能參與CMBs的起始和進展過程。
目前認為基因遺傳因素參與了包括CMBs在內的腦小血管病的發生、發展過程[7-8]。在遺傳基因方面,載脂蛋白E(apolipoprotein E,ApoE)ε4等位基因是迄今唯一較公認的增加CMBs發生風險的遺傳因素[2,9-10]。針對我國漢族人群ApoE基因型與CMBs的相關性研究尚未見報道,ApoE基因型是否與潛在的CMBs風險因子存在交互作用,目前仍不清楚。雖然近期有研究針對漢族人群探討了急性腦梗死患者CMBs與VEGF相關性,發現VEGF水平與CMBs嚴重程度相關[10]。也有研究發現阿爾茨海默病(Alzheimer’s disease,AD)患者血清VEGF水平與CMBs存在相關性[11]。上述研究均未對ApoE基因進行分型,VEGF水平與ApoE基因型是否存在交互作用,仍不清楚。因此,本研究選取急性腦梗死患者為研究對象,基于ApoE基因分型和CMBs影像學分類,探討漢族人群血漿VEGF水平與CMBs及其影像學分類的關系,為CMBs預警篩查提供有效的生物標志物。
1 研究對象及方法
1.1 研究對象 研究所選擇的對象來自于2014年8月-2017年8月在青島大學附屬醫院黃島分院及青島大學附屬威海市中心醫院住院治療的急性腦梗死患者。納入標準:①所有病例診斷符合中國急性期缺血性腦卒中診治指南2010版的標準,經顱腦MRI證實為新發梗死(DWI序列高信號和表觀彌散系數低信號)[12];②發病48 h內入院;③18歲≤年齡≤80歲。排除標準:①合并顱內出血、腦外傷、腦梗死后出血轉化、感染及腫瘤等占位性病變;②伴嚴重的心、肝、腎等基礎疾病;③年齡>80歲,伴嚴重癡呆、帕金森病或帕金森綜合征;④伴神經系統脫髓鞘疾病如吉蘭-巴雷綜合征、多發性硬化等;⑤意識障礙。
1.2 方法 對所有患者進行MRI(包括T1WI,T2WI,DWI及SWI等序列)檢查。常規行心電圖、心臟彩超、頸部動脈彩超、顱腦MRA(或CTA)及TCD等檢查,病因分型參照TOAST分型標準。記錄危險因素:年齡、性別、吸煙、飲酒、簡易精神狀態評估量表(mini-mental state examination,MMSE)評分、NIHSS評分、高血壓病、收縮壓水平、糖尿病、高血脂、抗高血壓、抗凝及抗血小板藥物使用等。本研究已經通過青島大學倫理委員會批準。
主要協變量的定義:①高血壓病:病前應用降壓藥物,入院時收縮壓≥140 mm Hg和(或)舒張壓≥90 mm Hg;②糖尿病:糖尿病病史;空腹血糖≥7.0 mmol/L或餐后2 h血糖≥11.1 mmol/L合并糖化血紅蛋白≥6.5%;③高脂血癥:既往有血脂異常或入院檢查血脂異常,TC>5.72 mmol/L,TG>1.72 mmol/L,或LDL>3.12 mmol/L;④吸煙:目前仍吸煙或已戒煙(10支/天,持續5年以上);⑤飲酒:飲酒量>50 mL/d,戒酒或未戒酒。
1.2.1ApoE基因分型及血管內皮生長因子檢測 所有患者在入院24 h內(即發病72 h內)抽取空腹靜脈血10 mL。其中5 mL血用于血糖、血脂、血常規、血凝常規等檢測。另5 mL血采用人VEGF Quantikine ELISA試劑盒檢測血漿VEGF水平。VEGF操作步驟按照說明書進行。ApoE基因分型采用的引物由南京東極生物科技有限公司設計并提供。使用以下引物進行擴增。ApoE rs429358:5’-TGTCCAAGGAGCTGCAGG-3’和5’-CTGCCCATCTCCTCCATCC-3’(片段長度3 9 3 b p);Ap o Er s7412:5’-ATGCCGATGACCTGCAGAA-3’和5’-CTGCCCATCTCCTCCATCC-3’(片段長度219 bp)。具體操作步驟按照說明書進行。
1.2.2 腦微出血MRI檢測及其影像學分類 采用GE公司的超導性磁共振成像系統(型號:GE MR Discovery 750 3.0T)、先后獲得橫軸位T1WI及T2WI、矢狀位T1WI、DWI、3D-TOF MRA和SWI圖像。掃描參數為:FLAIRT1WI[重復時間(repetition time,TR)/回波時間(echo time,TE),1750 ms/24 ms,反轉時間(inversion time,TI)780 ms;視野24 cm×24 cm,矩陣320×256];快速恢復快速自旋回波(fast relaxation fast spin echo,FRFSE)-T2WI(TR/TE,4300 ms/95 ms,視野24 cm×24 cm,矩陣512×512);DWI-平面回波成像(echo planar imaging,EPI)(TR/TE,3000 ms/70 ms;視野24 cm×24 cm,矩陣160×160。其中SWI序列參數為:3D T1-快速場回波(fast field echo,FFE),TR Minimum,TE 45.0 ms,反轉角15°,層厚2 mm,無間隔采集,矩陣384×320,激勵次數1.0。患者入院后行MRI平掃+SWI。CMBs診斷標準為SWI序列上圓形或橢圓形、質地均一、直徑為2~10 mm低信號影,邊界清楚、周圍無水腫,并排除顱內鈣化、鐵沉積、海綿狀血管瘤及擴大的血管周圍間隙等[13](圖1)。根據CMBs的分布位置不同,參照CMBs解剖評定量表可分為深部CMBs(基底節、丘腦、內囊、外囊及胼胝體和腦室周圍白質)、腦葉CMBs(皮質和皮質下白質)、幕下CMBs(腦干及小腦)、混合型CMBs(腦葉+深部或幕下+腦葉),為方便研究,本研究將幕下CMBs歸類于深部CMBs。為避免混合型CMBs對研究的干擾,予以剔除。所有MRI圖像均由2名影像專業醫師分別閱片給出報告。
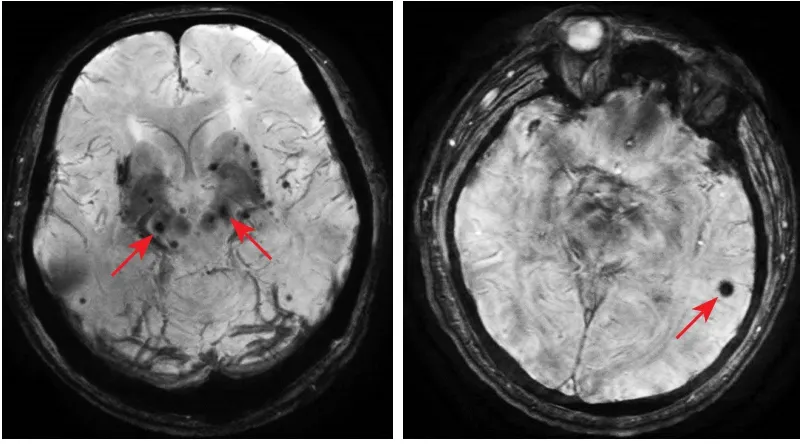
圖1 腦微出血在SWI序列上的表現
1.2.3ApoE基因分型依據 鑒于ApoEε4與Ap oEε2等位基因與腦內出血高風險、CMBs及白質高信號(white matter hyperintensities,WMH)負荷增加有關。且ApoE不同的基因型可能影響CMBs的不同影像學分類。因此本研究參照既往研究中ApoE基因分型思路,根據ApoE基因型對CMBs的影響不同,分為兩類:攜帶ε2或ε4等位基因(ε2/ε2、ε2/ε3、ε2/ε4、ε3/ε4、ε4/ε4)和僅攜帶ε3/ε3等位基因[14]。
1.3 統計學方法 采用SPSS 16.0統計軟件進行統計學處理,正態分布計量資料以表示,計數資料用頻數(%)表示。兩樣本均數比較采用t檢驗。計數資料兩樣本間比較采用卡方檢驗。使用Logistic分析校正混雜因素,分析VEGF與總體CMBs及CMBs不同影像學分類的關系。不同的回歸分析模型采用不同的協變量(年齡、性別、MMSE評分、NIHSS評分、高血壓病、收縮壓水平、糖尿病、吸煙、飲酒及抗血小板藥、抗凝劑、他汀類藥物使用等)進行校正。P<0.05表示差異有統計學意義。
2 結果
2.1 研究對象的人口統計學和臨床特征 本研究共納入451例腦梗死患者,經篩查發現CMBs 99例,將混合型分布(腦葉+深部或幕下+腦葉)CMBs 7例予以剔除。實際CMBs組92例,CMBs組的MMSE評分較非CMBs組低,CMBs組患者認知功能明顯受損(表1)。本研究并未發現ApoEε2和ε4兩個等位基因在腦葉和腦深部CMBs個體中的分布存在差異(P>0.05)。與非CMBs患者比較,合并CMBs的腦梗死人群中有更高的ApoEε2或ε4等位基因攜帶率(P<0.05)。CMBs組患者存在高血壓的比例較非CMBs組高(χ2=68.12,P=0.00),其他因素包括年齡、性別、MMSE評分、NIHSS評分、收縮壓水平、糖尿病、吸煙、飲酒及抗血小板藥、抗凝劑、他汀類藥物使用等,各組之間的差異無統計學意義。

表1 研究對象的人口統計學和臨床特征
2.2 血管內皮生長因子與CMBs的關系及其交互作用 CMBs組血漿VEGF水平高于非CMBs組(P=0.005),基于CMBs不同影像學分類亞組分析,腦深部CMBs組血漿VEGF水平高于非CMBs組(P=0.009)(圖2)。Logistic回歸分析表明,高水平血漿VEGF是CMBs的風險因素(OR1.59,95%CI1.02~2.47,P=0.005)。在腦深部CMBs患者中,血漿VEGF水平與ApoE基因型存在交互作用(P=0.01)。在攜帶ApoEε3/ε3患者中,血漿VEGF水平每增加一個標準差對于腦深部CMBs的多因素校正OR值是0.90(95%CI0.49~1.20,P=0.73);在ApoEε2或ε4患者中,對腦深部CMBs多因素校正OR值是2.83(95%CI1.31~6.10,P=0.008)(圖3)。

圖2 CMBs組與非CMBs組及CMBs各亞組患者血漿VEGF水平的比較
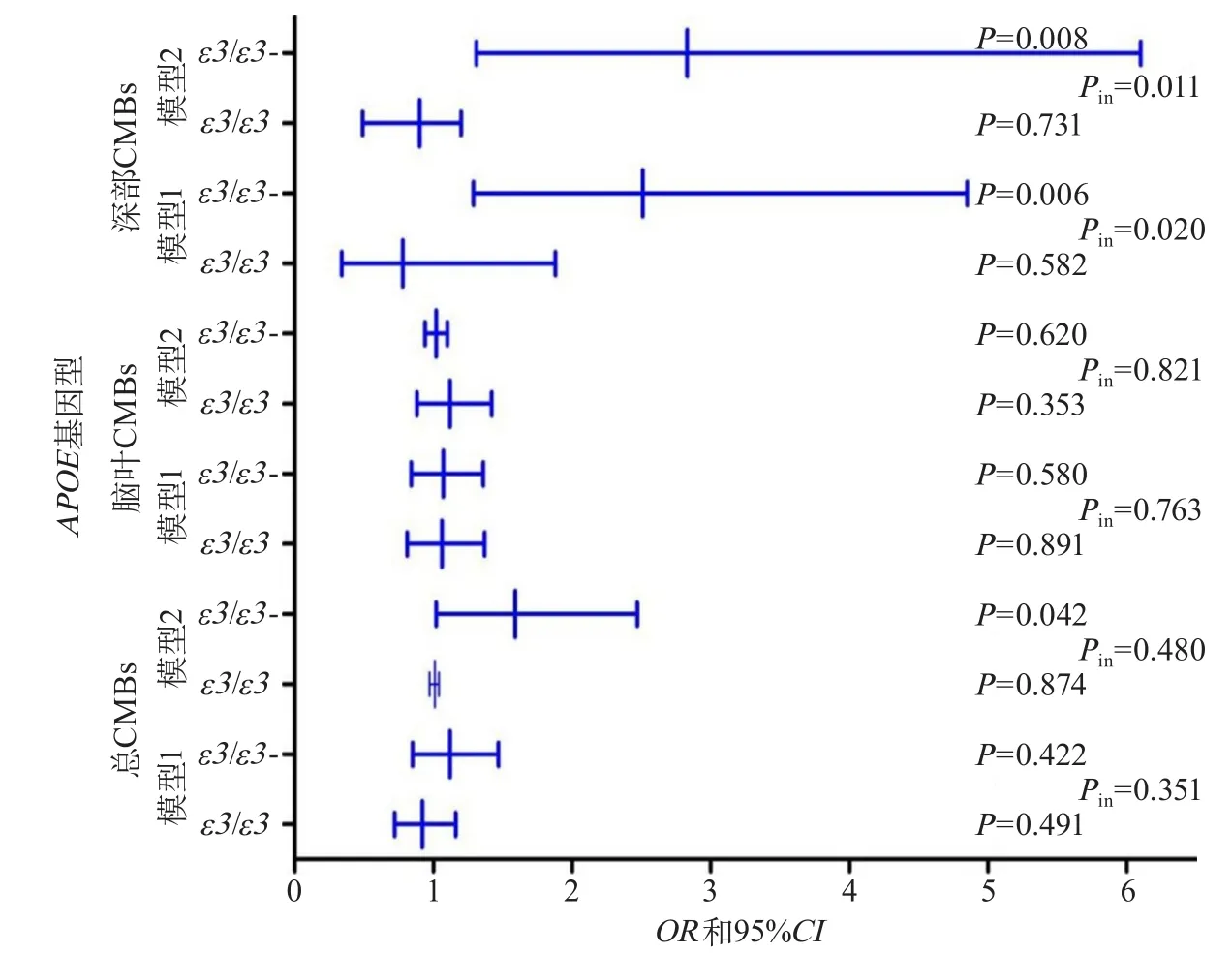
圖3 CMBs中ApoE基因型與血漿VEGF間交互作用分析
3 討論
本研究發現,在腦梗死人群中CMBs患病率為22.0%(99/451),多數患者存在單發CMBs,其中多發CMBs者42例,CMBs的位置分布較為廣泛,21例多發CMBs分布在腦葉,14例分布于基底節、丘腦、內外囊、胼胝體和腦室周圍白質、腦干及小腦等區域,7例多發CMBs屬于混合型分布(腦葉+深部或幕下+腦葉),為避免對研究的干擾,予以剔除。本研究觀察到男性CMBs患病率較女性高,但差異無統計學意義,這可能與本研究中男性樣本年齡偏大有關。既往研究表明藥物使用情況影響CMBs的發生,故本研究將藥物使用情況進行了統計分析[15-16]。
3.1ApoE基因型與CMBs的關系ApoE在腦功能中發揮多種作用,改變腦血管疾病和癡呆對常見危險因素的反應,影響其發生風險及易感性。例如,ApoE等位基因狀態與WMH(缺血性小血管疾病的標志)相關。ApoEε4與腦深部WMH有關[17]。攜帶ApoEε2或ε4等位基因的個體表現出更高的腦葉出血風險[16,18]。ApoEε4等位基因與深部和腦葉出血有關,而ApoEε2等位基因與腦深部出血的風險增加有關[19]。提示腦出血的分布類型及其發生易感性可能具有ApoE等位基因風險依賴性。然而在漢族人群中,ApoE等位基因與CMBs的影像學分類是否存在關聯,目前尚不清楚。有證據提示ε4等位基因可能對腦葉CMBs有更強的影響[16]。有一項包含了42個研究(共29 965例)的系統回顧和Meta分析表明,ApoEε4和ApoE ε2基因型與WMH負荷增加相關,ApoE4基因型與CMBs特別是腦葉CMBs發病率增加有關,而ApoEε2基因型與腦梗死相關[20]。本研究并未發現攜帶ApoEε2或ε4的等位基因在腦葉和腦深部CMBs個體中的分布存在差異(P=0.826)。與非CMBs患者比較,合并CMBs的腦梗死人群中有更高的ApoEε2或ε4等位基因攜帶率(P=0.01)。這一點與既往研究結果不盡一致,分析原因認為,不同種族人群CMBs的分布對ApoEε2或ε4基因型的風險依賴可能存在差異。另外,本研究選取急性腦梗死人群為研究對象,不除外腦梗死急性期病理過程導致新發CMBs的可能,因此可能對分析ApoE基因型與CMBs的風險關系產生偏倚。
3.2 CMBs影像學分類與炎性標志物的關系 CMBs不同影像學類型可能預示著不同的發生機制。上面的論述也表明CMBs影像學類型及其發生易感性可能具有ApoE等位基因風險依賴性。既往有研究發現,較高水平的血清炎性標志物(CRP、IL-6和IL-18)與腦深部和腦葉CMBs相關[21]。VEGF具有強烈的促內皮細胞增殖及促進新生血管形成的作用,可使血管通透性增加血漿蛋白滲出,在整合素及基質的作用下誘導內皮細胞增殖、遷移,形成新生血管[22]。當前關于CMBs的發生機制尚未明確,血腦屏障受損是CMBs主要的發生機制假說之一[23]。作為CMBs的兩個常見病因,高血壓和腦淀粉樣血管病變均可導致血腦屏障的損傷。有研究發現腦血管淀粉樣變性(cerebral amyloid angiopathy,CAA)患者中β-淀粉樣蛋白的沉積可導致血腦屏障通透性增加及MMP-2、MMP-9表達增加。VEGF、血管生成素、MMP是促進新生血管形成的主要細胞因子,在促進血腦屏障通透性增加中發揮重要作用。近期國內研究報道AD患者血清VEGF水平與CMBs存在相關性[14]。
在漢族人群ApoE基因分型背景下,CMBs影像學分類與血漿VEGF是否存在相關性,至今仍不清楚。本研究發現,在整體CMBs層面,與CMBs有關的是血漿VEGF水平。基于不同CMBs影像學分類亞組分析發現血漿VEGF能增加CMBs的風險。既往研究發現急性腦梗死合并CMBs患者血清VEGF水平大約是健康人的4倍[24]。近期有研究發現VEGF增高是急性腦梗死患者CMBs發生的獨立危險因素,VEGF水平與CMBs嚴重程度相關[6]。本研究關于血漿VEGF水平與CMBs關系的結果與上述研究一致。上述研究納入的研究對象是發病24 h內的腦梗死患者,且采集血樣的時間在發病24 h內,不除外腦梗死超急性期及急性期病理過程對血漿VEGF等檢測指標的影響。而本研究納入的研究對象是發病48 h的腦梗死患者,且在患者入院第2日的清晨采集血樣標本,即患者發病72 h內采集血樣,盡可能減少上述因素所造成的偏倚。本研究發現腦深部CMBs與高水平血漿VEGF有關。在ApoEε2或ε4患者中,高水平血漿VEGF是腦深部CMBs的風險因素(OR2.83,95%CI1.31~6.10,P=0.008)。提示血漿VEGF在不同CMBs影像學分類亞組與ApoE基因型存在一定的交互作用。這是本研究的創新之處,進一步發現ApoE基因型與血漿VEGF參與CMBs發生易感性風險控制的復雜性。ApoE等位基因型不同狀態對血漿VEGF與CMBs不同影像學類型風險關聯的影響可能由不同的機制介導。
3.3ApoE基因型對血漿VEGF與CMBs風險關聯的影響及其可能機制 眾多研究發現,ApoE是脂蛋白代謝過程中一個重要的調節劑,是心腦血管疾病、AD等慢性疾病重要風險因素之一。ApoE4可能涉及到對線粒體功能的異常調節,與缺血性腦損傷后的惡化結局有關[25]。ApoE基因型與氧化/氮化應激、內質網應激調控、線粒體功能和炎癥反應存在密切的聯系。ApoE蛋白的多功能特性及基因型對疾病風險的影響在很大程度上可能歸因于對氧化/氮化應激狀態的影響或基于ApoE免疫細胞/抗炎特性的影響。
已有大量研究證實了ApoE基因型與氧化應激和衰老過程之間的關聯。ApoE異構體特異性抗氧化能力的順序是ApoE2>ApoE3>ApoE4。ApoE4與氧化應激標志物呈正相關,ApoEε4/ε3雜合子個體中脂質過氧化物水平升高[26-27]。ApoEε4等位基因導致更高的氧化應激和促炎狀態[28-29]。在ApoE ε4攜帶者中發現了高水平的氧化/氮化應激壓力,這可能是ApoEε4和人類疾病之間基因關聯的潛在機制之一[30]。研究發現,ApoE基因多態性通過對細胞內鈣水平調節影響神經元細胞凋亡,所有ApoEε4等位基因型,即ε2/ε4、ε3/ε4和ε4/ε4與AD風險增加相關,而ApoE ε2/ε2、ε2/ε3和ε3/ε3則具有保護作用[31]。提示ApoE基因多態性對疾病狀態影響的復雜性和多樣性。即ApoE不同基因型對氧化應激等生化病理狀態影響是不同的,從而對疾病的發生易感性產生不同的影響[28,32-33]。ApoEε4通過調節炎性分子即增加IL-1和減少IL-10表達水平來調節MMP-9和組織抑制劑(tissue inhibitor of metalloproteinase,TIMP)-1的水平[34]。而MMP是參與合成和降解細胞外基質和具有特定底物的酶,涉及MMP在細胞外基質的重塑。研究發現調節MMP-9水平有助于清除β-淀粉樣蛋白,MMP-9與CMBs密切相關[35-36]。新生血管形成反應存在VEGF、CD31、MMP-2、MMP-9上調和TIMP-1和TIMP-2下調等主要特征,伴有MMP蛋白水解活性增強、血管Ⅳ型膠原和層粘連蛋白的降解,VEGF是血管炎癥發生過程中重要的趨化因子[37-39]。VEGF和MMP都至少部分受到氧化應激的調節,這一病理過程與CMBs是密切相關的。在一定程度上,VEGF和ApoE蛋白的表達可能受ApoEε4基因型調控[40]。不同亞型的ApoE對包括VEGF在內的細胞因子的調控發揮的作用不同[41]。由于VEGF表達受缺氧、氧化應激和氮化應激等因素調控,推測ApoE不同基因型影響VEGF參與CMBs的機制,可能是通過調控氧化或氮化應激等炎性機制影響VEGF的表達,從而參與內皮細胞功能的調節。
本研究結果表明,ApoE基因型可能對CMBs發生風險相關炎性細胞因子,例如血管內皮細胞調節因子VEGF致病風險產生修飾作用。在遺傳基因方面,ApoE基因型可能是唯一增加CMBs發生風險的敏感性因素。然而ApoE基因型方法在診斷CMBs方面的能力是有限的。因此,結合易感基因分型策略,聯合其他體液生物標志物進行評估,可能是進行CMBs早期篩查診斷的有效手段。在整體CMBs層面,血漿VEGF水平與CMBs有關。血漿VEGF在不同的CMBs影像學分類亞組與ApoE基因型存在交互作用。本研究結果提示ApoE基因型狀態可能影響血漿VEGF與CMBs發生風險及其影像學分類的內在聯系,即血漿VEGF對CMBs風險作用可能存在ApoE基因型依賴。尤其是那些攜帶ε2或ε4等位基因者,對血漿VEGF的綜合評價可能有助于CMBs的早期診斷和預測。
本研究仍存在一些局限性:①屬于橫斷面研究,僅在單個時間點進行MRI評估和VEGF檢測。尚不清楚急性腦梗死的病程是否會對患者血清VEGF產生影響。為了盡可能減少非同期評估及急性腦梗死病程等混雜因素對研究結果的影響,在患者發病后的72 h內完成頭顱MRI并采集血、尿相關樣本并保存進行檢測;②本研究采用漢族人群為研究對象,鑒于不同種族的差異性,本研究結果不能推廣到其他種族人群。是否存在其他未知的影響ApoE基因型/CMBs風險關聯的調節因子,仍不清楚,需要將來進一步研究。
【點睛】基于載脂蛋白E基因分型研究發現腦深部腦微出血與高水平血漿血管內皮生長因子有關。血漿血管內皮生長因子與腦微出血的風險聯系可能存在載脂蛋白E基因型依賴。

