lncRNA TUG1對高糖誘導的小鼠足細胞MPC5凋亡的影響
馬 媛,張大鵬,王 想,任 蕾
1)駐馬店市中心醫院內分泌科 河南駐馬店 463000 2)鄭州大學第一附屬醫院內分泌科 鄭州 450052
糖尿病腎病是糖尿病重要的并發癥之一,表現為腎功能衰退、高血壓、蛋白尿等,糖尿病腎病也是終末期腎病發生的主要原因[1]。大鼠足細胞凋亡是糖尿病腎病發生的重要病理變化[2]。牛磺酸調節基因1(taurine up-regulated gene 1,TUG1)是一種長鏈非編碼RNA(long non-coding RNA, lncRNA),在人體正常細胞功能維持以及疾病發生過程中發揮關鍵作用[3]。研究[4]發現,TUG1不僅參與腫瘤的發生發展過程,還參與動脈粥樣硬化等疾病的發生過程。前期研究[5]表明,TUG1與糖尿病腎病足細胞的能量代謝有關,TUG1在糖尿病腎病發生過程中表達下調。該研究用小鼠足細胞MPC5體外構建糖尿病腎病足細胞損傷模型,觀察內質網應激標志蛋白表達的變化,探討TUG1在高糖條件下足細胞凋亡中的作用,為明確TUG1在糖尿病腎病損傷中的作用提供參考,為基因治療糖尿病腎病提供思路。
1 材料與方法
1.1細胞及主要試劑小鼠足細胞MPC5購自美國ATCC細胞庫,細胞培養條件為飽和濕度、37 ℃、體積分數5%CO2培養箱,培養基為含體積分數10%胎牛血清的DMEM;反轉錄試劑盒購自大連TaKaRa公司;裂解的半胱氨酸天冬氨酸蛋白酶12(Cleaved-Caspase-12)、裂解的多聚ADP核糖聚合酶(Cleaved-PARP)抗體購自美國Santa Cruz 公司;內質網應激標志蛋白C/EBP同源蛋白(CHOP)、磷酸化真核細胞翻譯起始因子2α(p-eIF2α)、78 000葡萄糖調節蛋白(GRP78)抗體購自美國Abcam公司;TUG1過表達CMV-EGFP慢病毒和陰性對照PMT406空載體慢病毒均由北京合生基因科技有限公司構建。
1.2細胞分組及處理足細胞分別用含5.5和25.0 mmol/L葡萄糖的細胞培養液培養,記為對照組(A組)和高糖組(B組)。MPC5細胞培養至對數生長期后接種到24孔板,每孔105個細胞,細胞融合度為50%左右時添加慢病毒液(MOI=15),同時加入5 mg/L聚凝胺,感染12 h后更換細胞培養液,繼續培養48 h后以含1 mg/L聚凝胺的細胞培養液培養7 d,篩選穩定感染的細胞。感染TUG1過表達慢病毒和陰性對照慢病毒的MPC5細胞以含25.0 mmol/L葡萄糖的細胞培養液培養,記為陰性對照高糖組(C組)和TUG1過表達高糖組(D組)。每組3個復孔。
1.3qRT-PCR檢測各組MPC5細胞中TUG1的表達4組細胞培養48 h后,采用qRT-PCR方法檢測細胞中TUG1的表達。PCR引物由南京金斯瑞生物科技公司合成,序列如下:β-actin 上游引物5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物5’-TG TAGACCATGTAGTTGAGGTCA-3’;TUG1上游引物5’-TAACAGCCCTCCACTCCAGAT-3’, 下游引物5’-AGGCACCAGCTTCAAAACCC-3’。以Trizol試劑提取細胞總RNA,然后用紫外分光光度計測定RNA濃度及純度。用反轉錄試劑盒進行反轉錄,體系為4 μL 4×Prime Script Buffer、2 μL總RNA、1 μL Oligod T 引物、1 μL反轉錄酶混合液Ⅰ、1 μL隨機六核苷酸引物,添加無RNA酶水至20 μL。反轉錄條件:37 ℃孵育15 min,85 ℃孵育5 s。PCR反應體系:上下游引物各1 μL、2 μL cDNA、1.6 μL DyeROX、10 μL 2×SYBR Premix Ex TaqⅡ,添加 ddH2O至20 μL。PCR反應條件:95 ℃孵育30 s,95 ℃孵育10 s,60 ℃孵育30 s,共40個循環。按照2-ΔΔCt法計算TUG1相對表達量。實驗重復3次。
1.4細胞凋亡率的檢測4組細胞培養48 h后,添加2.5 g/L的胰蛋白酶將細胞消化成單細胞懸浮液,PBS洗滌后將細胞懸浮在250 μL的結合緩沖液中,然后在細胞中添加5 μL的PI以及5 μL的Annexin V-FITC溶液,室溫下孵育15 min,添加300 μL的結合緩沖液,用流式細胞儀檢測細胞凋亡率。實驗重復3次。
1.5Western blot法測定細胞中Cleaved-Caspase-12、Cleaved-PARP、CHOP、p-eIF2α、GRP78蛋白的表達4組細胞培養48 h后,添加蛋白提取試劑,冰上裂解20 min,高速離心后吸取上清,用BCA方法進行定量。將蛋白樣品同Loading Buffer混勻煮沸變性后添加到樣品孔內,每孔30 μg,先80 V恒壓電泳約30 min,然后以120 V的電壓電泳2 h。將凝膠上的蛋白轉移到PVDF膜上,然后將PVDF膜放在封閉液中,室溫孵育1 h。取出PVDF膜,置于一抗稀釋液(Cleaved-Caspase-12、Cleaved-PARP稀釋度為1∶800,CHOP、p-eIF2α、GRP78稀釋度為1∶1 000)中,4 ℃過夜。PVDF膜與HRP標記的二抗在室溫中孵育2 h后,ECL顯色發光,定影,用Quantity One軟件測定蛋白條帶的灰度值,目的蛋白相對表達量=目的蛋白條帶灰度值/β-actin條帶灰度值。實驗重復3次。
1.6統計學處理采用SPSS 21.0分析數據。不同組間TUG1表達、Cleaved-Caspase-12、Cleaved-PARP、CHOP、p-eIF2α、GRP78蛋白相對表達量和細胞凋亡率的比較均采用單因素方差分析,兩兩比較采用LSD-t檢驗。檢驗水準α=0.05。
2 結果
2.1 4組細胞TUG1表達、凋亡率和Cleaved-Caspase-12、Cleaved-PARP蛋白相對表達量的比較結果見圖1和表1。與A組相比,B、C、D組細胞凋亡率升高,Cleaved-Caspase-12、Cleaved-PARP蛋白相對表達量升高;與B、C組相比,D組細胞凋亡率降低,Cleaved-Caspase-12、Cleaved-PARP蛋白相對表達量降低。
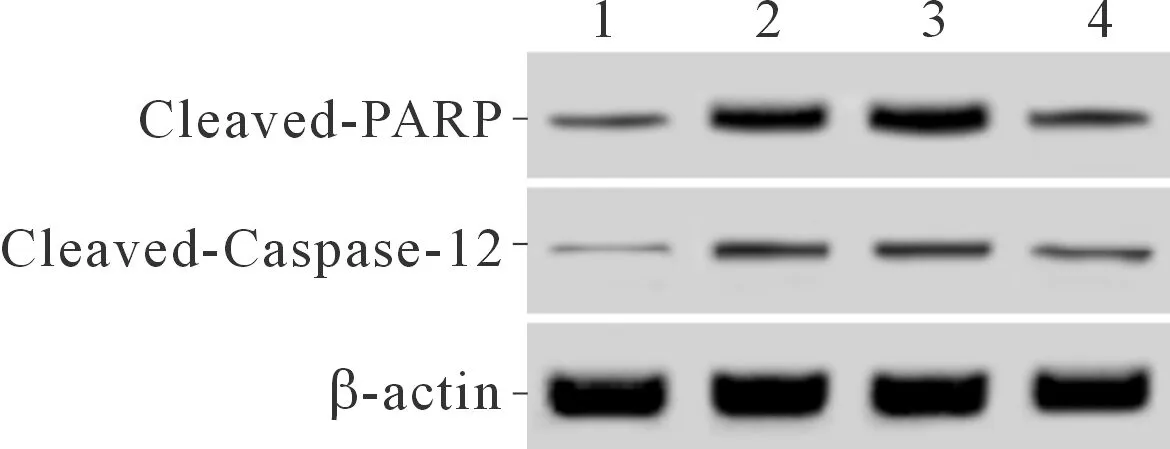
1:A組;2:B組;3:C組;4:D組
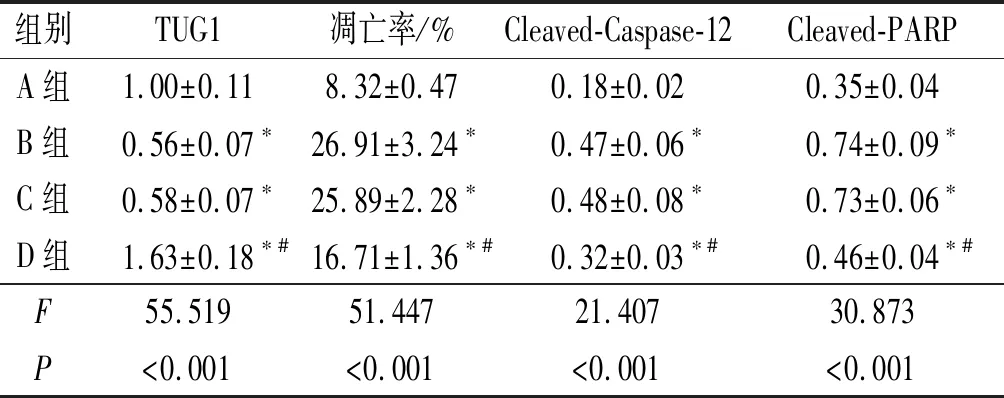
組別TUG1凋亡率/%Cleaved-Caspase-12Cleaved-PARPA組1.00±0.118.32±0.470.18±0.020.35±0.04B組0.56±0.07?26.91±3.24?0.47±0.06?0.74±0.09?C組0.58±0.07?25.89±2.28?0.48±0.08?0.73±0.06?D組1.63±0.18?#16.71±1.36?#0.32±0.03?#0.46±0.04?#F55.51951.44721.40730.873P<0.001<0.001<0.001<0.001
*:與A組比較,P<0.05;#:與B、C組比較,P<0.05
2.2 4組細胞中CHOP、p-eIF2α、GRP78蛋白相對表達量的比較結果見圖2和表2。與A組相比,B、C、D組細胞中CHOP、p-eIF2α、GRP78蛋白相對表達量升高;與B、C組相比,D組細胞中CHOP、p-eIF2α、GRP78蛋白相對表達量降低。
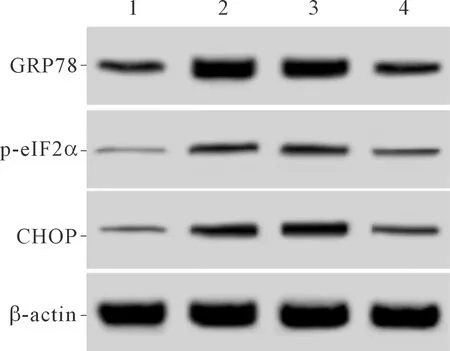
1:A組;2:B組;3:C組;4:D組
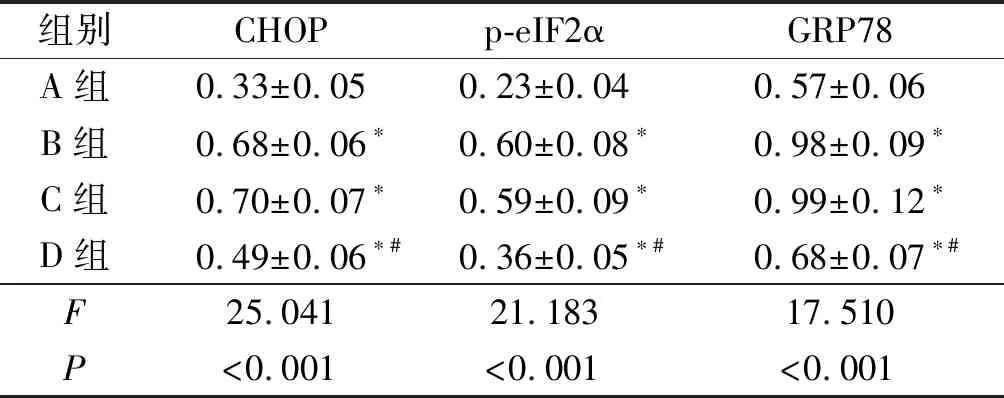
組別CHOPp-eIF2αGRP78A組0.33±0.050.23±0.040.57±0.06B組0.68±0.06?0.60±0.08?0.98±0.09?C組0.70±0.07?0.59±0.09?0.99±0.12?D組0.49±0.06?#0.36±0.05?#0.68±0.07?#F25.04121.18317.510P<0.001<0.001<0.001
*:與A組比較,P<0.05;#:與B、C組比較,P<0.05
3 討論
糖尿病腎病作為終末期腎病發生的首位病因,其發生機制十分復雜,腎小球基底膜增厚是常見的病理變化[6]。足細胞功能異常是糖尿病腎病發生的機制之一,也是腎小球硬化和蛋白尿產生的重要原因[7]。陳恩平等[8]用高糖處理永生化小鼠足細胞后發現Bax表達升高,Bcl-2表達降低,細胞凋亡率升高,證明高糖可誘導足細胞凋亡。本實驗結果顯示,高糖處理后的足細胞凋亡率增加,Cleaved-Caspase-12、Cleaved-PARP蛋白表達水平升高。Caspase-12是Caspase蛋白家族的成員,其只有被激活形成Cleaved-Caspase-12才可以發揮促凋亡作用[9]。PARP也是細胞凋亡發生的促進因子,其被活化后形成Cleaved-PARP是細胞凋亡發生的標志之一[10]。本實驗結果說明高糖可誘導足細胞發生凋亡。
TUG1是一個在小鼠視網膜中發現的lncRNA,定位在22q12.2染色體上,參與血管生成、細胞耐藥等過程,還與人體腫瘤發生有關[11]。Lei等[5]發現在鏈脲佐菌素誘導的糖尿病大鼠和高糖處理的MPC5細胞中TUG1水平降低,高糖處理的MPC5細胞凋亡增加;黃芪甲苷Ⅳ處理可上調TUG1表達水平并減少足細胞凋亡,說明TUG1可能參與糖尿病腎病的發生發展。Long等[12]發現,TUG1參與了糖尿病腎病足細胞的能量代謝,誘導足細胞產生ATP。本實驗結果表明,高糖處理后的足細胞中TUG1表達水平降低,與上述研究結果一致;過表達TUG1高糖誘導的足細胞凋亡率顯著降低,Cleaved-Caspase-12、Cleaved-PARP表達水平降低,說明過表達TUG1可以抑制高糖誘導的足細胞凋亡,TUG1在糖尿病腎病足細胞損傷中可能發揮保護作用。
CHOP、p-eIF2α、GRP78是內質網應激的標志蛋白,近些年來,內質網應激被認為是細胞凋亡發生的途徑之一,內質網應激發生時GRP78大量表達,并激活CHOP和Caspase-12,誘導細胞凋亡;PERK與GRP78解離后活化eIF2α,活化的eIF2α誘導CHOP的表達進而誘導細胞凋亡[13-14]。研究[15]顯示高糖處理的足細胞中GRP78、p-PERK、Caspase-12蛋白表達水平升高。本實驗結果顯示,高糖誘導的足細胞中CHOP、p-eIF2α、GRP78蛋白表達水平升高,過表達TUG1高糖誘導的足細胞中CHOP、p-eIF2α、GRP78蛋白表達水平降低,表明TUG1可能通過減弱高糖誘導的足細胞內質網應激而抑制細胞凋亡發生,這可能是TUG1調控細胞凋亡的機制之一。
總之,TUG1在糖尿病腎病進展中可能發揮保護作用,過表達TUG1可能通過抑制內質網應激而減少高糖誘導的足細胞凋亡。本實驗結果為明確TUG1在糖尿病腎病發生中的作用提供了參考,為基因靶向治療糖尿病腎病提供了可能。

