高脲酶活性褐土的宏基因組測序與微生物來源脲酶基因的篩選
軒貝貝,郭建華,王愛國,牟文君,戴華鑫,閆 鼎,蔡憲杰,奚家勤,薛超群,周漢平,張艷玲,胡利偉*,宋紀真
1. 中國煙草總公司鄭州煙草研究院,鄭州高新技術產業開發區楓楊街2 號450001
2. 上海煙草集團有限責任公司采購中心, 上海市楊浦區長陽路717 號 200082
脲酶(Urease),是土壤中水解尿素的主要酶類,可將施入土壤的尿素水解成氨離子,然后氨離子被氨氧化細菌硝化成NO3-。有研究表明,目前我國尿素肥效一般為20%~35%,通常情況下常低于30%,其重要原因之一是土壤脲酶過多或者活性過高導致尿素分解過快,致使其利用率降低[1-2]。一般認為,土壤脲酶與其他從生物體中分離的純脲酶在性質上存在很大差異,土壤脲酶只對尿素而不能對尿素衍生物起催化作用。有研究表明,土壤脲酶活性與有機物、全氮、速效磷含量和土壤微生物數量呈正相關,是評價土壤氮素狀況、土壤生產力等的重要指標[3]。土壤脲酶通常是由簡單蛋白構成的生物催化劑,一般由土壤微生物產生,而不同微生物所產生的脲酶單體結構、數目與類型不完全相同。脲酶基因簇由結構基因、輔助基因和調節基因三部分組成。一般情況下,脲酶結構基因位于調節基因的上游,結構基因編碼α、β、γ亞基,構成沒有活性的脲酶酶原;輔助基因通常編碼UreD、UreE、UreF、UreG 和UreH 等亞基,其作用是協助鎳離子轉運到無活性的脲酶酶原上,以激活脲酶[4-6]。目前對產脲酶細菌的研究相對較多,克氏桿菌(Klebsiella)和巴氏桿菌(Pasteurella)所產生的脲酶結構只有結構基因編碼的三聚體[7-8]。另外腐生性葡萄球菌(Staphylococcus saprophyticus)和雷葡萄球菌(Staphylococcus leei)產生的脲酶結構為四聚體和五聚體[9-11]。盡管亞基單位數存在差異,但是從蛋白序列比對結果來看,真菌和細菌來源的脲酶具有較高的同源性[12]。土壤中好氧性微生物、微好氧性微生物、厭氧性微生物均能水解尿素,土壤細菌、真菌甚至古細菌都能分泌脲酶[13]。Alizadeh等[14]對新西蘭牧場土壤的研究發現,腸桿菌(Enterobacter ludwigii)、綠針假單胞菌(Pseudomonas chlororaphis)、變形斑沙雷菌(Serratia proteamaculans)、克氏耶爾森菌(Yersinia kristensenii)等9 種細菌以及瓜枝孢菌(Cladosporium cladosporioides)、黃色鐮孢菌(Fusarium culmorum)、肉色擬青霉(Paecilomyces carneus)和小刺青霉(Penicillium spinulosum)等24 種真菌參與了牧場土壤中尿素的代謝,并且具有較強的脲酶活性;李萌等[15-16]從苗圃中分離得到芽孢桿菌(Bacillus)和芽孢八疊球菌(Sporosarcina)等,其分泌脲酶的酶活性均較高,表明產脲酶微生物在土壤中是廣泛存在的。
目前以Roche/454 FLX、Illumina/Solexa 和SOLID system 等為代表的第二代測序技術已比較成熟,二代測序技術通量高、成本較低[17-19],也越來越多地被應用于宏基因組學的研究。宏基因組學一般是通過采集環境樣品,以整個環境微生物為研究對象,以測序分析為研究手段,研究環境中微生物的多樣性、種群結構、進化關系、基因功能及分類等[20]。絕大多數的環境微生物處于可檢測但不可分離狀態,導致通過分離培養來研究相關功能微生物的效果并不理想,而宏基因學技術則是直接提取環境樣本DNA 進行測序,克服了傳統培養方法的缺陷,且通量高,信息獲取也較為全面。因此,在環境微生物和醫學微生物等領域得到較為廣泛應用[21-22]。褐土是河南煙葉產區的代表性土壤,分布于鄭州、三門峽、洛陽、許昌、平頂山、安陽等地[23]。有研究表明,與潮土和棕壤相比較,褐土施用尿素后,氨釋放較快[24],這與褐土中產脲酶微生物的種類與數量是否有關目前尚不清楚。為此,在鄭州、洛陽、許昌、平頂山和安陽等產區采集褐土樣品,測定其脲酶活性,并將脲酶活性較高的土壤樣品用富集培養基培養,提取土壤DNA。利用Hiseq XTen 平臺進行宏基因組測序,深度挖掘并篩選脲酶基因,然后對其進行物種注釋,旨在從分子水平上揭示褐土中產脲酶微生物的群落構成與物種來源。
1 材料與方法
1.1 土壤樣品的采集
2018 年6~10月在河南省平頂山市郟縣、洛陽市洛寧縣、許昌市襄城縣、鄭州市上街區和滎陽市、安陽林州市等產區進行土壤樣品采集,取0~10 cm表層土壤樣品,采用5 點混合采樣法,將混合土壤樣品剔除砂石和植物殘體后裝入塑料袋,密封后帶回實驗室置于低溫通風處(10~15 ℃)保存。每個地級市取樣10 份,共取土樣50 份。
1.2 土壤脲酶活性的測定
將土壤樣品在干燥箱(北京普立泰科儀器有限公司)中風干,過2 mm篩后放在通風、干燥處待測,采用靛酚藍比色法進行土壤脲酶活性的檢測,按照土壤脲酶測試盒(蘇州科銘生物技術有限公司)的說明書進行檢測,每個土壤樣品分別測定3 次生物學重復。
1.3 產脲酶菌的富集培養
根據文獻[25]進行產脲酶菌富集培養基的配制,即在0.95 L去離子水中加入蛋白胨1.0 g,氯化鈉1.2 g,磷酸二氫鉀0.8 g,葡萄糖1.5 g,硫酸鎳0.1 g,酚紅0.016 g,然后調節pH 至7.0,121 ℃高壓滅菌20 min后,待溫度降至30 ℃以下時,加入50 mL 過濾除菌的尿素溶液(內含20 g 尿素)。
分別從洛陽、許昌、鄭州、安陽和平頂山等產區采集的土樣中選取脲酶活性較高的土樣,即XC-10、ZZ-07、AY-06、LY-07 和PDS-01 等5 個樣品,每個土壤樣品分別稱取3 次,每次稱取10 g,共計15 份,分別加入含有50 mL 高濃度尿素液體培養基的250 mL三角瓶中,在30 ℃、180 r/min 條件下搖菌培養24 h,然后將其混合后直接提取DNA。采用土壤DNA 提取試劑盒(美國OMEGA 生物科技公司)提取DNA,具體操作按照試劑盒說明書進行。
1.4 宏基因組測序
采用Covaris ME220(美國Covaris 公司)將DNA片段打斷,用Agencourt AMPure XP 核酸純化試劑盒(德國Beckman Coulter 公司)將破碎后的DNA 片段濃縮回收。利用Next?UltraTMIIDNA 文庫制備試劑盒(英國NEB 公司)構建高質量文庫,接著采用Next Q5 Hot Start HiFi PCR 預混液(英國NEB 公司)進行文庫的擴增并純化擴增產物,使用生物分析儀(Agilent 2100,美國Agilent 公司)確定擴增產物片段大小、純度和濃度,最后采用Hiseq XTen 平臺(美國Illumina公司)進行測序。
1.5 基因預測與生物信息學分析
由于測序結果中存在一定比例的測序錯誤,所以獲得測序原始數據后,采用FastQC 軟件對原始數據進行質量評估與過濾,過濾后得到有效數據,然后對各樣本的有效序列進行拼接組裝[26-27],獲得拼接后的重疊群即Contigs,明確各個Contigs 的先后順序,并綜合評定多個Kmer 的組裝結果。采用Prodigal 對最佳拼接結果進行ORF 預測[28],并將長度≥100 bp的基因序列翻譯成氨基酸序列。采用CD-HIT 軟件對基因預測結果進行去冗,獲得非冗余的基因集[29]。采用Bowtie2 將各樣本序列比對到非冗余基因集序列上[30-31]。將獲得的基因翻譯成蛋白序列與包括NR等在內的相關數據庫進行比對,獲得基因功能及物種注釋信息[32-34]。
2 結果與分析
2.1 褐土脲酶酶活性的檢測
從河南平頂山、洛陽、許昌、鄭州、安陽等產區采集褐土土壤樣品進行脲酶活性檢測,每天每克土樣中產生1 μg NH3-N 定義為一個酶活性單位。結果表明,脲酶活性最高的為來自洛陽市洛寧縣的土壤樣品LY07,脲酶活性為67.18 μg·d-1·g-1,最低的是來自平頂山郟縣的土壤樣品PDS-10,為8.34 μg·d-1·g-1。脲酶活性在0~20、20~40、40~60 和60~80 μg·d-1·g-1之間的土壤樣品分別有3、16、28 和3 個,所占比例分別為6%、32%、56%和6%,見圖1。其中,鄭州、洛陽、許昌、安陽和平頂山等地土壤樣品中脲酶活性最高值分別為46.98、67.18、57.68、45.97 和64.15 μg·d-1·g-1,見表1。
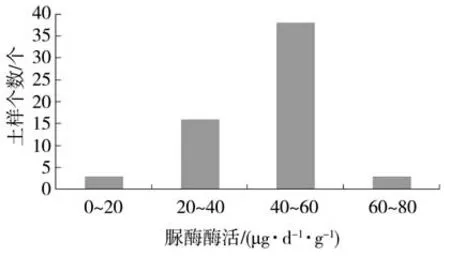
圖1 褐土脲酶活性的分布區間Fig.1 Distribution interval of urease activity in cinnamon soil
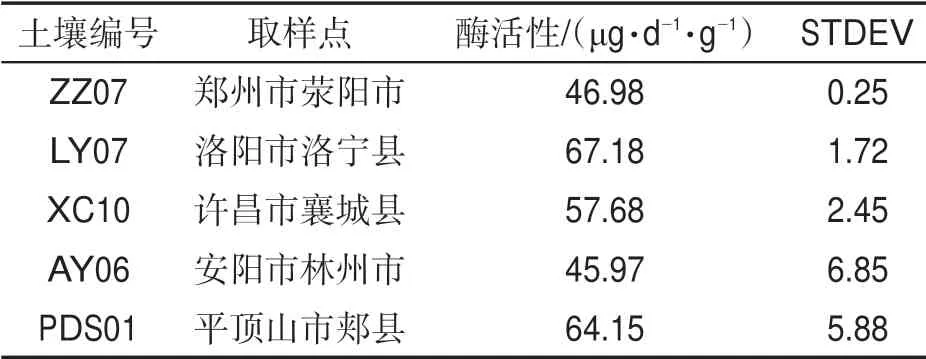
表1 褐土取樣點及脲酶活性Tab.1 Sampling sites and urease activity of cinnamon soil
2.2 褐土中產脲酶微生物的富集培養與宏基因組測序
選取各產區的脲酶活性最高的土壤樣品XC10、ZZ07、AY06、LY07 和PDS01,采用高濃度尿素液體培養基進行富集培養,混合后提取土壤DNA 并進行宏基因組測序。初步獲得總數據量約31.43 Gb,拼接后獲得855.32 Mb 基因組數據,組裝后的N50為1 251 bp,N90為558 bp,平均長度1 138 bp,GC 含量為54.96%,見表2。

表2 宏基因組的測序結果Tab.2 Results of metagenome sequencing
2.3 基因預測與脲酶蛋白篩選
使用Prodigal 對拼接的Contigs 進行序列翻譯和ORF 預測,拼接獲得約855 Mb 基因組數據,共預測基因1 375 921 個,并篩選到406 個脲酶結構蛋白與437 個脲酶輔助蛋白。
篩選到的406個脲酶結構蛋白中有234個α亞基、85 個β亞基、87 個γ亞基;437 個脲酶輔助蛋白中有110 個UreD 亞基、81 個UreE 亞基、102 個UreF 亞基、114 個UreG 亞基、19 個UreH 亞基以及11 個UreJ 亞基,見圖2。利用NCBI 中的NR 數據庫中已經收錄的蛋白序列與篩選的脲酶蛋白序列進行BLASTP 分析,結果表明,406 個脲酶結構蛋白和NCBI 的NR 數據庫中收錄蛋白的同源性為40.7%~100%,437 個脲酶輔助蛋白和NR 數據庫中已收錄蛋白的同源性為29.4%~100%。
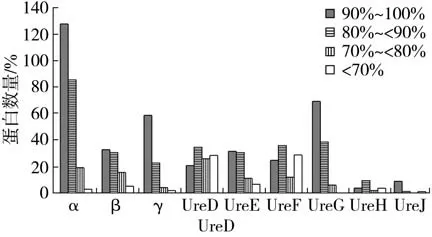
圖2 不同脲酶蛋白亞基數量與NR 數據庫中的序列同源性Fig.2 Number and sequence homology in NR database of different urease protein subunits
2.4 脲酶和脲酶輔助蛋白的來源
利用NCBI 中的NR 數據庫將406 個脲酶結構蛋白和437 個脲酶輔助蛋白進行BLASTP 比對,結果表明,褐土中與細菌來源的脲酶蛋白同源性較高的有797 個,包括384 個脲酶結構蛋白和413 個輔助蛋白;19 個脲酶結構蛋白和23 個脲酶輔助蛋白與古細菌來源的脲酶蛋白同源性較高;與真菌來源的脲酶蛋白同源性較高的有4 個,包括3 個脲酶結構蛋白和1個脲酶輔助蛋白。
將同源性大于95%的細菌來源的脲酶蛋白進行歸類,共篩選出190 個脲酶蛋白,包括脲酶結構蛋白106 個,脲酶輔助蛋白84 個。注釋到的細菌主要有鏈霉菌屬(Streptomyces)、節桿菌屬(Arthrobacter)、不動桿菌屬(Acinetobacter)、假單胞菌屬(Pseudomonas)、叢毛單胞菌屬(Comamonas)和貪銅菌屬(Cupriavidus),表明這些屬的細菌在褐土尿素水解過程中發揮著關鍵作用。其中來源于鏈霉菌屬(Streptomyces)、節桿菌屬(Arthrobacter)、不動桿菌屬(Acinetobacter)、假單胞菌屬(Pseudomonas)、叢毛單胞菌屬(Comamonas)和貪銅菌屬(Cupriavidus)等的脲酶蛋白數量均大于10 個,分別為48、32、19、16、12 和10 個,由不同數量的脲酶結構蛋白和脲酶輔助蛋白組成。不同細菌來源的脲酶結構蛋白和脲酶輔助蛋白數量見表3。
將同源性小于95%的細菌來源的脲酶蛋白進行歸類,結果見表3。表3表明,與芽孢桿菌屬(Bacillus)、節桿菌屬(Arthrobacter)、鏈霉菌屬(Streptomyces)、芽孢八疊球菌屬(Sporosarcina)、類芽孢桿菌屬(Paenibacillus)、假單胞菌屬(Pseudomonas)、鞘氨醇桿菌屬(Sphingobacterium)和硝化螺旋菌屬(Nitrospira)等來源的脲酶蛋白的序列同源性相對較高。說明褐土中產脲酶細菌可能與上述屬的親緣關系較近。此外,還篩選到42 個來源于古細菌的脲酶蛋白,脲酶結構蛋白亞基α、β、γ和脲酶輔助蛋白亞基UreD、UreE、UreF 和UreG 等均被篩選到,其中29 個脲酶蛋白來源于亞硝化球菌屬(Nitrososphaera);另外有4 個脲酶蛋白來源于氨氧化古菌屬(Nitrosopumilus),3 個脲酶蛋白來源于奇古菌(Thaumarchaeota archaeon MY3),見表4。
褐土中真菌來源的脲酶蛋白共篩選到3 個脲酶結構蛋白和1 個脲酶輔助蛋白,與NR 數據庫中收錄蛋白的同源性為81.2%~94.4%。1個α亞基(CSU_orf_949809)和UreG 亞基(CSU_orf_743410)與足馬杜拉分枝菌(Madurella mycetomatis)來源的脲酶蛋白同源性較高,而另外1 個α(CSU_orf_949808)和β亞基(CSU_orf_968211)分別來源于藍莓枝枯病菌(Neofusicoccum parvum)和嗜熱毛殼菌(Chaetomium thermophilum)。
2.5 富集培養后褐土中產脲酶微生物的豐度
從圖3中可以看出,用尿素培養基富集培養的褐土中優勢菌群為芽孢桿菌屬(Bacillus),占17.48%;其次為短芽孢桿菌屬(Brevibacillus),占13.64%,以及節 桿 菌 屬(Arthrobacter,8.07%)、 鏈 霉 菌 屬(Streptomyces,7.88%)、叢毛單胞菌屬(Comamonas,6.62%)、類芽孢桿菌屬(Paenibacillus,4.15%)和不動桿菌屬(Acinetobacter,3.46%)等6 個屬所占比例大于60%;其他所占比例超過1%的屬有黃桿菌屬(Flavobacterium)、貪銅菌屬(Cupriavidus)、芽孢八疊球 菌 屬 (Sporosarcina)、鞘 氨 醇 桿 菌 屬(Sphingobacterium)、假單胞菌屬(Pseudomonas)和霉菌屬(Agromyces)等。
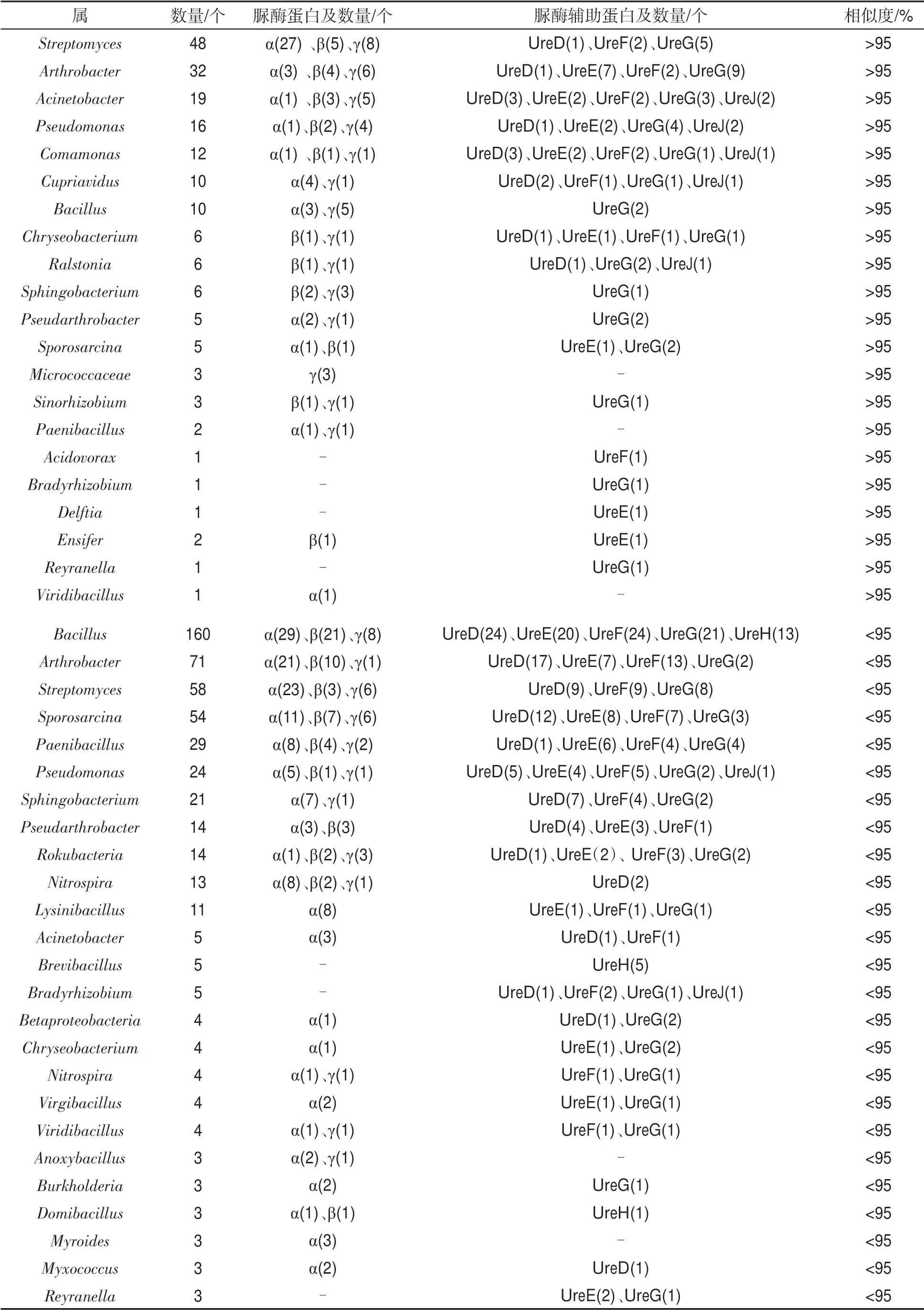
表3 來源于細菌的脲酶蛋白亞基及數量①Tab.3 Number and subunits of urease protein from bacteria
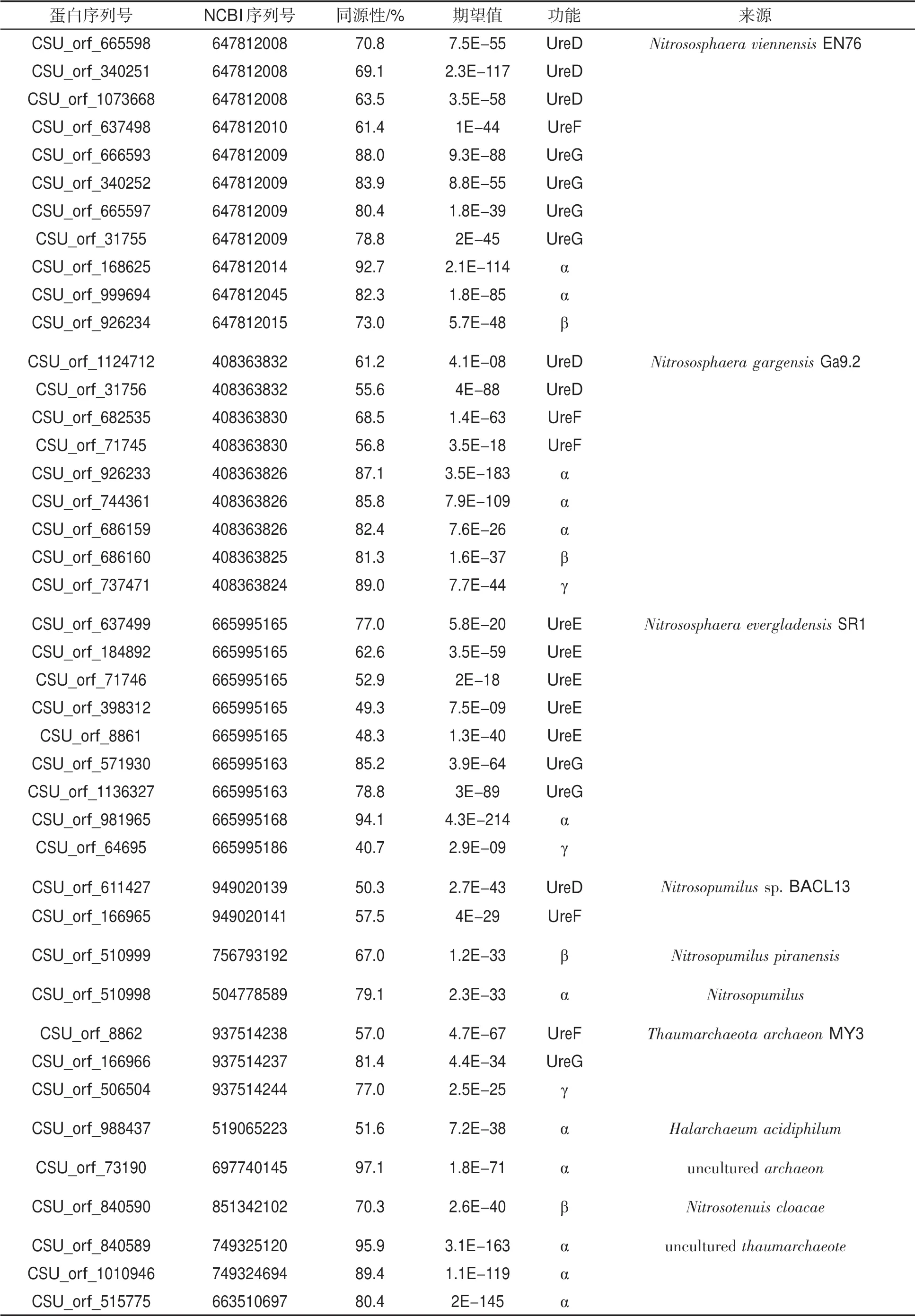
表4 古細菌來源的脲酶蛋白及同源性Tab.4 Urease protein subunits from archaea and sequence homology

圖3 富集培養后褐土中產脲酶微生物的豐度Fig.3 Abundance of urease-producing microbes in richly cultured cinnamon soil
3 討論
土壤中存在大量的產生脲酶微生物,土壤脲酶作為土壤中最重要的酶類之一,其活性已成為表征土壤氮素狀況等的重要指標[35]。土壤有機質、全氮、全磷含量會直接或間接影響脲酶活性,而不同土壤類型其脲酶活性存在較大差異[36],土壤中的脲酶活性隨著尿素及磷肥施用量的增加而有所降低[37]。本研究結果顯示,河南省多地土壤脲酶活性在8.34~67.18 μg·d-1·g-1之間,在脲酶活性較高的土壤樣品中篩選到406 個脲酶結構蛋白與437 個脲酶輔助蛋白,這些脲酶蛋白大多來源于產脲酶細菌,這與前人研究結果基本一致[38]。
褐土中細菌來源的脲酶蛋白與NCBI 收錄的脲酶同源性在95%以上的有190 個,僅占23.84%,表明褐土土壤中存在著大量產脲酶細菌還未被發掘和利用。物種注釋結果顯示,褐土中產脲酶細菌主要為鏈霉菌屬(Streptomyces)、節桿菌屬(Arthrobacter)、不動桿菌屬(Acinetobacter)、假單胞菌屬(Pseudomonas)、叢毛單胞菌屬(Comamonas)、貪銅菌屬(Cupriavidus)、芽孢桿菌屬(Bacillus)、金黃桿菌屬(Chryseobacterium)、勞爾氏菌屬(Ralstonia)、鞘氨醇桿菌屬(Sphingobacterium)和芽孢八疊球菌屬(Sporosarcina)等,這些產脲酶菌廣泛存在于不同類型的土壤中。其中假單胞菌屬(Pseudomonas)和貪銅菌屬(Cupriavidus)在新西蘭牧場土壤中曾被分離到[4];芽孢桿菌屬(Bacillus)在馬來西亞熱帶沼澤地泥炭中被分離到[25];芽孢八疊球菌屬(Sporosarcina)和芽孢桿菌屬(Bacillus)在我國苗圃土壤中被分離到[15-16]。除以上篩選注釋的產脲酶微生物之外,對相似度在95%以下的脲酶蛋白進行歸類結果顯示,褐土中還可能存在與鞘氨醇桿菌屬(Sphingobacterium)、類芽孢桿菌屬(Paenibacillus)等或者與其親緣關系較近的產脲酶微生物。還發現了古細菌中亞硝化球菌屬(Nitrososphaera)和氨氧化古菌屬(Nitrosopumilus)可能也參與了尿素的降解過程。宏基因組測序結果中篩選的真菌來源的脲酶結構蛋白和脲酶輔助蛋白均較少,可能是因為富集培養基不適合真菌的生長繁殖,且真菌基因組較大,拼接獲得單個脲酶蛋白的幾率可能會隨之降低[39],也有研究顯示真菌在不同環境中的數量變化較大[40]。因此,在針對真菌的富集培養基優化、挖掘真菌來源的脲酶方面尚有待進一步研究。
4 結論
河南褐土中產脲酶微生物的來源豐富,通過分析宏基因組測序數據,篩選到406 個脲酶結構蛋白和437 個脲酶輔助蛋白基因。物種注釋表明,褐土中產脲酶細菌最多,主要有鏈霉菌屬(Streptomyces)、節桿菌屬(Arthrobacter)、不動桿菌屬(Acinetobacter)等。褐土中還存在部分產脲酶古細菌,與亞硝化球菌屬(Nitrososphaera)和氨氧化古菌屬(Nitrosopumilus)等親緣關系較近,這說明古細菌可能也參與了褐土中尿素的降解;還鑒定出極少量的產脲酶真菌,與其親緣關系較近的有足馬杜拉分枝菌(Madurella mycetomatis)、藍莓枝枯病菌(Neofusicoccum parvum)和嗜熱毛殼菌(Chaetomium thermophilum)等。篩選到的脲酶結構蛋白和脲酶輔助蛋白顯示,褐土中產脲酶微生物具有高度多樣性,也表明參與褐土尿素降解的脲酶是一個極其復雜的多物種來源的酶系復合體,同時也證明富集培養后進行宏基因組測序對脲酶基因的挖掘和物種注釋是較為可行和有效的方法。

