經皮支架輔助內鏡下壞死組織清除術治療胰腺壞死組織感染
汪鵬 李剛 柯路 葉博 周晶 童智慧 李維勤,
1南方醫科大學第一臨床醫學院附屬金陵醫院(解放軍東部戰區總醫院)普通外科,南京 210002;2南京大學醫學院附屬金陵醫院(解放軍東部戰區總醫院)普通外科,南京 210002
目前,以微創引流技術為核心的階梯(step-up)模式已成為胰腺壞死組織感染(infected pancreatic necrosis,IPN)的標準處理策略[1-3],其具體處理流程為:對于感染或懷疑感染的胰腺炎局部壞死集聚或壞死包裹,首先通過經皮穿刺或內鏡下置管引流,如病情不能緩解,則采用多種微創技術進行壞死組織清創;對于不能通過置管引流或清創術控制病情的病例,給予剖腹手術治療[4]。該模式中應用較多的微創引流技術是視頻輔助腹膜后清創術(videoscopic-assisted retroperitoneal debridement,VARD)和腹膜后小切口胰腺壞死組織清除術(minimal access retroperitoneal pancreatic necrosec-tomy,MARPN)[5-6]。近年來,越來越多的臨床研究證實,經自然腔道(胃或十二指腸)內鏡下壞死組織清除技術較腹膜后入路的微創技術更有優勢,如不需要全麻、操作相關并發癥少等[7-8]。但當臨床醫師面對遠離自然腔道的感染病灶或不能開展經自然腔道引流技術時,腹膜后入路的微創技術仍是治療的必要選擇。通過優化經皮腹膜后微創引流技術降低操作相關并發癥是IPN研究的重要方向。使用經皮支架治療胰腺包裹性壞死感染是微創引流技術改進的措施之一。目前已被多次報道[9-11],通過支架建立牢固的可重復利用的操作竇道取得良好的臨床效果,但研究證據等級較低,能否使用這一技術改善IPN的微創引流效果值得深入探討。為此,本研究設計采用經皮支架輔助內鏡下壞死組織清除術(stent-assisted percutaneous endoscopic necrosectomy,SAPEN)治療IPN的前瞻性觀察性研究,探討該技術在IPN微創引流中的應用價值。
資料與方法
一、一般資料
序貫性收集2018年1月至2018年9月間解放軍東部戰區總醫院胰腺炎治療中心收治的重癥急性胰腺炎(SAP)患者。入選標準:(1)明確診斷為胰腺壞死組織感染[12];(2)接受經皮覆膜支架輔助清創引流治療。排除標準:(1)近期接受腹部手術治療者;(2)瀕死者;(3)年齡<18歲或>70歲;(4)妊娠;(5)醫學認為有救治價值但因經濟原因放棄治療者;(6)合并其他嚴重基礎疾病者。
二、研究方法
采用前瞻性觀察性研究的方法,序貫性收集病例資料,臨床操作者對本研究狀態不可知。本研究得到急性胰腺炎數據庫專家委員會批準同意,所有數據分析方法符合委員會數據使用規定。所有患者或親屬均簽署同意臨床數據收集與出版使用同意書。
三、操作方法
1.經皮支架的放置與持續引流:對于所有診斷為IPN的患者,優先考慮經皮置管引流(percutaneous catheter drainage,PCD)[13-14]。根據胰腺壞死感染病灶的位置選擇PCD的路徑,可以選擇腹膜后通路或經腹腔引流路徑。根據病灶大小及壞死物性狀決定是否需要放置支架。支架放置方法:通過PCD引流管置入導絲,經CT掃描確認導絲到達目標位置后,使用腎鏡擴張器逐步擴張竇道至28 F,以保證全覆膜自膨式金屬支架(fully covered self-expanding metal stent,FCSEMS)可以順利展開。支架規格為18 mm×80 mm、18 mm×103 mm或18 mm×123 mm(佳森,常州),遠端(體內端)呈球形,避免支架邊緣對局部組織造成損傷;近端(體外端)呈杯口狀,便于支架固定及內鏡器械清創操作時進出。支架放置后,經支架置入雙套管,雙套管頭端超過支架球口端3 cm左右并給予持續負壓沖洗引流24 h,此時可接受經皮內鏡清創操作。在支架保護下可短期內反復多次內鏡清創操作。當腹部CT確認局部感染病灶清除徹底或竇道成熟后可去除支架,并于原竇道放置雙套管或硅膠引流管,直至無膿性液體引流出后拔除引流管。
2.SAPEN:進行SAPEN治療時需要給予患者適當的鎮靜、鎮痛劑。本組患者采用的標準鎮靜劑為右美托咪定注射劑(江蘇新晨醫藥有限公司,連云港);標準鎮痛劑為瑞芬太尼注射劑(人福醫藥集團股份公司,宜昌),操作時根據患者疼痛評分增減藥物劑量。該操作可在床旁或在手術室實施。通過放置后擴張良好的支架,使用軟鏡(9.8 mm,Olympus Medical Systems,日本)或腎鏡(10 mm,Karl Storz,德國)進入膿腔,采用息肉勒除器或腎鏡操作鉗清除壞死組織。對于壞死組織較多的病例可建立多個支架通道,使用多個或多種不同內鏡(軟鏡或腎鏡等)、多種不同清除工具協同操作,提高清創效率。多通道、多操作鏡聯合清創需要多位操作者協同實施。此外,在技術條件成熟及設備器材完善的情況下,SAPEN操作不妨礙患者接受其他的引流方式,包括PCD、經胃置管引流、經胃內鏡操作等。
四、數據收集與處理
前瞻性收集臨床數據,包括患者基本信息(年齡、性別、病因診斷),入院時病情嚴重程度(器官功能狀態、APACHEⅡ評分、SOFA評分),治療中是否出現新發主要器官功能障礙、需要干預的腹腔出血、需要干預的消化道瘺等;記錄支架操作相關指標,包括支架留置時間、SAPEN或其他內鏡操作次數、是否需要外科手術干預、SAPEN操作相關不良事件等。其中主要并發癥指新發主要器官功能障礙,包括呼吸、循環、腎臟功能障礙及多器官功能衰竭綜合征(MODS);主要觀察指標為病死率及主要器官功能障礙發生率;次要觀察指標為支架操作相關指標。所有病例觀察終點為出院或死亡。
五、統計學處理
采用SPSS 23.0統計學軟件進行數據分析。連續性數據以M(P25,P75)表示,分類變量以例數和百分數表示。
結 果
一、一般資料
本中心接受SAPEN治療胰腺壞死組織感染的SAP病例共46例,3例因經濟原因、1例因腦死亡放棄治療,2例因年齡>70歲排除研究,最終入組40例。患者人口學資料及入院時病情相關資料見表1。本中心為全國專病轉診中心,入組病例絕大部分為外院轉入,因此患者入院與發病的時間間隔變異較大。
二、SAPEN操作相關情況
所有患者均按本中心階梯引流治療策略治療,即在PCD后實施至少1次SAPEN。本組治療過程中支架放置成功率為100%,無支架放置相關并發癥出現。SAPEN操作相關情況見表2。
三、治療效果
40例SAPEN操作臨床結局見表3。32例患者(80.0%)僅通過接受SAPEN治療即獲得臨床治愈,4例患者出現大出血需要床邊填塞治療及血管造影檢查,其中2例患者接受急診止血手術。5例因結腸瘺接受了造口手術治療,3例十二指腸瘺和5例胰瘺患者均通過微創技術引流或內科治療獲得治愈。12例出現新發重要器官功能障礙,其中6例死亡,原因為進展的膿毒癥、伴隨的多臟器功能衰竭、腹腔大出血及出血相關性休克等。
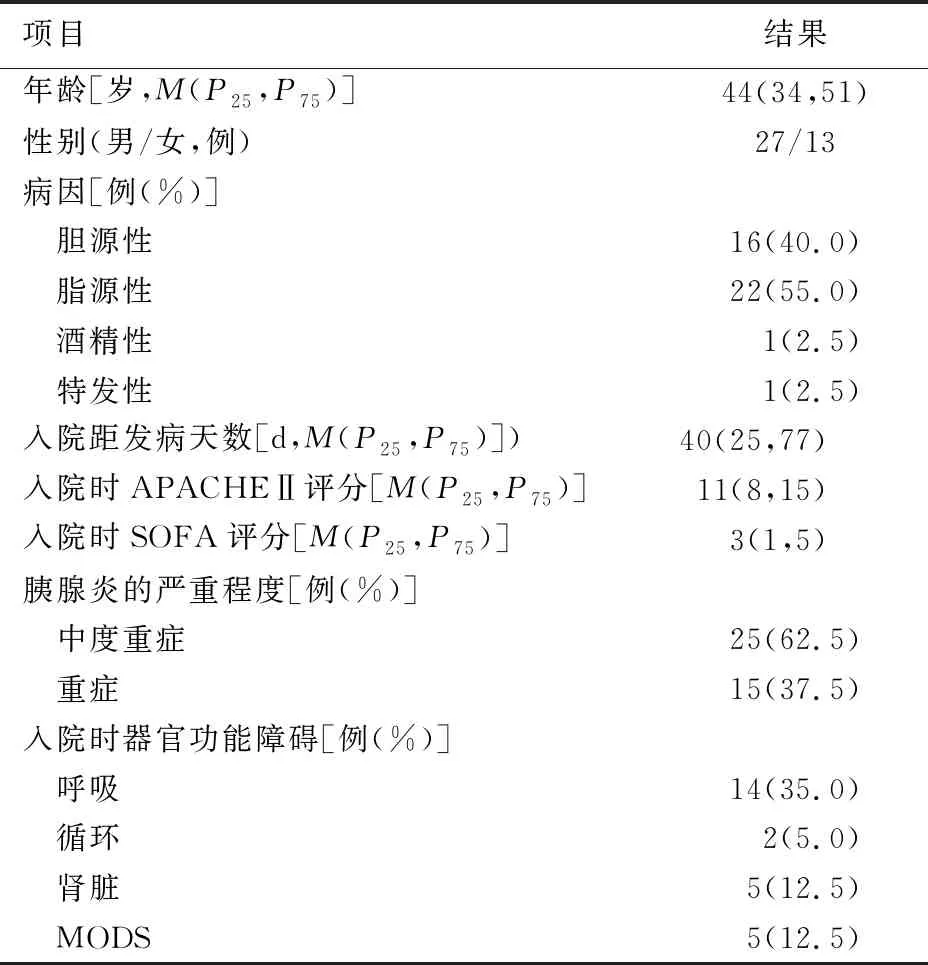
表1 40例IPN患者入院臨床資料

表2 40例IPN患者SAPEN操作相關情況
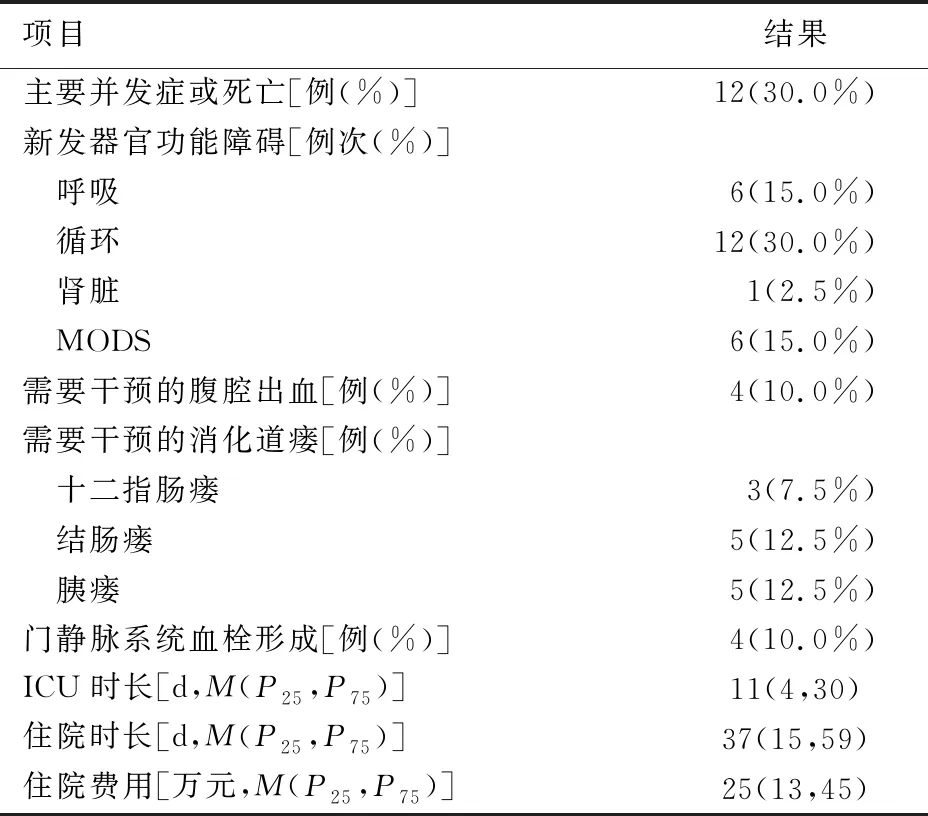
表3 40例IPN患者SAPEN操作臨床結局
討 論
由于存在支架對竇道的保護及放置支架后形成的穩定的操作通道,理論上SAPEN具有良好的操作安全性。本研究采用SAPEN作為40例IPN患者清創的主要引流手段,結果顯示放置支架成功率達100%,未出現操作相關不良事件。32例(80.0%)患者通過接受SAPEN治療獲得治愈,12例(30.0%)出現新發器官功能障礙或死亡,與文獻報道[1,15]具有可比性,與本中心前期研究結果一致[13-14],表明SAPEN不增加IPN的病死率及不良事件發生的風險。
IPN的微創引流有多種清創技術可供選擇[16-18]。與SAPEN相似的經皮途徑清創技術主要有MARPN及VARD技術[5,7]。這兩項技術的共同點在于均采用直接的后腹膜通路,均采用硬質鏡操作,其路徑選擇受到操作器械特性的限制,需要滿足操作空間大、局部解剖結構簡單、方便操作鏡遠端大范圍活動等特點,所以常規入路一般位于左腎上極、脾下極以及結腸脾曲等解剖部位。與MARPN和VARD不同,SAPEN在通路選擇上更加多樣化,可以有效減少操作盲區,如可以建立經腹膜通路等;通道建立不依賴前期的經皮置管,借助全覆膜自膨式金屬支架可以迅速便捷地建立穩定通道;操作器械的選擇更加豐富,可以選擇軟鏡和(或)硬鏡聯合操作。在操作相關的損傷方面,SAPEN操作孔道一般為1.2 cm左右,不需要額外的小切口,真正做到微創手術,從而減少切口感染、切口疝等并發癥的發生。此外,因為有覆膜支架的保護,有雙套管的持續負壓沖洗引流,SAPEN在減少竇道的損傷、減少局部感染擴散方面也有顯著優勢。在操作條件上,SAPEN也更加寬松,如不需要全麻[9]而僅給予基礎鎮痛鎮靜;操作地點可以在床邊或病房操作間;人員配置上一般2~3人就可順利完成操作,不需要額外的專科醫師。操作條件限制的減少可降低操作費用、提高操作便利性,對于IPN患者清創操作可反復多次實施,其經濟及便利的優勢就更加突出。
有數篇關于經皮支架胰腺壞死清除的研究報道。Cerecedo-Rodriguez等[10]報道了1例采用自膨式食管金屬支架治療的病例。另一項研究報道了9例接受食管金屬支架治療的病例,這些患者病灶均為位于結腸旁溝區域的包裹性壞死[9]。最近,Thorsen等[11]報道了5例患者接受全覆膜自膨式金屬支架(fully covered self-expanding metal stent,FCSEMS)治療,其治療成功率達80%。這些文獻報道均無操作相關的出血及穿孔并發癥,FCSEMS相關的潛在的鄰近組織損傷并發癥也未見報道。
有證據表明經胃清創引流比腹膜后微創引流具有更多的優勢[8,19-20],但經胃途徑引流存在一定的限制,如需要胰腺壞死包裹良好、病灶貼近胃壁等,而實際工作中往往存在胰腺壞死感染不能有效包裹、膿腔部位分布廣泛而遠離胃腔(如膈下、雙側結腸旁溝、盆腔等部位)等情況,從而不利于經胃途徑引流的開展。SAPEN避免了傳統經皮內鏡引流的一系列不足,同時也突破了經胃引流對胰腺壞死形態(一般需完整包裹)、壞死包裹位置(一般需貼近胃壁)等的限制,大大提高了技術適用性。
支架輔助的經胃途徑引流也被證明比傳統清創手段更加有效,但支架相關的并發癥及延遲經口經胃飲食的風險仍然不可回避[21-22]。雖然已經有新型支架開發和應用,但經胃途徑引流仍存在支架移位的風險,并可能造成嚴重的不良事件發生[23]。與此相反,SAPEN技術采用經皮放置支架,支架近端位于體外,并采用縫線固定,所以不存在支架移位的風險。同時,該技術不破壞胃腸道解剖的完整性,不影響早期經口、經胃飲食。所以盡管筆者所在中心也實施經胃引流技術、腹膜后途徑引流技術,但SAPEN已成為本中心治療IPN的主要引流手段。
本研究通過前瞻性數據顯示了SAPEN治療IPN的安全性與有效性,相對MARPN、VARD,SAPEN具有減少創傷的優勢,在技術的適用性方面優于經胃途徑的引流技術。另外,SAPEN存在多種技術形式,如多個支架建立的操作通道、不同類型內鏡聯合清創、多種操作工具協同應用等,多種操作形式的組合可以擴展操作時的手術視野、提高壞死清除的效率。SAPEN作為階梯引流技術體系的重要補充,當其他的微創技術失敗時為階梯引流提供了更多選擇。本研究樣本量較小,SAPEN的治療臨床效果和優勢仍需要后續大樣本隨機對照研究進一步證實。
利益沖突所有作者均聲明不存在利益沖突

