阿托伐他汀對慢性腎病大鼠血清及腎組織microRNA-92a 表達的影響*
趙婷婷,郭娟英,尚粉青,王 慧,程曼麗,郭 瑄
在慢性腎病發展過程中硫酸吲哚酚、 吲哚乙酸、 馬尿酸等尿毒癥毒素均可以誘發microRNA-92a(miR-92a)升高,miR-92a 影響內皮細胞重要調節因子Krüppel 樣轉錄因子2 (Krüppel-like factor 2,KLF2)、Krüppel 樣 轉 錄 因 子 4 (Krüppel-like factor 4,KLF4)、 沉 默 信 息 調 節 因 子-1(silent information regulator of transcription-1,SIRT1)等的表達,從而誘發內皮細胞炎癥反應,損傷內皮細胞功能[1]。 有報道阿托伐他汀可以降低miR-92a 的表達[2],該研究目的在于觀察阿托伐他汀是否可以降低慢性腎病的炎癥反應及其是否通過降低miR-92a 發揮治療作用。
1 材料與方法
1.1 藥物、試劑及儀器阿托伐他汀購自輝瑞制藥有限公司。 主要試劑:PCR 引物 (miR-92a、KLF2等):生工(上海)有限公司合成。 β-actin 抗體購自Santa Cruz 公司;KLF2 抗體購自美國Cell Signaling公司。Trizol 試劑(Invitrogen 公司),HiScriptTMqPCR SuperMix 逆轉錄試劑盒 (Vazyme 公司),PCR DNA聚合酶(Vazyme 公司),其余試劑為國產分析純。 主要儀器: 實時定量PCR 儀及梯度PCR 儀 (美國Applied Biosystems 公司),WB 電泳儀和電泳槽、WB 半干轉膜槽(BIO-RAD 公司),自動洗片機(柯達公司)。
1.2 5/6 腎切除慢性腎衰模型的建立選用24 只8~10 周SPF 級雄性SD 大鼠作為研究對象, 購自西安交通大學實驗動物中心。 所有大鼠均在室溫24 ℃,12 h 光照,12 h 黑暗,充足水供和飼料。二步法建立5/6 腎切除模型, 以10%的水合氯醛(350 mg/kg)腹腔注射麻醉后,仰臥固定在手術臺上,局部剪毛,右側腹直肌外緣常規消毒,無菌操作下垂直切口開腹,長約3 cm,暴露右腎,分離固定,按上極、下極弧形切右腎組織,主要切皮質,用噴有凝血酶的凝膠海綿壓迫止血,待血止后縫合包扎,切除的右腎組織約占一側腎臟皮質的2/3。 術后2 周再次手術,同樣方案麻醉,切開左側腹部皮膚,暴露左腎,結扎腎蒂,切除左腎。 假手術組制備方法:同樣方法麻醉及開腹,不切除腎臟,分離腎周膜,保留腎上腺即關腹。
1.3 動物分組及處理24 只10 周左右SD 大鼠,適應環境1 周,隨機分成三組:對照組(假手術組,8只),腎病組(5/6 腎切除組,8 只);阿托伐他汀干預組(5/6 腎切除+阿托伐他汀,8 只)。阿托伐他汀給予6 mg/kg·d 水懸液灌胃, 對照組和模型組每天給予等量的生理鹽水灌胃。 大鼠自由進食、飲水。 術后8周處死動物,留取標本。
1.4 標本的采集處死大鼠前1 d, 將大鼠置金屬代謝籠,留取24 h 尿液。 測定24 h 尿蛋白定量。 處死大鼠當天用10%水合氯醛麻醉大鼠,取腹腔正中切口,經腹主動脈采血,提取血清,測定血生化。 取腎臟組織(對照組取右腎中極腎組織,腎病組取剩余的腎組織) 分成1 cm3大小置一80 ℃冰箱保存,用于分子生物學研究。
1.5 血清各項指標的測定用血自動生化儀測定血尿素氮、肌酐、膽固醇、三酰甘油、低密度脂蛋白、高密度脂蛋白。 采用RT-PCR 方法測定血清中miR-92a 的含量,具體方法見文獻[3]。使用ELISA 試劑盒測定血清中hs-CRP 及IL-1β 水平變化。
1.6 腎臟組織各項指標的測定(1) 取腎臟組織50 mg,剪碎,加入Trizol 1 ml超聲勻漿,提取腎臟組織RNA,RT-PCR 方法測定腎臟組織中各因子的表達變化。 PCR 引物序列見表1。 (2)取腎臟組織80 mg/只,剪碎組織,加入蛋白裂解液約300 ml,勻漿機勻漿,3 次,30 s/次; 液氮凍融3 次,4 ℃,12000 r/min, 離心15 min, 取上清,ABC 法測定蛋白濃度。Western Blot 方法測定腎臟組織中蛋白表達的變化。

表1 實時定量PCR 引物列表
1.7 統計學分析計量資料用均數±標準差表示,兩組比較采用t 檢驗;計數資料用百分比(%)表示,比較采用λ2檢驗,相關分析采用Spearman。 正態性檢驗采用Shapiro-Wilk 檢驗, 方差齊性檢驗采用Levene 檢驗。 P<0.05 為差異有統計學意義。
2 結 果
2.1 血清中miR-92a 含量變化如圖1 所示,與正常對照組相比,腎病組大鼠血清miR-92a 水平顯著升高 (腎病組值5.181 vs. 對照組值1.134,P<0.01)。 阿托伐他汀治療組血清miR-92a 水平較腎病組明顯降低 (他汀治療組值2.250 vs. 腎病組值5.181,P<0.05)。
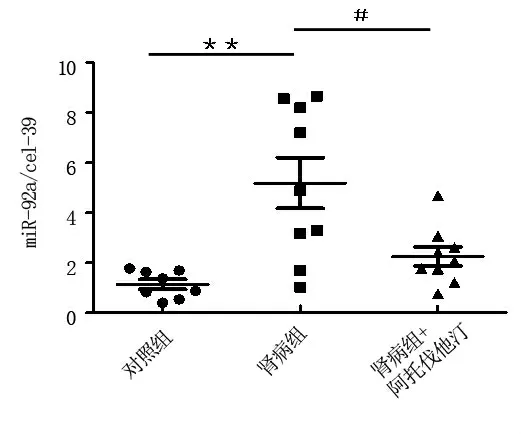
圖1 三組大鼠血清中miR-92a 含量變化
2.2 血清中一般生化指標及CRP 及IL-1β 等炎癥指標變化與正常對照組相比,腎病組尿素氮和肌酐明顯升高,血漿總膽固醇(TC)(P<0.01)及低密度脂蛋白(LDL-C)亦顯著升高(P<0.05)。 阿托伐他汀治療組與腎病組比較,TC 和LDL-C 降低 (P<0.01),尿素氮和肌酐明顯降低,兩組比較差別有統計學意義 (P 值分別<0.05 和<0.01)。 但三酰甘油(TG)和高密度脂蛋白(HDL-C)水平在治療前后無明顯變化(P>0.05)。炎癥指標CRP 及IL-1β 在腎病組明顯升高(P<0.01),阿托伐他汀治療后明顯降低(P<0.05)。 見表2。

表2 三組血清生化指標的比較
Spearman 相關分析顯示,血清中miR-92a 的水平與血清中炎癥指標CRP 及IL-1β 具有明確的相關性,呈顯著正相關。 見圖2。
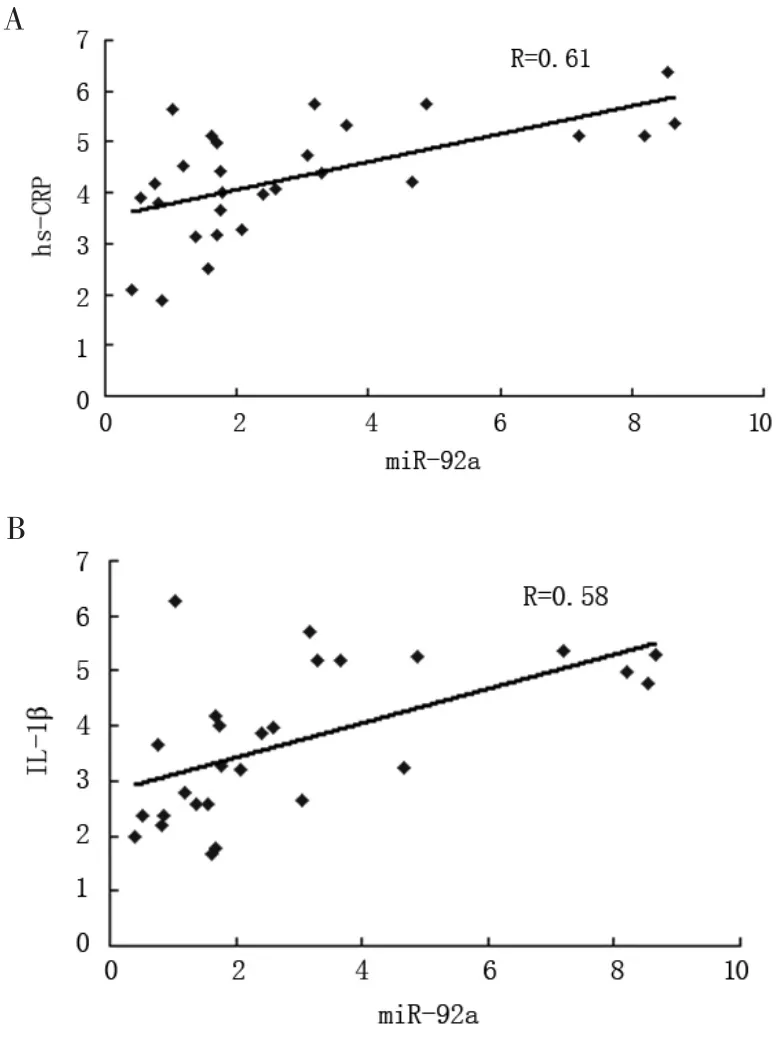
圖2 血清中miR-92a 與CRP 及IL-1β 相關性分析
2.3 腎臟組織中miR-92a 及其下游靶基因KLF2表達變化RT-PCR 結果提示腎病組腎臟組織中miR-92a 表達較對照組明顯增加(P<0.01),而阿托伐他汀治療組較腎病組表達明顯減少 (P<0.05)。RT-PCR 及Western Blot 結果提示腎病組腎臟組織中KLF2 表達較對照組明顯減少(P<0.01),而阿托伐他汀治療組較腎病組表達明顯增加(P<0.05)。 見圖3。

圖3 腎臟組織中miR-92a 與KLF2 表達變化
3 討 論
慢性腎病(CKD)嚴重危害著全世界人民的健康與生命。 國內外有關資料表明,慢性腎病的發病率、患病率以及患者知曉率迅速上升[4]。這已成為當今腎病專業以及醫學界面臨的嚴峻公共衛生與醫療問題。 因此尋找有效的治療方法刻不容緩。
microRNA 在慢性腎病中的研究日益深入,已發現有多種microRNA 參與腎病的發生及發展[5-9]。miR-29、miR-302、miR-192 和miR-21 在慢性腎病發病過程中均發揮重要作用。 miR-92a 是內皮細胞特異性高表達的microRNA, 屬于miR17-92 基因簇,是第一個被發現的癌基因,其表達上調被證實與多種腫瘤的發生和進展有關。 我們前期研究證實慢性腎病患者血清miR-92a 顯著升高,損傷血管內皮細胞,促進心腦血管并發癥發生。而對于miR-92a在腎功能損傷的進展過程中的作用尚不清楚。 該研究證實在5/6 腎切除模型大鼠的血清及腎臟組織中miR-92a 的表達均明顯增加。
慢性腎病進展過程中,在各種致病因素的作用下,炎癥細胞和腎固有細胞(如系膜細胞、內皮細胞和上皮細胞)合成和分泌多種炎癥介質參與炎癥反應,在腎病發生、發展中起了關鍵作用。 因此抑制炎癥反應對延緩腎病的進展有重要的意義。 miR-92a通過作用于其靶基因KLF2[10]來調節炎癥反應。KLF2 受血流切應力誘導,參與調節炎癥、凝血、血管舒縮和血管生成等多種過程。KLF-2 通過抑制炎癥關鍵通路核因子-kappa B (nuclear factor-κB,NF-κB) 和轉錄因子活化蛋白-1 (activator protein 1,AP-1)的轉錄活動,進而抑制單核細胞炎癥因子的表達[11]。KLF2 還能抑制蛋白激酶活化受體-1,抑制凝血酶誘導的MCP-1、IL-6 和IL-8 的表達[12]。此外KLF2 還能抑制IL-1β 和TNF-α 等促炎因子誘導內皮細胞活化和內皮細胞黏附分子如E-選擇素、血管細胞黏附分子-1、細胞間黏附分子-1 的表達,從而抑制炎癥細胞黏附[13]。
阿托伐他汀首先是通過糾正脂代謝紊亂來減輕高脂血癥對腎臟的損害。 阿托伐他汀的腎保護作用機制亦可通過非依賴降脂作用機制參與:抑制細胞增殖、促進細胞凋亡、減少細胞外基質、抗炎作用及調節免疫功能等。 阿托伐他汀可以通過抑制炎癥因子的表達、炎癥細胞的活化等起抗炎作用來延緩CKD 的進展。有研究證實他汀類藥物治療可顯著降低冠心病患者血清miR-92a 水平[2]。 該研究提示,阿托伐他汀可能通過抑制miR-92a 的表達, 促進KLF2 表達增加,從而有效抑制炎癥反應,延緩慢性腎病的進展。
通過該研究筆者證實了miR-92a 在CKD 進展過程中的重要作用及阿托伐他汀通過抑制miR-92a 的表達,減輕炎癥反應,延緩腎病發展。而miR-92a 在腎病進展中是否有其他作用機制有待于進一步研究。動物實驗證明miR-92a 抑制劑可延緩動脈硬化的發展。 而miR-92a 抑制劑是否可作為CKD的治療方法仍有待進一步評估及驗證。

