運動強度對不同性別代謝綜合征患者骨骼肌mRNA表達譜的影響
劉軍
(常州工程職業技術學院體育學院,江蘇 常州 213164)
肥胖、血脂異常及久坐生活方式是導致心血管疾病、糖尿病等多種疾病的高危因素,是亞健康人群的重要特征[1]。運動訓練可通過增加去脂體質量、減少體脂量、改善體脂分布促進人體恢復健康,其效果與運動訓練的類型(有氧/阻力運動)以及運動強度有關[2]。既往研究[2]表明有氧運動可減輕體質量和體脂含量,調節骨骼肌內的重要代謝通路(線粒體代謝等),運動量是影響血脂水平、胰島素敏感性的重要因素。
基于高通量數據所進行的基因組學研究,已成為揭示疾病機制和基因生物功能的重要手段,基因富集分析(gene set enrichment analysis,GSEA)是解釋基因表達譜數據的核心分析工具之一[3]。GSEA可對樣本所表達的基因進行分類,把具有相同生物學功能和調節機制、處于同一信號通路的基因富集出來,通過富集的這些優勢通路闡明其生物學特征及相關機制,進而提示疾病防控靶點或指導疾病進展監控與預后預測。已有研究[4]顯示運動訓練可增加胰島素敏感性,通過對骨骼肌結構和功能的調節影響心血管代謝疾病的發生與發展,而心血管代謝的改善與有氧運動強度有關。
本研究利用基因數據集GSE48278,以具有慢性心血管代謝疾病危險因素的亞健康狀態人群為研究對照,探討不運動以及不同強度有氧運動6個月對男性和女性骨骼肌mRNA表達譜的改變,并利用生物信息學方法分析此種改變潛在的生物功能與分子機制。
1 材料與方法
1.1 原始數據集與分級訓練方案
從NCBI的GEO數據庫(http://www.ncbi.nlm.nih.gov/geo)下載代謝綜合征患者骨骼肌基因表達數據集GSE48278。共納入112例,隨機選取1998年至2003和2004年至2009年進行的第1次和第2次通過特定方式體育鍛煉進行有針對性的降低風險干預措施的研究(studies of a targeted risk reduction intervention through sefined exercise,STRRIDE)試驗。納入標準:(1)年齡18~70歲;(2)不活動;(3)超重至輕度肥胖(體質量指數25~35 kg/m2)和血脂異常[低密度脂蛋白膽固醇:3.34~4.92 mmol/L或高密度脂蛋白膽固醇< 1.04 mmol/L(男性)或1.17 mmol/L(女性)]。排除標準:(1)已確診糖尿病或空腹血糖> 6.99 mmol/L;(2)高血壓(血壓> 160/90 mmHg);(3)已知患有心血管疾病,禁止運動訓練的肌肉骨骼疾病;(4)吸煙;(5)服用影響糖/脂類代謝的藥物;(6)應用減肥食譜。參與者隨機分配到不運動或小量中、高有氧運動組,運動強度分別為小量中強度運動(5 021 kJ/周,40%~55%峰值)、小量高強度運動(5 021 kJ/周,65%~80%峰值)、大量高強度運動(8 368 kJ/周,65%~80%峰值)、聯合阻力訓練、單獨阻力訓練。在當地健身中心進行觀察。入組時使用最大運動量測試確定參與者的峰值、最大心率和對應于規定強度的心率范圍。參與者按指定的運動訓練處方進行6個月運動。通過心率監測器的記錄和肉眼監督來驗證運動訓練的依從性。具體方法見文獻[4]。
1.2 研究分組
基于研究目的,本研究選取不運動和有氧運動的參與者。剔除阻力訓練者。另外,大量高強度運動量超過中國人常規耐受范圍,參考價值有限,因此也被剔除。最終納入者按性別劃分,每個性別納入者分為3組:不運動組(5例)、小量中強度組(5例)、小量高強度組(5例),共30例。
1.3 基因數據分析
每例在入組時和系統運動6個月后,從骨骼肌活組織檢查提取總RNA進行基因表達微陣列分析(Affymetrix U133 Plus 2.0)。本研究應用該數據集的series matrix數據。以探針為基本單位進行后續分析。
應用Gene Set Enrichment analysis 3.0版軟件,以入組時與不運動、小量中強度運動、小量高強度運動6月后比較,以MSigDB在線基因集數據庫的hallmark gene sets作為參考基因集,對基因表達譜進行GSEA。設置隨機組合次數為1 000次。以P< 0.05,且FDRq< 0.25為差異具有統計學意義。對有統計學意義的基因集進行leading edge gene分析。使用GPL570的注釋文件對leading edge gene分析所選定的探針進行注釋,利用genecards網站(http://www.genecards.org)匯總各個相關基因的功能等信息。
2 結果
2.1 男性患者鍛煉前后的GSEA比較
結果顯示,與入組時比較,6個月后不運動組的標本富集了“凋亡”,“炎癥反應”,“上皮間質轉化”,“KRAS信號”等通路,如IL6_JAK_STAT3_SIGNALING、ALLOGRAFT_REJECTION、EPITHELIAL_MESENCHYMAL_TRANSITION、COMPLEMENT、APOPTOSIS、INFLAMMATORY_RESPONSE、KRAS_SIGNALING_UP、APICAL_SURFACE、XENOBIOTIC_METABOLISM、COAGULATION和IL2_STAT5_SIGNALING等;小量中強度組未富集任何通路;而小量高強度組富集的通路為PANCREAS_BETA_CELLS。見表1、圖1。
2.2 女性鍛煉前后的GSEA比較
與入組時比較,6個月后不運動組的標本未富集任何通路;小量中強度組富集了氧化磷酸化(OXIDATIVE_PHOSPHORYLATION)、過氧化物酶體(PEROXISOME)等通路;小量高強度組則富集了氧化磷酸化(OXIDATIVE_PHOSPHORYLATION)、脂肪發生(ADIPOGENESIS)、脂肪酸代謝(FATTY_ACID_METABOLISM)、HEDGEHOG信號等通路,見表1、圖2。

表1 亞健康狀態高危人群小量有氧運動或不運動6個月骨骼肌中基因表達譜的基因集富集分析Tab.1 Gene set enrichment analysis for the gene expression profile in the skeletal muscles of cardiometabolic high-risk population with/without 6 months of low-amount aerobic exercise

圖1 與入組時比較,男性不運動組6個月后骨骼肌基因譜的GSEA結果Fig.1 GSEA results of skeletal muscle gene profiles in males without exercise after 6 months compared with the gene profiles at enrollment
2.3 男性、女性鍛煉前后領頭亞群基因分析

圖2 與入組時比較,女性小量高強度運動組6個月后骨骼肌基因譜的GSEA結果Fig.2 GSEA results of the skeletal muscle gene profiles in females with 6 months low-amount vigorous-intensity exercise compared with the gene profiles at enrollment
與入組時比較,男性不運動組6個月后的骨骼肌細胞中在所富集通路出現頻次最多的領頭亞群基 因 包 括TIMP2、IL2RB、LYN、SERPINE1等,見 圖3A。與入組時比較,女性小量高強度組6個月后骨骼肌細胞中高頻度出現于富集通路中的領頭亞群基因 包 括ECHS1、DLD、SDHC、ECH1、ACAA2、MDH2、ACADM、DECR1、RETSAT等,見圖3B。
3 討論
本研究結果顯示,男性與入組時比較,不運動組骨骼肌細胞富集了凋亡、炎癥反應和異常增生與轉化相關通路,在各強度運動組未發現此種改變;女性不運動組骨骼肌細胞無特殊變化,小量中高強度運動訓練則增強骨骼肌有氧代謝、維持肌纖維結構以及促進肌細胞損傷修復等生物過程。
骨骼肌作為代謝、心血管相關疾病的重要靶器官,其結構與功能的穩態是維持人體健康的重要基石[4]。而人體由亞健康狀態發展為代謝、心血管疾病的過程中,骨骼肌的代謝適應性下降,出現胰島素敏感性下降/抵抗,從而導致多重代謝改變,其本質主要存在以下兩方面變化:(1)線粒體氧化能力/三羥酸循環破壞;(2)免疫功能破壞、炎癥/免疫反應增強、細胞死亡/凋亡增多。已有研究[5-6]顯示代謝異常的小鼠模型或具有代謝綜合征/2型糖尿病的患者中,可觀察到骨骼肌發生胰島素抵抗以及損傷相關性改變(線粒體功能失調、線粒體超氧產物以及凋亡、免疫相關信號通路激活)。
本研究結果顯示,亞健康狀態的男性,6個月不運動骨骼肌細胞出現了炎性細胞因子介導的免疫活性、排斥反應、補體系統、炎癥反應增強,并存在凋亡、上皮間質轉化、高凝和異常增生信號通路活化,即向更易于發生心血管、代謝疾病的方向發展。而運動情況下未出現這些不利的因素,在小量高強度運動組出現了胰島β-細胞增強,即可能通過促進胰島素分泌逆轉亞健康狀態。亞健康狀態女性6個月不運動未見骨骼肌發生不利變化,而小量運動6個月無論中強度還是高強度均可促進骨骼肌細胞中的氧化磷酸化代謝、增強過氧化物及脂肪酸的代謝,從而促進亞健康狀態逆轉。另外,已有研究[7]顯示小量高強度運動中活化的HEDGEHOG信號通路可能有利于促進高強度運動后骨骼肌發育、損傷修復,并負責調節快慢肌纖維特性。
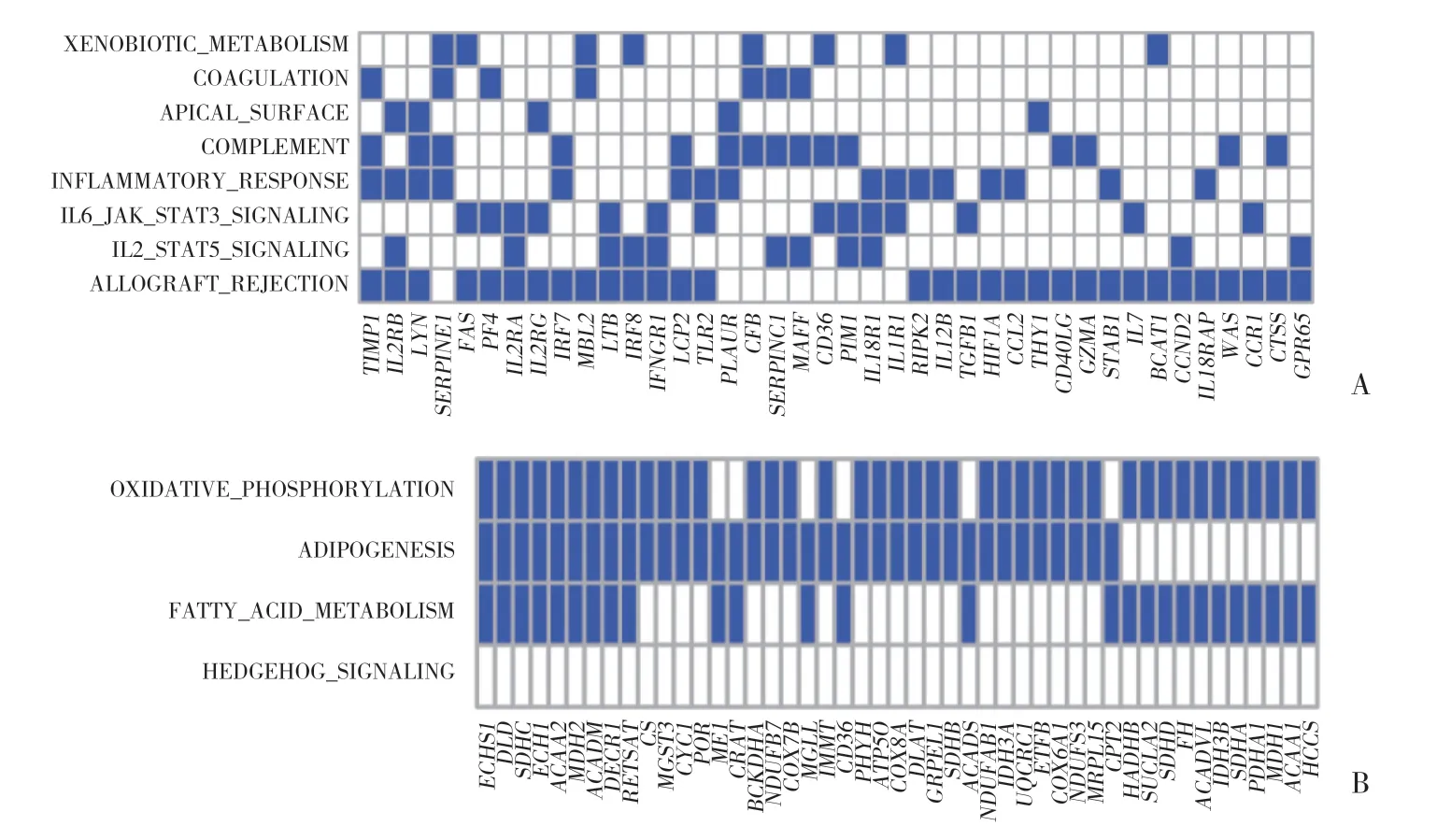
圖3 與入組時比較,參與者6個月后骨骼肌中領頭亞群基因分析結果Fig.3 Leading edge genes of the skeletal muscles in participants after 6 months compared with those at enrollment
根據領頭亞群基因分析結果,男性不運動組中上調的TIMP2基因參與了上皮間質轉化、免疫反應、炎癥反應、氧化應激反應等多種機體變化,并與高血壓、代謝綜合征等疾病的發生發展密切相關[8];IL2RB基因主要參與機體內免疫反應,與2型糖尿病、高血壓及心腦血管事件等相關[9];LYN基因為酪氨酸蛋白激酶,與多種惡性腫瘤的發生發展相關[10];SERPINE1基因上調使患者易于形成血栓,可見于肥胖、高脂血癥、2型糖尿病等代謝相關疾病以及乳腺癌等惡性腫瘤和多種感染性疾病[11-12]。目前,這些基因改變認為是不運動導致亞健康狀態男性骨骼肌發生不利變化、并促進其發生心血管、代謝疾病的核心因素。另一方面,在女性小量高強度運動組篩出的基因中,ECHS1基因屬于水合酶超家族,負責線粒體脂肪酸代謝,其表達可抑制腫瘤細胞和病毒復制[13-14];DLD基因作為氧化還原酶或蛋白水解酶調節機體的能量代謝[15];SDHC基因作為參與線粒體能量代謝(三羧酸循環和有氧呼吸鏈)的關鍵酶,其表達缺失與多種惡性腫瘤發生相關[16];ECH1基因屬于水解酶超家族,其功能與營養狀況相關[17];ACAA2基因參與線粒體脂肪酸代謝,避免細胞發生凋亡[18];MDH2基因為線粒體內參與三羧酸循環的脫氫酶,其表達減低或缺失與惡性腫瘤密切相關[19];ACADM基因參與線粒體脂肪酸代謝,其異常與多種代謝性疾病相關[20];DECR1基因主要在線粒體內參與氧化反應和脂肪酸代謝[21];而RETSA基因則參與脂肪形成,在肥胖患者體內其表達下降[22]。本研究結果顯示這些基因可能是運動使女性受益、逆轉其亞健康狀態的關鍵基因。
綜上所述,本研究針對處于亞健康狀態的心血管代謝疾病高危人群,基于在線數據GSE48278,通過生物信息學分析其骨骼肌細胞基因組學改變,明確了不運動對于男性骨骼肌結構與功能的不利影響;并發現小量運動訓練可增強女性骨骼肌有氧代謝并維持骨骼肌的組成與功能。本研究從基因組學角度,解釋了適量運動對亞健康人群的重要性,對明確如何逆轉亞健康狀態,降低心血管代謝疾病風險提供了重要依據,具有一定的科學價值。

