人工肝聯合CRRT治療復雜先心病術后肝衰竭的臨床研究
劉小燕,陳 欣,周德江
復雜先心病是嚴重危及患兒生命的一組先天性心臟疾病,具有病情復雜、治療困難、病死率高等特點,目前主要的治療方式是采用體外循環(CPB)輔助下外科手術治療。CPB的體外轉流過程致使患兒被迫處于控制性休克狀態[1],而肝臟細胞對缺血缺氧的耐受較差,所以,CPB極易引起肝細胞代謝功能受損。10%~20%CPB輔助下心內直視術后的患兒,術后第2~3 d膽紅素和轉氨酶顯著增高,表明患兒存在不同程度的肝功能損害[2];而4%的患兒CPB術后會出現肝衰竭[3]。肝衰竭是肝臟功能失代償的終末狀態,其病死率甚至可達75%~80%[3]。目前,臨床多采用人工肝血漿置換的方式對CPB術后肝衰竭患兒進行治療。筆者在臨床工作中發現,人工肝血漿置換聯合CRRT可以更有效地改善患兒肝功能,本研究對此進行了總結分析,以為該技術的臨床應用提供證據。
1 資料與方法
1.1 病例資料 2013年1月~2018年11月醫院心血管外科收治26例復雜先心病術后肝衰竭的患兒,其中2013年1月~2015年11月采用人工肝治療的共12例,作為人工肝組(n=12例),2015年12月~2018年11月在人工肝治療基礎上聯合CRRT治療的共14例,作為聯合組(n=14例),均符合肝衰竭診斷標準[4]。 入選標準:(1)年齡 4~13 歲;(2)CPB下行心內直視手術;(3)術后2~3 d出現肝衰竭。排除標準:(1)入 ICU 時間<48 h;(2)有頸靜脈置管及股靜脈置管禁忌;(3)因各種原因(如患兒家屬拒絕接受人工肝及CRRT治療)未能行人工肝或CRRT治療的患兒。
1.2 治療方法 兩組均采取全身支持以及藥物對癥治療。人工肝組行人工肝血漿置換治療,采用Prisma機型和TPE1000濾器,選擇PE治療模式,溫度設置為36℃,血流量50~70 ml/min,置換速度150~200 ml/h。抗凝藥物選擇低分子肝素,首劑35~40 U/kg,肝素鈉輸注速度維持 25~30 U/(kg·h),監測ACT頻率為30 min/次。聯合組在人工肝血漿置換治療前2 h內行CRRT,采用CVVH治療模式,根據患兒血壓調節血流速度,置換量為15~20 ml/(kg·h),透析量為20~30 ml/(kg·h)。每位患兒至少連續治療3 d,每次治療時間24 h。
1.3 檢測指標 分別記錄治療前1 d和治療后1、3 d,檢測患兒的肝功能和凝血指標,包括白蛋白(ALB)、總膽紅素(TBIL)、谷草轉氨酶(AST)、谷丙轉氨酶(ALT)、凝血酶原時間(PT)等;評估急性和慢性健康狀況評分系統(APAECHE-Ⅱ)和序貫性器官衰竭評估(SOFA)評分。
1.4 統計學方法 應用SPSS22.0統計軟件分析,計數資料用頻數和百分率表示,采用χ2檢驗;計量資料以均數±標準差表示,組間比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組一般資料比較 兩組各項臨床指標比較無統計學差異(P>0.05,表 1)。
2.2 兩組治療前后肝功能和凝血指標比較 在治療后 1、3 d, 兩組 ALT、TBIL、AST 和 PT 均逐漸降低,而ALB逐漸升高,且聯合組的改善幅度均大于人工肝組(P< 0.05,表 2)。
2.2 兩組治療前后APAECHE-Ⅱ和SOFA評分比較 在治療后1、3 d,兩組APAECHE-Ⅱ和SOFA評分均逐漸降低,且聯合組均低于人工肝組(P<0.05,表 3)。
3 討論
肝衰竭是復雜先心病患兒術后出現的嚴重并發癥,其發病機理尚不明確,可能與手術創傷以及術中CPB對心肌的損傷有關。復雜先心病的嬰幼兒的心血管系統未完全發育成熟,手術創傷及心肌缺血再灌注損傷對未成熟的心肌影響較大[5]。血液灌注不能供給組織細胞需要,導致代謝障礙,繼而發生功能障礙,嚴重時甚至會導致壞死,從而引起全身多個器官功能障礙[6]。肝細胞對缺血缺氧更為敏感且耐受差。因此,肝臟更容易受到體外循環的影響而造成器官功能障礙,在肝細胞大量壞死的情況下,極易發展為肝功能衰竭。ALF病情危重且預后差,是復雜先心病患兒圍手術期的主要致死原因之一[7]。因此,治療復雜先心病患兒術后ALF的核心在于減少肝細胞變性壞死以及體內毒素蓄積,促使肝細胞再生。非生物型人工肝是治療ALF最常用的方法[8],在成人ALF治療中得到了肯定[9]。但是人工肝治療在復雜先心病患兒術后ALF這一領域應用較少,目前尚無統一的治療方案。
表1 兩組一般資料比較
人工肝血漿置換治療的原理是,暫時替代部分肝臟的功能,通過血漿分離器將含有毒素的血漿和致病物質濾出,同時用相同量的新鮮血漿進行置換,并適量補充凝血因子和白蛋白,以達到維持患兒內環境穩定的目的,為肝細胞的修復提供更多的時間。因肝細胞大量壞死變性而產生并蓄積的各種毒素,因該療法可得到清除,阻斷了肝臟的進一步受損,最終促進肝臟自我修復而提高患者存活率。國外的研究顯示,CRRT能夠有效調整機體內環境,使全身各個器官維持穩定,還能夠改善患者免疫細胞功能,起到重建體內免疫狀態的作用[10]。而且由于CRRT在穩定血液中溶質濃度及容量變化中具有較強的優勢,中國心臟重癥連續性腎替代治療專家共識建議,術后早期應用CRRT治療[11-12]。
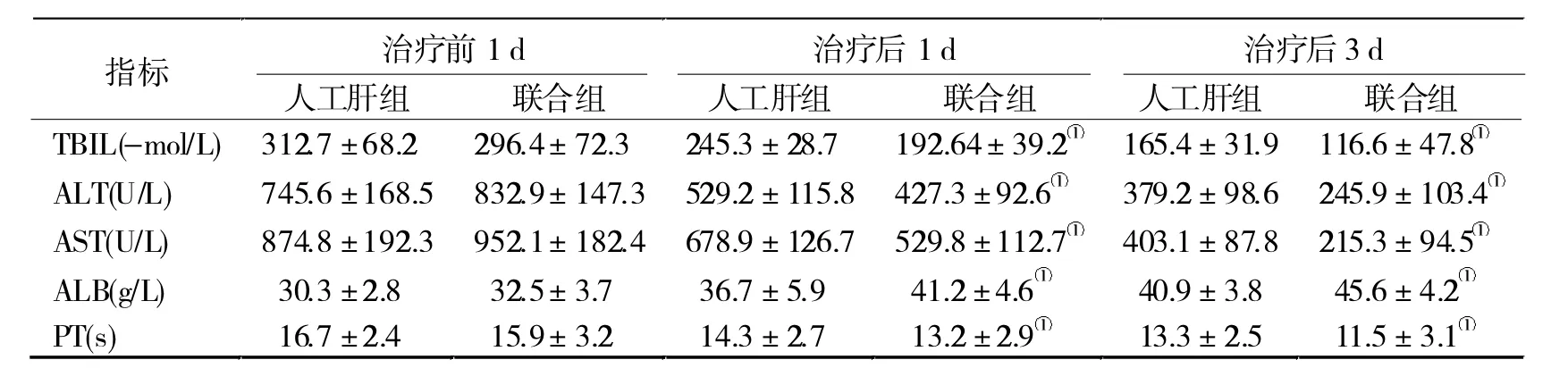
表2 兩組治療前后肝功能和凝血指標比較

表3 兩組治療前后APAECHE-Ⅱ和SOFA評分比較
盡管人工肝和CRRT對ALF的治療效果均較為顯著,但是二者聯合治療ALF的研究較少。本研究發現,聯合組在治療前1 d、治療1 d、治療3 d后,TBIL、ALT、AST明顯降低,較人工肝組有顯著差異(P<0.05),表明聯合組肝功能改善效果更顯著。同時還發現,聯合組較同時間的人工肝組ALB水平明顯升高,PT顯著縮短。這兩項指標對肝功能損害均較為敏感,表明人工肝聯合CRRT治療能夠明顯改善患兒肝功能,促進和維持機體內環境的穩定。不僅如此,在治療后1、3 d,兩組APAECHE-Ⅱ評分和SOFA評分均逐漸降低,且聯合組均低于人工肝組,提示人工肝支持治療是有效的,而聯合使用CRRT治療的效果更好,可進一步提高療效[13]。
綜上所述,人工肝聯合CRRT治療能明顯改善復雜先心病患兒術后肝功能衰竭,為復雜先心病患兒術后肝功能衰竭的治療提供新的臨床思路。

