脂肪間充質干細胞中CCR7過表達對BALB/c小鼠皮片移植免疫調節的影響
陳 芳 姚翠英 田治國 楊云尉
(武漢科技大學附屬天佑醫院整形美容科,武漢 430064)
組織移植是整形外科中常用的組織修復方法,且隨著材料學的不斷發展,為組織修復提供了新的思路。但是,組織工程移植物血管化的速度相對緩慢,血管化不良在一定程度上限制了組織工程的發展。同種異體復合組織移植是臨床上修復大面積或特殊部位(包括:陰莖、肢體或面部等)組織缺損的重要方法,能有效改善部位形態,成為修復重建最為理想的方法之一[1]。近年來,隨著醫療技術的不斷發展,冷凍同種異體手指復合組織移植術開始用于手外科,燒傷整形及美容等科室中,均能獲得良好效果。但是,移植后多數患者需要長時間給予的免疫抑制劑,容易增加術后感染、糖尿病、惡性腫瘤的發生率[2,3]。因此,如何采取有效的措施降低免疫抑制劑使用劑量,減輕對機體免疫的影響成為研究的熱點[4,5]。
間充質干細胞是一種多能干細胞,具有干細胞的所有特征,即自我更新和多向分化能力。目前,臨床上應用相對較多,常與造血干細胞聯合使用,有助于提高移植成功率,加速造血重建。臨床研究表明:間充質干細胞不僅存在于骨髓中,亦可存在于骨骼肌、骨外膜與骨小梁中。而脂肪間充質干細胞是一類特殊的細胞,具有干細胞的特性,在同種異體復合組織移植后免疫調節中發揮重要的作用,但是其機制尚未知曉。CC趨化因子受體7(CCR7)屬于一類趨化因子受體,配體為趨化因子配體21(CCL21)(由淋巴器官分泌生成),且能誘導、表達CCR7并趨化到脾臟等器官中[6-8]。因此,本文采用隨機對照方法進行研究,探討脂肪間充質干細胞中CCR7過表達對BALB/c小鼠異體復合組織移植早期免疫調節的作用,現報道如下。
1 材料與方法
1.1材料
1.1.1動物資料 取BALB/c小鼠5只進行脂肪間充質干細胞的提取、分離及培養,另取2017年5月~2018年1月參與實驗的C57BL6與BALB/c小鼠各30只作為對象,以C57BL6小鼠作為供體獲取皮片,BALB/c小鼠為受體。35只小鼠檢疫合格,雌雄不限,體質量200~420 g,平均(310.63±15.66)g。動物合格證號:SCXK-(吉)2007-0003,所選動物均由醫學動物實驗中心提供,BALB/c小鼠常規飼養,自由攝食、飲水,光照12 h,建模前12 h禁食。
1.1.2儀器與設備 實驗所需儀器與設備見表1。
1.2方法
1.2.1細胞的構建 ①脂肪間充質干細胞的分離、提取:對建模小鼠進行精確稱重,腹腔注射濃度10.0%水合氯醛4 ml/kg,待麻醉生效后進行常規消毒、鋪巾。在脂肪相對集中區域抽取相應脂肪2 ml,同時抽取頸動脈血2 ml,將其放置在-20℃冰箱中,備用。完成上述操作后采用PBS對抽取出的脂肪組織進行清洗,加入膠原酶液,振動,220 r/min離心15 min。采用PBS對獲得的混懸液進行2次清洗,完畢后放入100 mm的細胞培養箱中培養3 d,每3 d換液1次,待細胞融合80.0%時按照1∶5比例進行細胞的擴增培養,調整細胞密度5×104ml-1,并將二代細胞放置在培養箱中繼續培養,待融合90.0%后繼續進行培養、傳代,取第三代脂肪干細胞采用流式細胞儀測定細胞標記物CD90和CD34[9,10]。②細胞的構建:取第三代脂肪間充質干細胞,貼壁后加入10.0%胎牛血清a-MEM培養基重懸,調整細胞密度2×105ml-1,分裝在12孔板中,放入培養箱中過夜。結合試驗需要設置感染復數(MOI)為100,在生物安全柜中向培養基中加入CD197(CCR7)-APC(4B12)慢病毒顆粒包裝試劑,為了提高轉染效率可加入聚凝胺2.5 μl/ml,37℃溫箱下靜置,連續進行6 h 轉染后首次換液。連續進行5~6 d轉染后在熒光顯微鏡下觀察細胞轉染后的熒光。取傳代擴增細胞,向培養基中加入濃度為4 mg/ml的殺稻瘟菌素1 μl/ml,完成轉染細胞的篩選。調整細胞密度2×105ml-1,放置在EP管中,4℃避光靜置20 min,利用PBS連續2次洗滌、備用,見圖1。

表1 儀器與設備Tab.1 Instruments and equipment
1.2.2動物實驗 ①異體復合組織移植動物模型的建立。C57BL6小鼠供體獲取皮片,按照小鼠重量常規腹腔注射戊巴比妥鈉(上海上藥新亞藥業有限公司,國藥準字H31021724)5 g/L進行麻醉,待麻醉生效后進行常規消毒、鋪巾,在無菌條件下采用美蘭劃線并標記圓形皮片直徑1.0 cm,沿著劃線區域完成全層皮片的剪取,給予生理鹽水、紗布覆蓋后備用。BALB/c小鼠受體:根據上述步驟,對BALB/c小鼠給予常規麻醉,無菌條件下在背部采用美蘭劃線并標記圓形皮片直徑1.0 cm,根據劃線區域切除皮膚及皮下組織,形成直徑為1.0 cm的創面,并將C57BL6小鼠供體皮片覆蓋到創面,給予4-0絲線完成縫合、固定,給予無菌棉球加壓、打包覆蓋,采用繃帶包裹、固定,見圖2。②建模后處理。建模成功后分為過表達CCR7組(CCR7組)、脂肪間充質干細胞組(干細胞組)與對照組。CCR7組建模后經尾靜脈注射CCR7脂肪間充質干細胞1×106、干細胞組注射脂肪間充質干細胞1×106、對照組注射等體積生理鹽水,連續進行30 d干預。
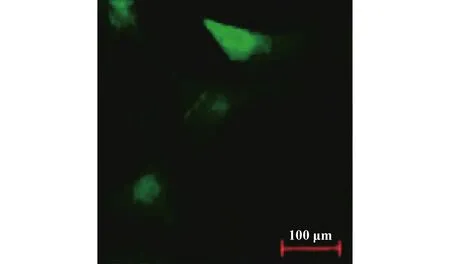
圖1 熒光顯微鏡下細胞熒光(可見細胞熒光,轉染成功)Fig.1 Cellular fluorescence under fluorescence micros-cope (visible cell fluorescence,successful trans-fection)

圖2 異體復合組織移植動物模型建立Fig.2 Establishment of animal model of allogeneic composite tissue transplantationNote:A.The formation of wounds in BALB/c mice;B.The packing and sutures after transplantation of allogeneic skin grafts.
1.2.3觀察指標 ①受體皮片存活面積:分別在小鼠移植后第 3、6、9及30天時進行換藥,創面清理后給予塑料紙描邊記錄受體皮片存活的面積[15]。②HE染色:各組BALB/c小鼠30 d干預完畢后均給予斷頸方式處死,取移植皮片組織,制備5 μm切片,經石蠟包埋后進行HE染色[16,17]。③細胞免疫水平:各組BALB/c小鼠30 d干預后取頸動脈血3 ml,1 129 g離心15 min,血清分離后經非特異誘導劑誘導后采用流式細胞儀測定淋巴細胞中Th17、Treg、Th1/Th2的細胞水平[18,19]。④Th1/Th2細胞因子水平:取上述分離的血清標本,采用酶聯免疫吸附試驗(ELISA)測定患者IL-6、IL-2、IL-10、IL-1β及腫瘤壞死因子-α(TNF-α)的水平。

2 結果
2.1三組受體皮片存活面積比較 CCR7組干預后第3、6、9及30天皮片存活面積均大于干細胞組與對照組(P<0.05);干細胞組預后第3、6、9及30天皮片存活面積均大于對照組(P<0.05),見圖3和表2。
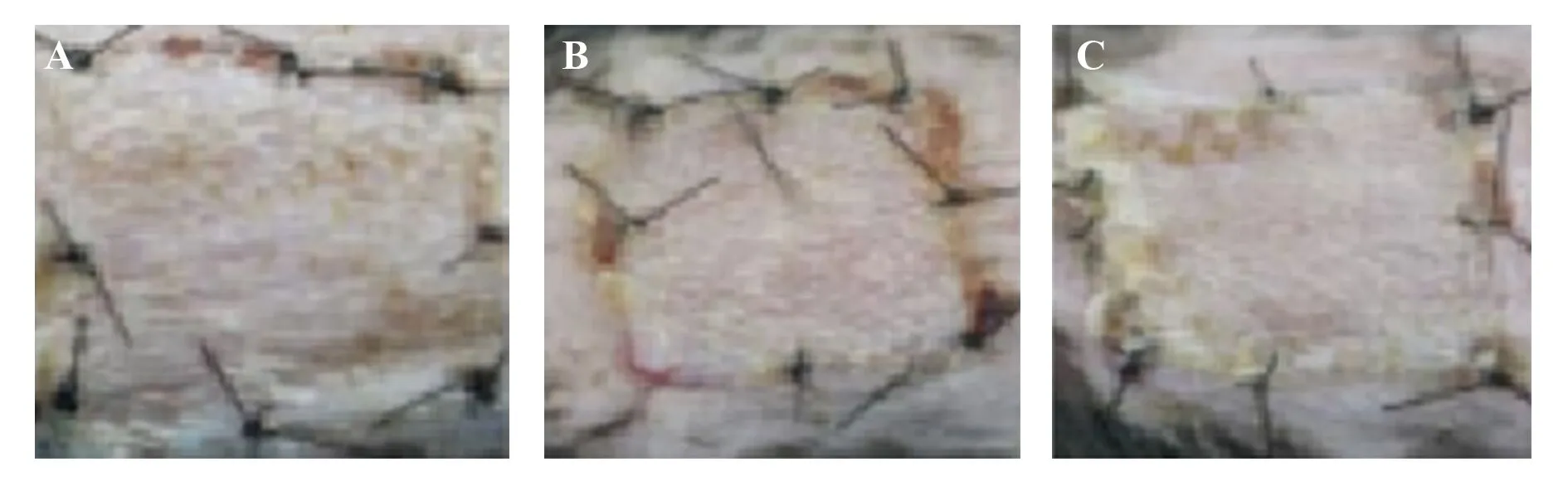
圖3 三組皮瓣面積存活情況Fig.3 Survival of three groups of flapsNote:A.CCR7 Group;B.Stem cell group;C.Control group.

表2 三組受體皮片存活面積比較
2.2各組HE染色比較 HE染色結果表明:CCR7組小鼠多數存在角質層,可見毛囊等皮膚附屬器官;干細胞組角質層剝脫,皮膚附屬器官尚未缺失;對照組角質層剝脫且皮膚附屬器官缺失,見圖4。
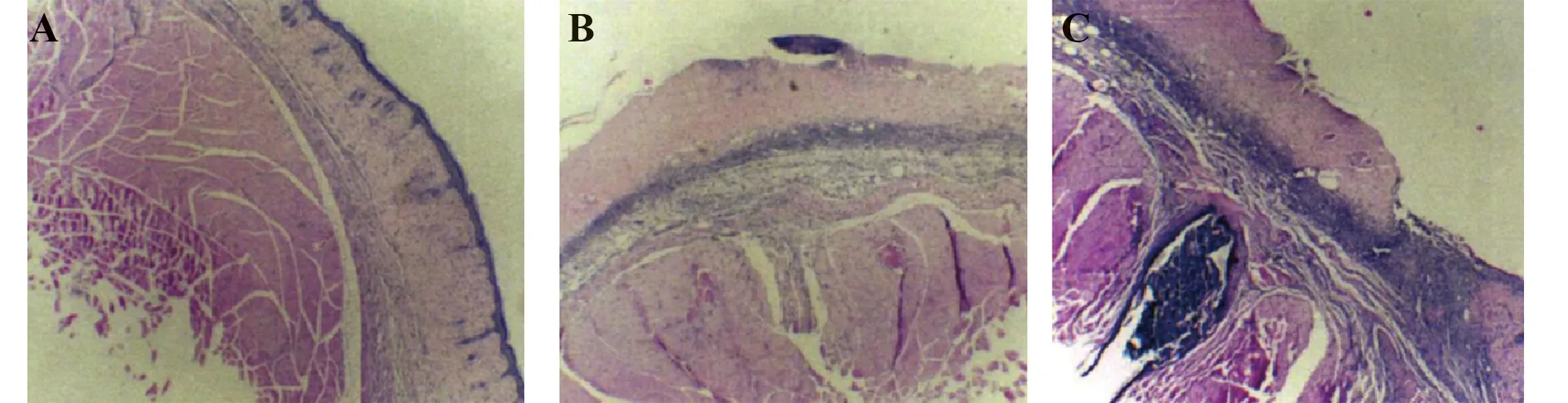
圖4 各組HE染色結果比較(×200)Fig.4 Comparison of HE staining results of each group (×200)Note:A.The results of HE staining in the CCR7 group;B.The results of HE staining in the stem cell group;C.The result of HE staining in the control group.
2.3三組細胞免疫水平比較 CCR7組Th17水平均低于干細胞組和對照組(P<0.05);CCR7組Treg細胞水平高于干細胞組和對照組(P<0.05);干細胞組Th17水平低于對照組(P<0.05); 干細胞組Treg細胞水平高于對照組(P<0.05),見表3和圖5。
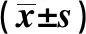
表3 三組細胞免疫水平比較

圖5 三組流式細胞圖Fig.5 Three sets of flow cytometryNote:A.The CCR7 Group;B.The Stem cell group;C.The Control group.
2.4三組Th1/Th2細胞因子水平比較 CCR7組IL-6、IL-2、IL-10、IL-1β及TNF-α水平均低于干細胞組(P<0.05);干細胞組IL-6、IL-2、IL-10、IL-1β及TNF-α水平均高于對照組(P<0.05),見表4。

表4 三組Th1/Th2細胞因子水平比較
3 討論
脂肪間充質干細胞是一種特殊的細胞,具有多向分化潛能,能在特定的調節下向其他細胞分化[20]。近年來,隨著醫療技術的不斷發展,臨床上對于脂肪間充質干細胞誘導免疫的臨床研究已取得階段性進展,但是其免疫抑制作用機制尚未完全清除[21]。臨床研究表明,脂肪間充質干細胞的免疫調節功能主要通過分泌各種細胞因子等產生抑制作用[22]。趨化因子是一種小分子家族蛋白質,在腫瘤的發生、免疫細胞的應答中發揮重要的作用[23,24]。CCR7是表達于細胞表面的趨化因子受體,而CCL21在其定向誘導表達中發揮了重要作用(淋巴結與脾臟是其主要場所)[25]。臨床研究表明:過表達CCR7的脂肪間充質干細胞能在次淋巴結富集[26]。為了進一步分析過表達CCR7脂肪間充質干細胞在小鼠異體復合組織移植中的免疫作用,本研究中構建過表達CCR7細胞,并建立小鼠異體復合組織模型,動物建模成功后注射脂肪間充質干細胞1×106,結果表明:CCR7組干預后第3、6、9及30天皮片存活面積均大于干細胞組與對照組(P<0.05),說明過表達CCR7脂肪間充質干細胞用于小鼠異體復合組織模型中能獲得良好的修復效果,有助于提高皮片的存活率,利于創面的愈合。同時,本文注射劑量為注射脂肪間充質干細胞1×106,該劑量既不太大,又符合小鼠需要,能獲得良好的修復效果,但是對于其他劑量脂肪間充質干細胞對修復效果的影響尚需要進一步研究與探討。
Treg是人體重要的免疫系統(視為免疫系統天然干擾器),其表達水平能抑制、降低小鼠異體復合組織移植過程中產生的排斥反應,是移植免疫的“信號燈”;而Th17屬于一種輔助性T細胞,在炎癥反應的發生、發展中發揮了重要的作用[27,28]。過表達CCR7的脂肪間充質干細胞能抑制CD4+細胞向炎癥Th1細胞與Th17細胞分化,能充分體現免疫抑制作用[29]。本研究中,CCR7組Th17水平低于干細胞組與對照組(P<0.05);CCR7組Treg細胞水平高于干細胞組與對照組(P<0.05);CCR7組IL-6、IL-2、IL-10、IL-1β及TNF-α水平均低于干細胞組(P<0.05);干細胞組IL-6、IL-2、IL-10、IL-1β及TNF-α水平均高于對照組(P<0.05)。說明過表達的CCR7具有良好的免疫抑制作用,有助于改善機體免疫,促進移植皮片的存活,利于創面的修復。臨床研究表明[30]:過表達的CCR7具有良好的歸巢作用,能避免細胞在正常組織中潴留,且在次級淋巴結中能更好地發揮脂肪間充質干細胞的作用,能實現免疫細胞接觸抑制,具有更強的免疫抑制作用。本研究中,HE染色結果表明:CCR7組小鼠多數存在角質層,可見毛囊等皮膚附屬器官;干細胞組角質層剝脫,皮膚附屬器官尚未缺失;對照組角質層剝脫且皮膚附屬器官缺失,說明過表達CCR7脂肪間充質干細胞用于小鼠異體復合組織移植中有利于創面的愈合。但是,本研究僅局限于動物實驗,再加上動物數量較少,獲得的結論存在一定的偏倚性,均需要進一步研究與探討。
綜上所述,注射CCR7脂肪間充質干細胞1×106L-1對小鼠異體復合組織移植早期具有更好的免疫抑制作用,有助于提高受體小鼠的生存狀態。