干擾DOT1L基因抑制胃癌MGC-803細胞增殖、侵襲和遷移
王慶康,宋早智,劉 雪,錢 軍
在我國,胃癌發病率和病死率分居惡性腫瘤的第二位和第三位,晚期胃癌的5年生存率小于5%[1- 2]。放化療主要用于中晚期胃癌患者的治療,但因其不良反應較多,患者通常難以耐受。類端粒沉默干擾體-1(disruptor of telomeric silencing-1, DOT1)是一種在哺乳動物進化過程中發揮作用的保守蛋白,其在人類基因中被稱為DOT1-like(DOT1L)[3]。DOT1L可使組蛋白H3的第79位賴氨酸(H3K79)發生甲基化[4]。對肺癌A549或NCI-H1299細胞DOT1L基因干擾后,細胞常表現出非增殖的多核表型[5]。上皮間質轉化(epithelial mesenchymal transition,EMT)是胃癌發生發展的關鍵驅動因素,在胃癌侵襲、復發轉移的早期階段均發揮重要作用[6]。有研究[7]表明,EMT與H3K79甲基化修飾有一定相關性。該研究通過干擾胃癌MGC-803細胞中DOT1L基因,下調H3K79甲基化水平,進而觀察DOT1L基因對胃癌MGC-803細胞增殖的影響,并探索遷移及侵襲能力改變與EMT的相關性。
1 材料與方法
1.1 細胞株與試劑MGC-803、BGC-823、SGC-7901細胞株均由本實驗室提供;RPMI -1640培養基、1%青霉素-鏈霉素混合物均購自美國Gibco公司;胎牛血清購自杭州四季青生物工程材料有限公司;Real-time PCR試劑盒購自美國Promega公司;TRIzol試劑購自美國Invitrogen公司;Primescript RT試劑購自日本Takara公司;CCK-8試劑盒、RIPA裂解液、BCA蛋白濃度測定試劑盒、0.1%結晶紫均購自上海碧云天公司;Transwell小室購自北京Unique生物公司;matrigel基質膠購自美國BD公司;polybrene、嘌呤霉素、胰酶均購自美國Sigma公司;DOT1L、H3K79me1、H3K79me2、H3K79me3、EMT標識基因蛋白一抗(鼠抗)均購自美國ABclonal公司;β-actin一抗(鼠抗)、DOT1L、H3K79me1、H3K79me2、H3K79me3、EMT標識基因蛋白、β-actin二抗(羊抗鼠)均購自美國Abbkine公司;DOT1L基因相關的上下游PCR引物(上海生工生物有限公司);上海吉瑪公司構建DOT1L-shRNA(正義序列:5′-CCGGGCCCGCAAGAAGAAGCTAAACCTCGAGG-TTTAGCTTCTTCTTGCGGGCTTTTTG-3′;反義序列:5′-AATTCAAAAAGCCCGCAAGAAGAAGCTAAACC-TCGAGGTTTAGCTTCTTCTTGCGGGC-3′),命名為pLKO.1puro-DOT1L-shRNA;陰性對照shRNA(正義序列:5′-CCGGCCTAAGGTTAAGTCGCCCTCGC-TCG AGCGAGGGCGACTTAACCTTAGGTTTTTG-3′;反義序列:5′-AATTCAAAAACCTAAGGTTAAGTCGCCCT CGCTCGAGCGAGGGCGACTTAACCTTAGG-3′),命名為pLKO.1puro-shNC。
1.2 Western blot法比較3種不同胃癌細胞株DOT1L基因的表達水平收集MGC-803、BGC-823、SGC-7901離心后細胞沉淀,提取總蛋白。檢測蛋白濃度后,使用RIPA裂解液調整各組蛋白樣品至等體積等濃度后,加入上樣緩沖液,沸水煮浴10 min使蛋白變性。取等體積3組蛋白樣品組上樣。110 V恒壓電泳完成后電轉移至0.45 μm PVDF膜上,經5%脫脂牛奶封閉2 h后,轉移至孵育盒中,加入TBST稀釋后的DOT1L抗體和β-actin的抗體并4 ℃孵育過夜。次日用TBST洗膜3次,每次10 min。加入二抗室溫搖床孵育2 h,洗膜3次,每次10 min。ECL發光液發光顯色,使用Image J軟件圖像分析,計算出各組細胞中DOT1L基因蛋白的相對表達量。
1.3 選取胃癌MGC-803細胞進行病毒感染將胃癌MGC-803細胞均勻接種于6孔板中,每孔約種5×105個細胞,控制polybrene終濃度為6 μg/ml,按使用說明,用pLKO.1puro-DOT1L-shRNA和pLKO.1puro-shNC分別感染胃癌細胞。病毒感染48 h后更換含10%血清培養基,加入調整后濃度為3 μg/ml的嘌呤霉素,篩選MGC-803細胞2周后繼續擴增。
1.4 Real-time PCR檢測DOT1L基因的轉染提取總RNA,使用Primescript RT試劑對不含DNA的RNA逆轉錄合成cDNA。通過使用Step One Plus Real-time PCR系統,用SYBR Green RT-PCR試劑盒進行所有qRT-PCR的mRNA分析。以下引物用于qRT-PCR:DOT1L上游引物:5′-CATCACTATGGCGTCGAGAAA-3′,下游引物:5′-CGCCTCTCTCCAATGTGTATT-3′;β-actin上游引物:5′-CAGGAAGGAAGGCTGGAAG-3′,下游引物:5′-CGGGAAAT CGTGCGTGAC-3′。PCR反應總體系為10 μl:ddH2O 3.2 μl、Rox 0.2 μl、上游和下游引物各0.3 μl、Mix 5 μl、cDNA 1 μl。PCR擴增條件:95 ℃預變性30 s,95 ℃變性5 s后60 ℃退火34 s,共40個循環。β-actin作為內參,實驗重復3次。各組Ct值與β-actin的Ct值相減得到△Ct,用2-△△Ct方法比較。
1.5 Western blot法檢測轉染效果按1.2項步驟,檢測MGC-803細胞轉染慢病毒后,各組細胞中H3K79甲基化水平。
1.6 細胞集落克隆實驗和CCK-8實驗檢測細胞增殖能力
1.6.1細胞集落克隆實驗 消化各組細胞并計數,以1×103/孔的密度接種在6孔板中,每組均設置3個亞孔。培養至肉眼下可見細胞集落后,棄培養基并加入PBS洗滌,加入600 μl 0.1%的結晶紫染色。室溫下晾干,倒置顯微鏡40倍鏡下相同拍照位置拍照,計算單克隆集落數并作圖。
1.6.2CCK-8實驗 消化細胞并計數后,調整細胞密度為3×103/孔并接種接種于4塊96孔板,每組均設置3個亞孔。培養24、48、72、96 h后向各孔中加入10 μl CCK-8溶液,37 ℃孵育1.5 h后。在波長450 nm下檢測各組細胞吸光度值,繪制增殖曲線圖。
1.7 細胞劃痕損傷實驗檢測MGC-803細胞體外遷移能力6孔板每孔約接種5×105個細胞,各組均設3個亞孔。待細胞隔夜剛長滿貼壁,吸出培養基,加入PBS洗滌3次。經皿底垂直劃直線,加入PBS洗去漂浮細胞。使用不含血清的RPMI 1640培養基進行細胞培養,0、24 h后顯微鏡下拍照并標記拍照位置。用Photoshop軟件測量細胞劃痕距離。本實驗重復3次。劃痕愈合率=(1-24 h距離/0 h距離)×100%。
1.8 Transwell實驗檢測MGC-803細胞遷移和侵襲能力
1.8.1細胞遷移實驗 無血清培養基調整細胞密度為5×105/ml,加入100 μl至Transwell上室,每組均設置3個亞室。下室加入含15%血清的培養基500 μl。培養24 h后,棄去小室內培養基,PBS洗滌并用棉簽輕輕擦拭濾膜上層。甲醇和結晶紫分別進行固定和染色,時長均為20 min,相同位置下取5個高倍視野進行細胞計數。
1.8.2細胞侵襲實驗 將提前24 h預冷的10 μl Matrigel與60 μl的無血清培養基混勻,晾干后還需加入50 μl無血清培養基水化基底膜。培養箱中孵育30 min。余步驟同Transwell細胞遷移實驗。
1.9 Western blot法檢測EMT標識基因蛋白表達水平按1.2項步驟檢測胃癌細胞中E-Cadherin、N-Cadherin和Vimentin蛋白的表達水平。
2 結果
2.1 Western blot法比較胃癌MGC-803、BGC-823、SGC-7901細胞DOT1L表達水平Western blot結果顯示,3種胃癌細胞系中,胃癌MGC-803細胞DOT1L表達水平最高。本研究擬挑選胃癌MGC-803細胞進行后續實驗,見圖1。

圖1 Western blot法檢測3種胃癌細胞株中 DOT1L基因蛋白的相對表達水平
2.2 Real-time PCR檢測DOT1L mRNA表達水平將pLKO.1puro-DOT1L-shRNA和pLKO.1puro-shNC分別感染胃癌MGC-803細胞,檢測3組細胞中DOT1L mRNA的表達水平。結果表明,感染慢病毒shDOT1L組細胞mRNA表達水平較空白對照組和陰性對照組明顯下調,差異有統計學意義(F=54.200,P<0.05),見圖2。

圖2 Real-time PCR檢測DOT1L mRNA水平
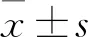
與空白對照組比較:*P<0.05;與陰性對照組比較:#P<0.05
2.3 Western blot法檢測3組細胞DOT1L甲基化水平shDOT1L組細胞內H3K79me1、H3K79me2和H3K79me3的表達水平顯著降低,灰度值差異具有統計學意義(F=71.100,P<0.05;F=104.800,P<0.05;F=33.940,P<0.05)。H3K79甲基化水平下調表明MGC-803細胞的DOT1L基因干擾有效。這與熒光定量PCR結果一致,證明該細胞可用于后續實驗,見圖3。
A:Western blot法檢測干擾DOT1L表達對H3K79甲基化蛋白相對表達水平的影響;B:干擾DOT1L表達對H3K79甲基化蛋白相對表達量的影響;與空白對照組比較:*P<0.05;與陰性對照組比較:#P<0.05
2.4 細胞集落克隆實驗和CCK-8法檢測細胞增殖能力① 細胞集落克隆結果顯示,轉染DOT1L-shRNA慢病毒后細胞形成的集落密度大小尚不及對照組。選取5個固定位置,使用倒置顯微鏡40倍鏡下拍照,空白對照組、陰性對照組及shDOT1L組平均集落數分別為(11.80±0.97)、(12.00±1.00)和(4.20±0.66),差異有統計學意義(F=24.920,P<0.05),見圖4。② CCK-8實驗結果顯示, shDOT1L組細胞在48、72、96 h的增殖效率明顯低于空白對照組和陰性對照組,差異有統計學差異(F=21.440,P<0.05;F=11.390,P<0.05;F=36.620,P<0.05)。以上結果提示干擾DOT1L基因表達抑制MGC-803細胞的增殖能力,見圖5。

圖4 細胞集落克隆實驗檢測MGC-803細胞增殖效率
A:不同組別細胞平板克隆結晶紫染色結果;B:不同組別倒置顯微鏡下細胞團塊數量×40;與空白對照組比較:*P<0.05;與陰性對照組比較:#P<0.05
2.5 劃痕實驗檢測細胞體外遷移能力空白對照組及陰性對照組細胞遷移率為(56±1.05)%、(51±1.31)%,shDOT1L組遷移率為(25±1.33)%。結果表明,干擾DOT1L表達的MGC-803細胞24 h的遷移能力顯著降低,差異有統計學意義(F=43.600,P<0.05),見圖6。
2.6 Transwell實驗檢測細胞遷移及侵襲能力Transwell侵襲實驗結果顯示,24 h后shDOT1L組遷移細胞數(62.33±6.89)較空白對照組(226.70±9.39)和陰性對照組(208.30±12.67)顯著減少,差異有統計學意義(F=82.190,P<0.05)。Transwell遷移實驗結果顯示, 24 h后空白對照組、陰性對照組和shDOT1L組細胞穿膜數分別為(356.70±21.17)、(331.30±12.81)、(169.00±9.64),差異具有統計學意義(F=44.110,P<0.05)。這表明干擾DOT1L基因表達能夠明顯減弱MGC-803細胞的遷移和侵襲能力,見圖7。
2.7 Western blot法檢測EMT標識基因蛋白表達水平結果顯示,干擾DOT1L表達可以減少MGC-803細胞中N-Cadherin和Vimentin的表達, 差異具有統計學意義(F=20.400,P<0.05;F=23.730,P<0.05),而E-Cadherin蛋白表達增加(F=76.060,P<0.05)。這一結果說明,下調DOT1L基因能部分逆轉MGC-803細胞的EMT表型,見圖8。

圖5 CCK-8驗檢測細胞增殖效率
與空白對照組比較:*P<0.05;與陰性對照組比較:#P<0.05
3 討論
DOT1L是一種賴氨酸甲基轉移酶,可以使組蛋白H3的第79位賴氨酸(H3K79)產生單甲基、二甲基和三甲基化[8]。在哺乳動物體內,H3K79甲基化與轉錄的活性相關[9]。有研究[10]表明,在混合譜系白血病中,DOT1L抑制劑讓機體可以產生較強的抗腫瘤作用。針對DOT1L基因高表達的肺癌和乳腺癌以及伴有MYCN擴增的的神經母細胞瘤,DOT1L基因同樣也是潛在的治療靶點[11-13]。然而,目前DOT1L對胃癌的發生發展有何影響,尚無相關報道。
本研究以DOT1L基因高表達的胃癌細胞系MGC-803為研究對象,設計針對DOT1L的pLKO.1puro-DOT1L-shRNA感染MGC-803細胞。成功篩選出DOT1L低表達的細胞株后,探討其對細胞增殖能力的改變以及EMT與遷移侵襲能力改變與的相關性。結果顯示,轉染后實驗組mRNA和相關蛋白的表達均較對照組顯著降低,表明轉染模型成功建立。通過CCK-8法驗證其抑制MGC-803細胞的增殖活性。細胞集落克隆形成實驗結果顯示,DOT1L表達能力降低可顯著抑制MGC-803細胞集落的形成能力,表現為集落數目顯著減少,細胞形態多種多樣,而對照組細胞大小形態一致,集落生長旺盛。該結果表明,DOT1L基因在胃癌MGC-803細胞惡性增殖過程中發揮著重要作用。遷移實驗結果顯示,干擾DOT1L表達后,胃癌MGC-803細胞體外遷移速度明顯減慢,Transwell上室的穿膜細胞數明顯減少。在Transwell侵襲實驗中,自上室侵襲至下室的細胞數目同樣減少。因此,DOT1L基因表達降低也會減弱MGC-803細胞的遷移和侵襲能力。

圖6 細胞劃痕實驗檢測胃癌MGC-803細胞遷移能力
A:不同組別細胞劃痕實驗結果×100;B:不同組別細胞遷移率結果比較分析;與空白對照組比較:*P<0.05;與陰性對照組比較:#P<0.05

圖7 Transwell小室實驗檢測細胞侵襲和遷移能力
A:Transwell侵襲實驗不同組別穿透小室的結晶紫染色結果×200;B:Transwell遷移實驗不同組別穿透小室的結晶紫染色結果×200;C:Transwell侵襲實驗不同組別穿透小室細胞數量;D:Transwell遷移實驗不同組別穿透小室細胞數量;與空白對照組比較:*P<0.05;與陰性對照組比較:#P<0.05

圖8 干擾DOT1L表達對EMT標識基因蛋白表達的影響
A:Western blot法檢測干擾DOT1L表達對EMT標識蛋白相對表達水平的影響;B:干擾DOT1L表達對EMT標識蛋白相對表達量的影響;與空白對照組比較:*P<0.05;與陰性對照組比較:#P<0.05
EMT不僅是一種復雜的多步驟過程, 它還是一種復雜的形態學變化過程, 并與上皮和間充質基因的轉錄或表達水平改變有關[14]。例如上皮細胞標記物E-Cadherin表達減少, 會導致上皮細胞的極性降低,細胞與細胞之間的連接減弱,而N-Cadherin與Vimentin表達增加則使腫瘤細胞遷移和侵襲潛力增強[15]。本研究發現, 干擾DOT1L基因正常表達后, 胃癌MGC-803細胞的EMT過程也會受到影響,表現為E-Cadherin的表達上調而N-Cadherin及Vimentin的表達下調。這或許表明干擾DOT1L基因表達導致EMT過程受到抑制,進而導致胃癌MGC-803細胞的侵襲和遷移能力發生改變。
該研究通過成功干擾DOT1L基因表達,研究實驗組與對照組MGC-803細胞增殖、遷移及侵襲能力的改變。結果表明,干擾DOT1L基因表達后可顯著減弱MGC-803細胞的體外增殖能力。體外侵襲和遷移能力同樣減弱明顯,其機制可能與調控EMT相關蛋白的表達有關。因此,考慮靶向阻斷或者干擾人體內DOT1L基因生物學作用,或許能給胃癌的治療提供新的思路。由于胃癌MGC-803細胞并不能完全代表其他類型的胃癌細胞系,體外細胞實驗亦不能夠完全模擬體內生理生化環境,因此該實驗也存在一定的局限性。為明確DOT1L基因作用于胃癌細胞的具體機制,需要進一步的探索研究。

