葡萄籽原花青素對碘海醇所致HK-2細胞凋亡的保護作用及其機制研究
單微微,翟志紅,丁玉松,王 忠
隨著現今介入診斷及治療的廣泛普及,造影劑(contrast media,CM)的使用日益頻繁。在其應用過程中,所發生的無其它原因的急性腎功能損害稱為造影劑腎病(contrast-induced nephropathy,CIN),目前顯著增多的CIN已成為醫源性急性腎損傷的第三大原因[1-2]。人們對CIN的防治進行了大量的研究,并取得了一些進展,但在現實世界中的臨床獲益并不盡人意[3]。鑒于此,尋找更為有效的預防和治療CIN的藥物顯得意義重大。CIN的發病機制尚不十分明確,目前一致認為CM對腎小管上皮細胞的直接毒性和其所致的氧化應激是CIN發生和發展的主要機制[2,4]。近年來許多研究[5]證實核因子E2相關因子2(Nuclear factor elytroid 2-related factor,Nrf2)在腎臟疾病的防治中具有重要生理學作用,激活Nrf2信號通路能有效提高機體的抗氧化應激和抗損傷能力。目前葡萄籽原花青素(Grape seed proanthocyanidin extracts,GSPE)被認為是天然的Nrf2活化劑,其可激活Nrf2信號通路,從而發揮對機體的保護作用[6-7],而GSPE能否通過 Nrf2信號通路預防CIN卻未有報道。該研究通過體外細胞實驗觀察GSPE對碘海醇所致的HK-2細胞凋亡損傷的保護作用,并探討其保護作用的相關機制,以期對CIN防治的深入研究提供可行的方法。
1 材料與方法
1.1 細胞、藥品與試劑HK-2細胞(上海富衡生物科技有限公司,貨號:FH0228);胎牛血清(以色列BI公司,貨號:BISH0798);DMEM/F12培養基(美國GIBCO公司,貨號:8118125);碘海醇(中國通用電氣有限公司);GSPE(天津尖峰天然產物研究開發有限公司,純度>95.0%,批號:G050412);Annexin V-FITC/PI雙染試劑盒(杭州聯科生物技術股份有限公司,貨號:AP101);ROS檢測試劑盒(南京建成生物技術研究所,貨號:E004);CCK-8試劑盒(貨號:AR1160-500),HRP標記羊抗兔二抗(貨號:BA1054),兔多抗Nrf2、NQO1、HO-1抗體(貨號:BA3790、BM4978、BM4010),兔單抗Keap1、Bcl-2、Bax(貨號:BA4497-2、PB3217、PB3351)(武漢博士德生物工程有限公司);兔多抗caspase-3、兔單抗GAPDH(美國CST公司,貨號:#5174);鼠單抗β-actin、HRP標記羊抗小鼠二抗(北京中杉金橋生物技術有限公司,貨號:TA-09、ZB-2305);總RNA抽提試劑TRIzol(美國Ambion,貨號:15596-026);反轉錄試劑盒(日本TaKaRa,貨號:RR037A);QuantiNova SYBR Green PCR 試劑盒(德國QIAGEN,貨號:Q111-02)。實時熒光定量PCR儀(美國ABI,型號:Quant Studio 6);紫外分析儀(北京君意東方電泳設備有限公司,型號:JY02S)。
1.2 檢測指標和方法
1.2.1細胞培養與分組 用DMEM/F12培養基+10%的胎牛血清配成的完全培養基培養HK-2細胞,在細胞孵育箱中37 ℃、5%CO2環境中孵育。生長至亞融合狀態時換為無血清培養基同步12 h后根據分組給予不同處理。實驗分為4組:① 對照組:細胞正常培養30 h;② 碘海醇組:細胞正常培養24 h后+碘海醇(100 mgI/ml作用細胞6 h);③ GSPE+碘海醇組:GSPE(15、30、60 μmol/L濃度)與細胞共培養24 h后,加碘海醇(100 mgI/ml)作用6 h;④ GSPE組:GSPE(15、30、60 μmol/L濃度)與細胞共培養30 h。
1.2.2細胞增殖/毒性檢測法(CCK-8)測定細胞活力 細胞均勻接種于96孔板,每孔接種5×103個細胞,每組設5個復孔。按以上分組處理細胞后,吸棄板孔中上清液,每孔加入含10% CCK-8的培養基100 μl,繼續培養l.5 h,后取含10% CCK-8的培養基100 μl加入沒有細胞的孔作為陰性對照。用酶標儀在450 nm波長下測定各孔吸光度(A)值。計算細胞存活率(%)=[(實驗組A值-陰性對照組A值)/(對照組A值-陰性對照組A值)]×100%。
1.2.3DCFH-DA熒光結合流式細胞法檢測細胞內ROS 細胞均勻的接種于六孔板,每個組平行設3個復孔,按各組要求處理細胞后把板內細胞培養液移除。用無血清培養基稀釋DCFH-DA,使終濃度為10 μmol/L。于六孔板中每孔加入稀釋好的DCFH-DA 1 ml,后孵育30 min~1 h。取出細胞培養板用PBS洗滌細胞3次,充分除去未進入細胞內的DCFH-DA。消化細胞,收集、離心后用PBS洗滌,再用PBS重懸,流式細胞儀檢測。
1.2.4流式Annexin V-FITC/PI雙標記法檢測細胞凋亡率 細胞均勻接種于六孔板,每孔2×105個細胞,每個組平行設3個復孔,待細胞長至良好狀態時,按以上分組處理細胞。后用不含EDTA的胰酶消化(操作要輕柔,且盡量少吹打細胞)、離心。后用PBS洗滌細胞1次,以盡可能去除殘留的培養基。然后離心,吸棄PBS,再根據Annexin V-FITC/PI雙標記法試劑盒說明書進行操作,后流式細胞儀檢測。
1.2.5Western blot 法檢測HK-2細胞Nrf2、Keap1、NQO1、HO-1和Bax、Bcl-2、Caspase-3蛋白表達 細胞均勻接種于六孔板,每個組設3個復孔,按各組要求處理細胞后,把板內細胞培養液移除,用PBS液輕柔地洗滌細胞3次。后置于冰上操作,每孔加預冷的細胞裂解液150 μl,裂解20 min,后用刮刀將細胞刮下,收集、離心,取上清液,測蛋白濃度并配平。每份樣本取等量蛋白加入上樣緩沖液,煮沸10 min變性,凝膠電泳分離,于轉膜溶液中將蛋白轉移至ECL專用PVDF膜上,室溫下搖動封閉2 h,一抗4 ℃ 孵育過夜,后洗去多余一抗,二抗室溫下孵育l~2 h,然后洗去多余二抗。顯色曝光,分別以GAPDH和β-actin作為內參并作相對量分析。
1.2.6實時熒光定量PCR測定細胞內Nrf2、HO-1、NQO1 mRNA的表達 細胞均勻接種于六孔板中,每個組設3個復孔,按各組要求處理細胞后,把板內細胞培養液移除,用預冷的PBS輕柔地洗滌細胞3次。后TRIzol法提取HK-2細胞內總RNA,后用TaKaRa反轉錄試劑盒將提取的總RNA進行逆轉錄。以逆轉錄后的cDNA為模板,β-actin為內參,在實時熒光定量PCR儀上對Nrf2、HO-1、NQO1基因進行熒光定量PCR擴增,所用引物序列見表1。反應條件:50 ℃、2 min,95 ℃、10 min;95 ℃、30 s,60 ℃、30 s,40 個循環。用相對定量分析公式2-△△Ct,計算基因相對表達量。
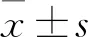
表1 實時熒光定量 PCR 所用引物序列
2 結果
2.1 各實驗組細胞存活率與對照組相比,碘海醇組細胞存活率明顯降低(P<0.01)。與碘海醇組相比,GSPE+碘海醇組細胞存活率呈GSPE劑量依賴性升高,見表2。
2.2 各實驗組細胞凋亡率與對照組相比,碘海醇組細胞凋亡率明顯升高(P<0.01)。與碘海醇組相比,GSPE+碘海醇組細胞凋亡率呈GSPE劑量依賴性降低,見圖1、表3。
2.3 各實驗組細胞內ROS水平與對照組比較,碘海醇組ROS水平顯著升高(P<0.01)。與碘海醇組比較,GSPE+碘海醇組細胞ROS水平呈GSPE劑量依賴性降低,見表3。
2.4 HK-2細胞相關蛋白的表達與對照組相比,碘海醇組Nrf2、HO-1和NQO1的蛋白表達量有所增加,但差異無統計學意義(P>0.05);凋亡相關蛋白 Bax 、Caspase-3的表達量增加,Bcl-2的表達量減少(P<0.05)。與對照組及碘海醇組相比,GSPE(60 μmol/L)+碘海醇組和GSPE(60 μmol/L)組Nrf2、HO-1和NQO1的蛋白表達量均顯著增加(P<0.01)。與碘海醇組相比,GSPE(60 μmol/L)+碘海醇組的Bcl-2蛋白表達量增多(P<0.05),Caspase-3蛋白表達量降低(P<0.05)。Keap1的蛋白表達量各組間差異均無統計學差異意義(P>0.05)。見圖2、3。
2.5 HK-2細胞內Nrf2、HO-1、NQO1 mRNA表達量與對照組相比,碘海醇組Nrf2、HO-1 、NQO1mRNA的表達有所增多,但差異無統計學意義(P>0.05),而 GSPE干預后GSPE(60 μmol/L)+碘海醇組及GSPE(60 μmol/L)組Nrf2、HO-1、NQO1 mRNA的表達上調,與對照組和碘海醇組相比差異有統計學意義(P<0.01),見表4。
表2 各實驗組細胞存活率
與對照組比較:**P<0.01;與碘海醇組比較:#P<0.05
表3 各實驗組細胞內ROS水平和細胞凋亡率
與對照組比較:**P<0.01;與碘海醇組比較:#P<0.05,##P<0.01
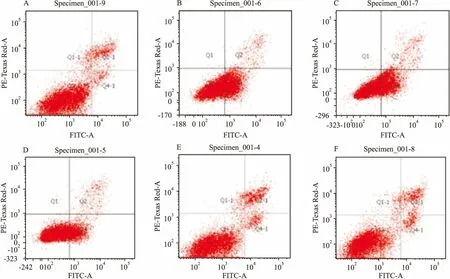
圖1 流式細胞儀檢測各組細胞凋亡率
A:對照組;B:碘海醇組;C:GSPE(15 μmol/L)+碘海醇組;D:GSPE(30 μmol/L)+碘海醇組;E:GSPE(60 μmol/L)+碘海醇組;F:GSPE(60 μmol/L)組
表4 HK-2細胞內Nrf2、HO-1、NQO1 mRNA的相對表達量
與對照組比較:*P<0.05,**P<0.01,與碘海醇組比較:#P<0.05,##P<0.01
3 討論
已有的研究表明:CM對HK-2細胞具有直接毒性并能加重其氧化應激程度,最終引起HK-2細胞的凋亡、壞死[4,8]。在本實驗中用第二代造影劑碘海醇(100 mgI/ml與HK-2細胞共培養6 h)[9]干預體外培養的HK-2細胞,同樣觀察到了細胞活力明顯降低,細胞凋亡率和細胞內ROS含量明顯升高。細胞內過量ROS的產生可引起并進一步加重細胞凋亡損傷,ROS參與調控的細胞凋亡與凋亡相關基因p53所介導的信號通路有關[10],過量的ROS使p53磷酸化,p53是Bcl-2基因家族中細胞凋亡促進蛋白Bax和凋亡抑制蛋白Bcl-2的上游調節基因,當磷酸化的p53與Bax基因啟動子中p53的結合位點結合后,使Bax的表達上調,Bcl-2的表達下調,這兩種功能互相對立的蛋白間的比率關系是決定細胞存亡的關鍵[11]。Bax的過度表達還能促進線粒體內前凋亡分子Cyt-C和凋亡誘導因子的釋放,進而活化下游的Caspase-3蛋白酶 ,介導細胞凋亡[12]。本實驗中碘海醇使HK-2細胞內Bax和Caspase-3蛋白含量增多,Bcl-2蛋白含量下降,Bcl-2/Bax小于1,因此細胞凋亡增多。
相比于碘海醇對HK-2細胞的不良影響,在本實驗中不同濃度的GSPE皆可拮抗碘海醇所致的細胞活力降低,抑制碘海醇誘導的細胞內ROS 升高,降低碘海醇所致的細胞高凋亡率,且在一定劑量范圍內具有濃度依賴性。同時GSPE亦使HK-2細胞內Bcl-2蛋白含量增多,Bax和Caspase-3蛋白含量下降,Bcl-2/Bax大于1。說明GSPE對碘海醇所致的細胞凋亡具有保護作用。

圖2 Nrf2信號通路相關蛋白的表達
A:對照組;B:碘海醇組;C:GSPE(60 μmol/L)+碘海醇組;D:GSPE(60 μmol/L)組;與對照組比較:**P<0.01;與碘海醇組比較:##P<0.01
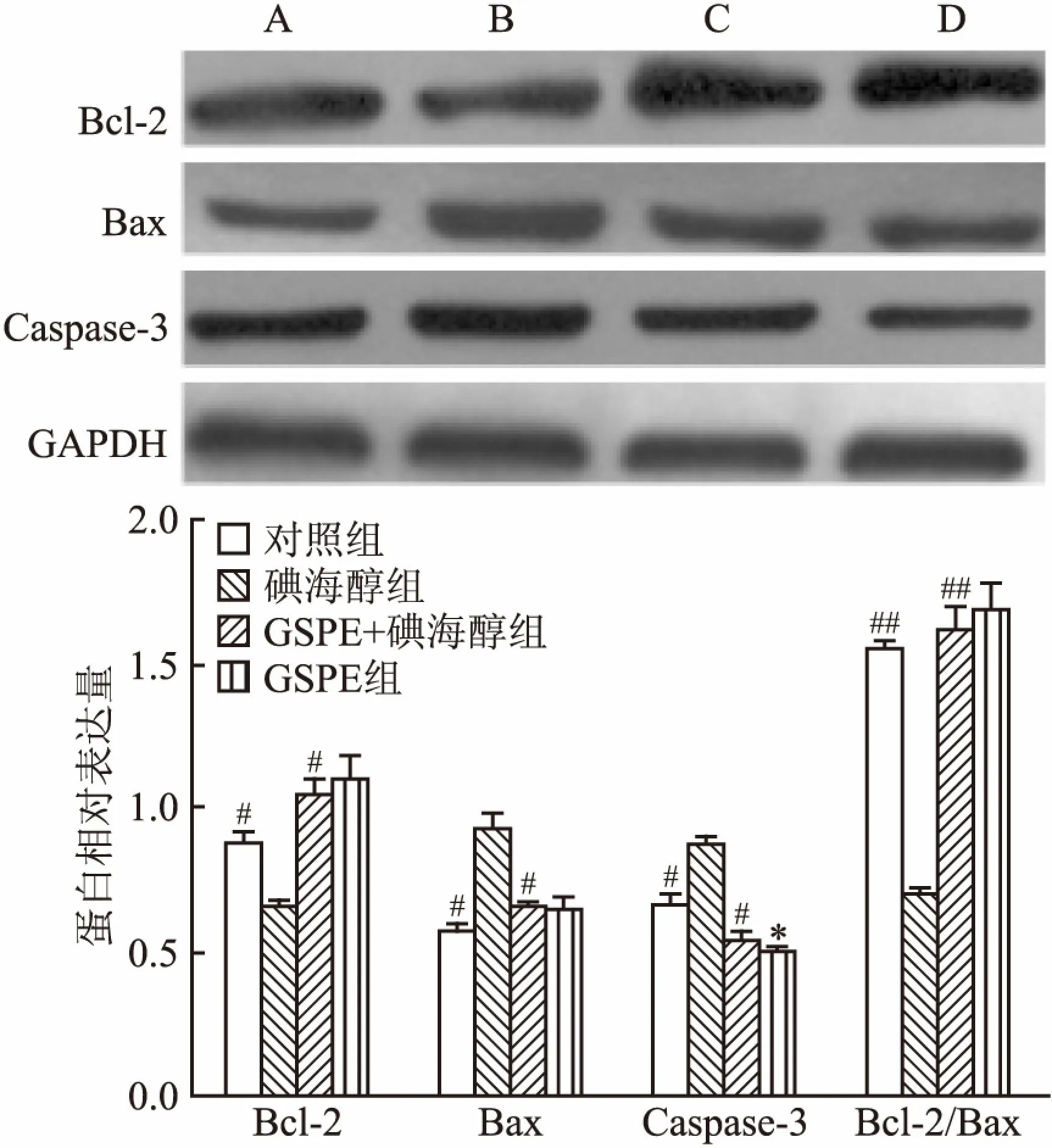
圖3 凋亡相關蛋白的表達
A:對照組;B:碘海醇組;C:GSPE(60 μmol/L)+碘海醇組;D:GSPE(60 μmol/L)組;與對照組比較:*P<0.05;與碘海醇組比較:#P<0.05,##P<0.01
由于Nrf2信號通路是機體主要的抵御外源性刺激和毒物的抗氧化應答反應的核心轉錄因子通路,已經明確其在細胞凋亡中發揮十分重要的作用。其激活的方式主要是Nrf2與Kelch樣環氧氯丙烷相關蛋白-1(Keap1)的解偶聯,Keap1是Nrf2的抑制物,錨定Nrf2于胞漿中處于非活性狀態而被降解,當胞漿中的Keap1與Nrf2解偶聯,活化的Nrf2才能進入細胞核,與抗氧化基因啟動子序列結合,調控抗氧化酶、Ⅱ相代謝酶的轉錄活性,進而發揮抗氧化損傷作用[13]。Nrf2與Keap1解偶聯的發生主要是Keap1構象的改變,由于Keap1蛋白上富含電敏感半胱氨酸結構,在氧化應激或親電子物質刺激下這些半胱氨酸變異,進而導致Keap1構象的變化,Nrf2與Keap1解偶聯,Nrf2的降解減少。在本研究中GSPE提高了HK-2細胞內Nrf2基因的表達量和蛋白含量,而不上調Keap1的蛋白表達量,說明GSPE有可能導致了Keap1構象的變化而激活其調控通路。
細胞抗氧化損傷作用的發揮,胞內ROS的降低與Nrf2調節的下游Ⅱ相代謝酶NQO1、抗氧化酶HO-1的表達密切相關,它們可通過催化醌、氮氧化合物等的雙電子還原來減輕氧化損傷。Jena et al[14]發現蝦青素能增加HO-1和NQO1的表達量,明顯降低環磷酰胺誘導的肝細胞的氧化應激。黃存東 等[15]研究表明激活Nrf2/HO-1信號通路能保護細胞免受氧化應激的損傷。本實驗結果中,GSPE干預組與對照組和碘海醇組相比NQO1和HO-1 基因表達和蛋白的含量均顯著增高,這表明GSPE能通過激活Nrf2信號通路上調了其靶基因表達,從而增強了細胞對不良刺激的抗性。
綜上,GSPE對碘海醇所致的HK-2細胞的凋亡損傷具有明顯的保護作用,其保護作用可能是通過激活Nrf2信號通路而實現的。GSPE作為一種純天然物質有很大的開發應用前景,基于該研究,在未來GSPE可能用于CIN的預防和治療。

