kshv-mir-k12-1-5p靶向調控CDKN1A影響卡波西肉瘤的細胞周期
張 靜,彭靖淇,吳秀娟,普雄明
卡波西肉瘤(Kaposi′s sarcoma,KS)是內皮細胞起源的惡性腫瘤[1]。卡波西肉瘤相關病毒(KSHV)屬于γ2皰疹病毒[2],是KS最重要的病原體。KSHV主要通過編碼miRNAs在KS中發揮作用[3]。miRNAs是非編碼小分子RNA[4]。miRNAs通過結合靶基因3′UTR區下調或沉默靶基因的表達[5]。miRNAs調控超過1/3的人類基因[6],通過復雜的機制在各種細胞過程中發揮重要作用, 廣泛參與腫瘤的形成和發展[7-8]。Wu et al[9]研究顯示 :13個KSHV miRNAs在KS中表達全部上調,其中kshv-mir-k12-1-5p上調最高,KSHV miRNAs主要通過調控或改變細胞周期導致KS的發生[10],故推測kshv-mir-k12-1-5p可能與細胞周期的調控密切相關。細胞周期蛋白依賴性激酶抑制因子1A(CDKN1A)是功能強大的細胞周期負調控因子。miRNAs通過抑制靶基因的翻譯而發揮其生物學功能[11]。現研究kshv-mir-k12-1-5p對靶基因(CDKN1A)的抑制作用及對KS細胞周期的影響,為KS的靶向治療提供理論依據。
1 材料與方法
1.1 細胞株和主要試劑卡波西肉瘤細胞株(KS cell line, SLK)(美國NIH AIDS Research and Reagent Program提供); 293T cells(美國Open Biosystems公司);雙熒光素酶報告系統試劑盒(美國Promega公司);Lipofectamine 2000、TRIzol試劑盒(美國Invitrogen公司);kshv-mir-k12-1-5p 模擬物(mimics)、kshv-mir-k12-1-5p抑制物(inhibitor)、mimics陰性對照(NC)、inhibitor NC(上海吉瑪技術有限公司);RIPA裂解液、細胞周期分析試劑盒(上海碧云天生物技術公司);CDKN1A、GAPDH、HRP(美國Abcam公司)。
1.2 方法
1.2.1細胞培養和轉染 使用對數生長期細胞密度為80%的SLK細胞(KS細胞)。將SLK細胞按每孔2×105細胞接種于96孔板中,培養24 h。Western blot、qRT-PCR及細胞周期PI實驗均分5組進行:mimics組、inhibitor組、mimics NC組、inhibitor NC組、正常細胞組(normal cell group)。使用Lipofectamine 2000轉染試劑將實驗5組分別轉染到SLK中,轉染時間為48 h。
1.2.2雙熒光素酶實驗 將野生型(WT)和突變型(MUT) CDKN1A 3′UTR擴增并構建為pYr-mirTarget重組質粒。然后用Lipofectamine 2000轉染試劑將重組質粒(1 μg)和kshv-mir-k12-1-5p mimics、mimics NC(50 nmol/L) 共轉染293T細胞(5×104)。轉染24 h后,使用雙熒光素酶測定系統檢測熒光素酶相對活性。
1.2.3Western blot(WB)檢測 使用400 μl RIPA裂解液(50 mmol/L Tris/pH7.4、150 mmol/L NaCl、1% NP-40、0.5% sodium deoxycholate、0.1% SDS、sodium orthova-nadate、sodium fluoride、EDTA、leupeptin)提取細胞總蛋白。根據蛋白質含量,繪制標準曲線。制備層疊凝膠(5%)和分離凝膠(12%)。然后進行電泳(1.5 h、100 V)。當溴酚藍到達凝膠板底部時,電泳結束。將蛋白轉移到膜上,整個過程持續70 min,用脫脂奶粉(5%)阻斷膜2 h。一抗CDKN1A稀釋(1 ∶1 000)、GAPDH稀釋(1 ∶1 000)在4 ℃下孵育過夜。HRP二抗稀釋(1 ∶10 000)在37 ℃下孵育2 h、使用增強化學發光成像。利用BandScan進行灰度值分析。
1.2.4實時熒光定量聚合酶鏈反應(qRT-PCR)檢測 使用1 ml TRIzol提取細胞總RNA。用 miScript SYBR Green PCR Kit試劑盒檢測mRNA和miRNA的表達水平。大約3 μg的總RNA用于互補DNA(cDNA)的合成。使用2 μl的cDNA進行PCR擴增。反應條件為:95 ℃ 30 s ; 95 ℃ 5 s , 60 ℃ 32 s,40個循環; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s,60 ℃ 15 s,運用2-ΔΔCt相對定量法進行數據分析。CDKN1A引物(F:5′-CCCGTGAGCGATGGAACTT-3′;R:5′CGAGGCACAAGGGTACAAGAC-3′);以GADPH作為對照 (F:5′-TCAAGAAGGTGGTGAAGCAGG-3′;R:5′-TCAAAGGTGGAGGAGTGGGT-3′);kshv-mir-k12-1-5p引物(F:5′-TGCGCATTACAGG AAACTGGGTG-3′; R:5′-CCAGTGCAGGGTCCGAG GTATT-3′;莖-環結構引物(stem-loop):5′-GTCG TATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATA CGACGCTTACAC-3′)。以U6作為對照(F:5′-CGCTTCGGCAGCACATATAC-3′;R:5′-AAATATGGAACGCTTCACGA-3′)。
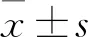
1.2.5細胞周期(PI法)測定 將kshv-mir-k12-1-5p mimics、inhibitor等(50 nmol/L)分別轉染到SLK細胞中。48 h后獲得2×105個細胞。用200 μl的細胞液離心5 min,用PBS洗滌細胞2次。隨后,細胞在-20 ℃下用75%乙醇固定1 h,在4 ℃下預冷。用冷PBS再次清洗細胞。細胞周期分析試劑盒的使用方法參照生產廠家提供的說明書,將Rnase A溶液(20 μl)加入細胞,37 ℃下置于水浴中30 min,然后將PI染料溶液(400 μl)加入混合物中,4 ℃下在黑暗中孵育。采用流式細胞術檢測,檢測波長488 nm。(PI值=S+G2/G1+S+G2,其中PI為增殖活性指數。PI值越大,細胞周期進程越快,細胞周期時間越短,細胞增殖越快。)
2 結果
2.1 kshv-mir-k12-1-5p的轉染水平將kshv-mir-k12-1-5p mimics、 inhibitor等分別轉染到SLK細胞中,qRT-PCR結果顯示,mimics組kshv-mir-k12-1-5p轉染水平最高(4.43±0.07), inhibitor組kshv-mir-k12-1-5p轉染水平最低(0.72±0.02)。各組轉染水平的差異有統計學意義(F=2 971.42,P<0.01),見圖1。
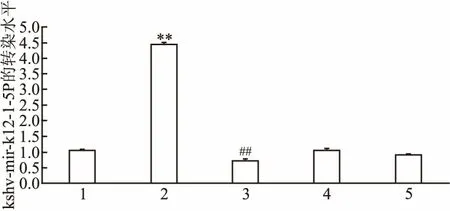
圖1 qRT-PCR檢測kshv-mir-k12-1-5p的轉染水平
1:normal cell group; 2:mimics 組; 3:inhibitor組;4:mimics NC組; 5: inhibitor NC組; 與 mimics NC組比較:**P<0.01;與inhibitor NC組比較:##P<0.01
2.2 CDKN1A 3′UTR與kshv-mir-K12-1-5p的結合位點預測通過Mirbase(http://www.mirbase.org/)靶基因預測軟件分析,從數百個靶基因中選擇CDKN1A作為kshv-mir-K12-1-5p的靶基因驗證,因為CDKN1A與細胞周期調控密切相關,是功能強大的細胞周期負性調控因子。圖2顯示了CDKN1A 3′UTR與kshv-mir-K12-1-5p的種子區序列(Seed sequence)的結合位點。
2.3 kshv-mir-k12-1-5p特異靶向CDKN1A293T細胞分別轉染kshv-mir-k12-1-5p mimics+CDKN1A-WT、mimics NC+CDKN1A-WT、kshv-mir-k12-1-5p mimics+CDKN1A-MUT和mimics NC+ CDKN1A-MUT。24 h后測定熒光素酶的相對活性。kshv-mir-k12-1-5p mimics和CDKN1A-WT共轉染后,相對熒光素酶活性降低(4.56±0.18);kshv-mir-k12-1-5p mimics和CDKN1A-MUT共轉染后,相對熒光素酶活性無明顯變化(7.11±0.17)。 mimics NC和CDKN1A-WT/ CDKN1A-MUT轉染后相對熒光素酶活性無明顯影響[(6.29±0.19)vs(7.04±0.21)]。各組熒光素酶的相對活性差異有統計學意義(F=28.31,P<0.01)。因此,CDKN1A是kshv-mir-k12-1-5p直接作用的靶基因。見圖3。
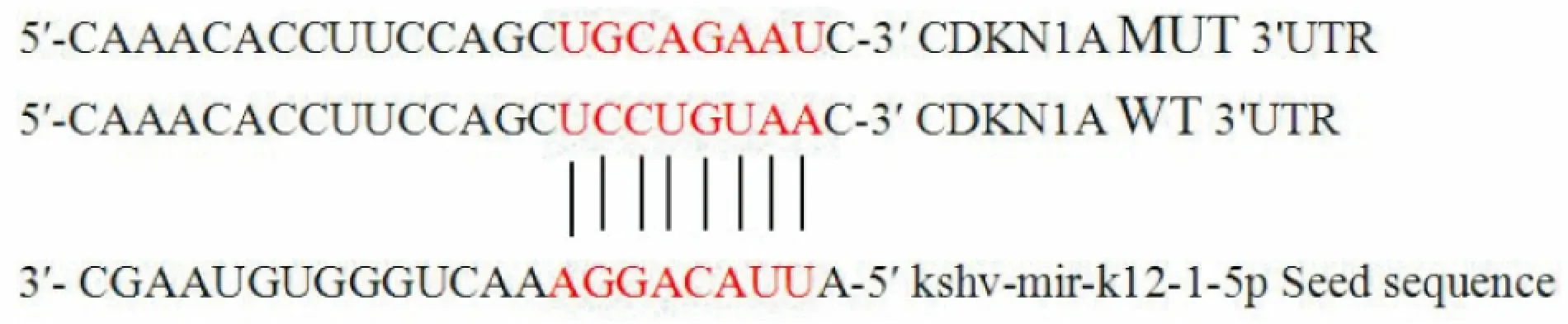
圖2 CDKN1A 3′UTR與kshv-mir-k12-1-5p的結合位點
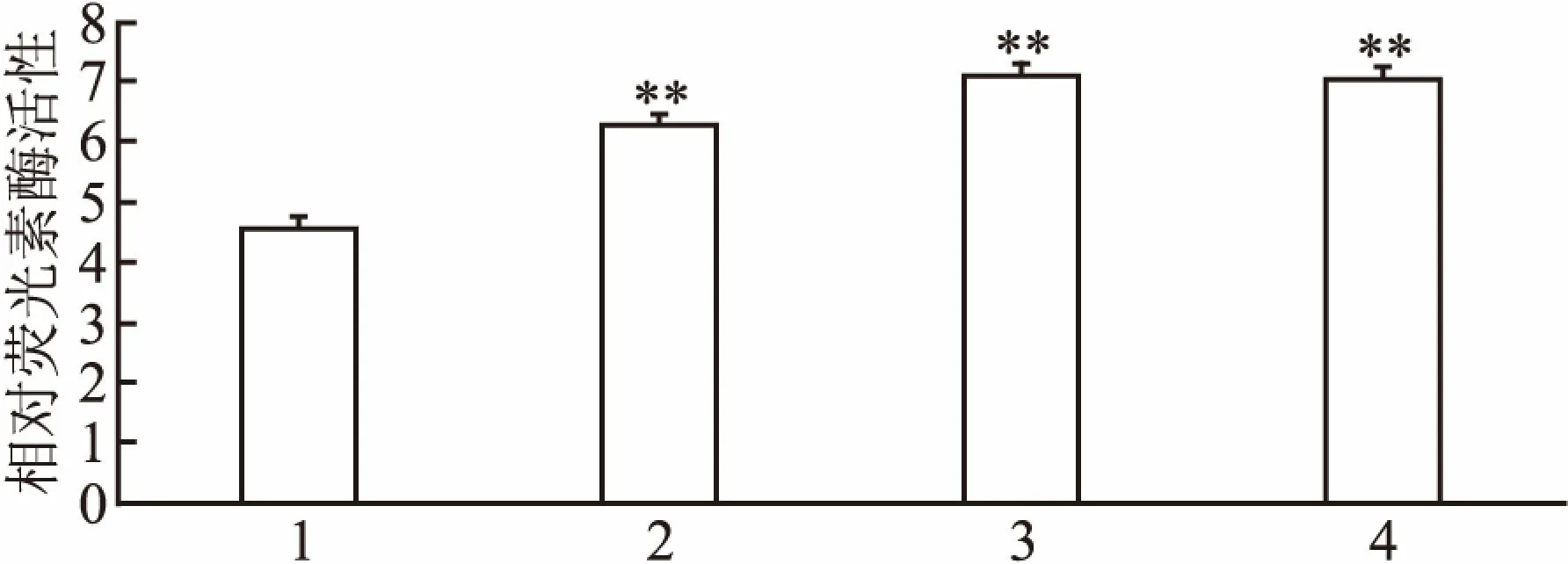
圖3 各組相對熒光素酶活性
1:mimics+CDKN1A-WT組;2:mimics NC+CDKN1A-WT組;3:mimics+CDKN1A-MUT組;4:mimics NC+CDKN1A-MUT組;與mimics+CDKN1A-WT組比較:**P<0.01
2.4 kshv-mir-k12-1-5p負性調控靶基因CDKN1A的表達轉染kshv-mir-k12-1-5p mimics后,SLK細胞中CDKN1A的蛋白表達水平顯著低于其余4組;轉染kshv-mir-k12-1-5p inhibitor后,SLK細胞中CDKN1A的蛋白表達水平顯著高于其余4組;轉染kshv-mir-k12-1-5p mimics后,SLK細胞中CDKN1A mRNA的表達水平顯著低于其余4組;轉染kshv-mir-k12-1-5p inhibitor后,SLK細胞中CDKN1A mRNA的表達水平顯著高于其余4組。各組CDKN1A的蛋白水平(F=76.10,P<0.01)和mRNA表達水平(F=83.31,P<0.01)差異有統計學意義。因此,kshv-mir-k12-1-5p可以負調控靶基因CDKN1A的表達。見圖4。
2.5 kshv-mir-k12-1-5P對SLK細胞周期的影響轉染SLK細胞48 h后,用流式細胞術檢測細胞周期分布情況。結果顯示:與其余4組比較,kshv-mir-k12-1-5p mimics組PI值最高,G1期細胞數量最少,S+G2期細胞數量最多;與其余4組比較,kshv-mir-k12-1-5p inhibitor組PI值最低、G1期細胞數量最多、S+G2期細胞數量最少。各組PI值差異有統計學意義(F=220.01,P<0.01)。因此,kshv-mir-k12-1-5P可加速細胞周期進程,縮短細胞周期時間,促進細胞增殖,促進G1/S期轉換。見圖5。
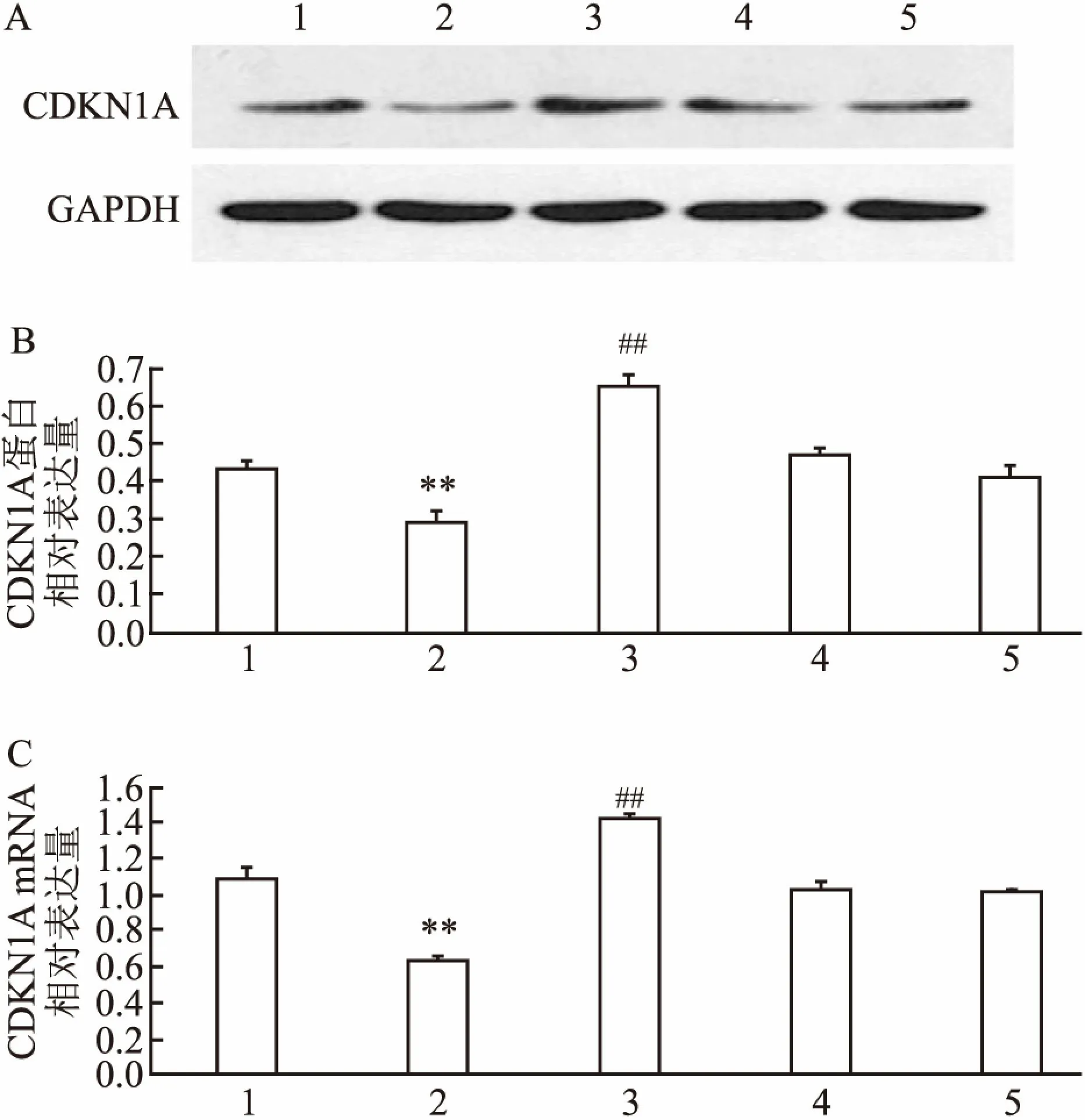
圖4 kshv-mir-k12-1-5p負性調控靶基因CDKN1A的表達
A:Western blot法檢測結果圖;B:CDKN1A蛋白相對表達量;C:CDKN1A mRNA 相對表達量;1:normal cell group; 2:mimics組; 3:inhibitor組;4:mimics NC組; 5: inhibitor NC組; 與mimics NC組比較:**P<0.01;與inhibitor NC組比較:##P<0.01
3 討論
卡波西肉瘤是間葉源性高度播散的血管肉瘤[1]。其在中國新疆高發,主要見于維吾爾族和哈薩克族。KS與獲得性免疫缺陷綜合征(AIDS)、KSHV、血管生成細胞分化和遺傳易感性有關。KSHV是導致人類惡性腫瘤的七種病毒之一,可引起人類宿主終身感染,是KS的重要致病因子。KSHV主要通過編碼的miRNAs發揮作用,KSHV miRNAs對宿主細胞的周期及自身周期均有重要的調控作用,最終可以誘導腫瘤的發生[10]。
Catrina Ene et al[12]通過基因芯片分析了17例KS樣本與3例正常皮膚樣本中miRNAs的表達差異,結果顯示:kshv-mir-k12-4-3p、kshv-mir-k12-1在KS中表達明顯上調,Wu et al[9]通過KS及瘤旁組織中miRNAs表達差異譜分析得出:69個miRNAs在KS中表達明顯上調,101個miRNAs表達明顯下調。其中kshv-mir-k12-1-5p表達上調最為明顯。因此高表達的kshv-mir-k12-1-5p可能與KS的細胞調控密切相關,但需要進一步驗證。miRNAs 的功能研究關鍵在于其靶基因的確定。因為miRNAs通過抑制靶基因的功能來發揮生物學作用[11]。如KSHV感染的淋巴瘤細胞中KSHV miRNA調控的潛在靶基因在該病的發病機制中起關鍵作用[13]。
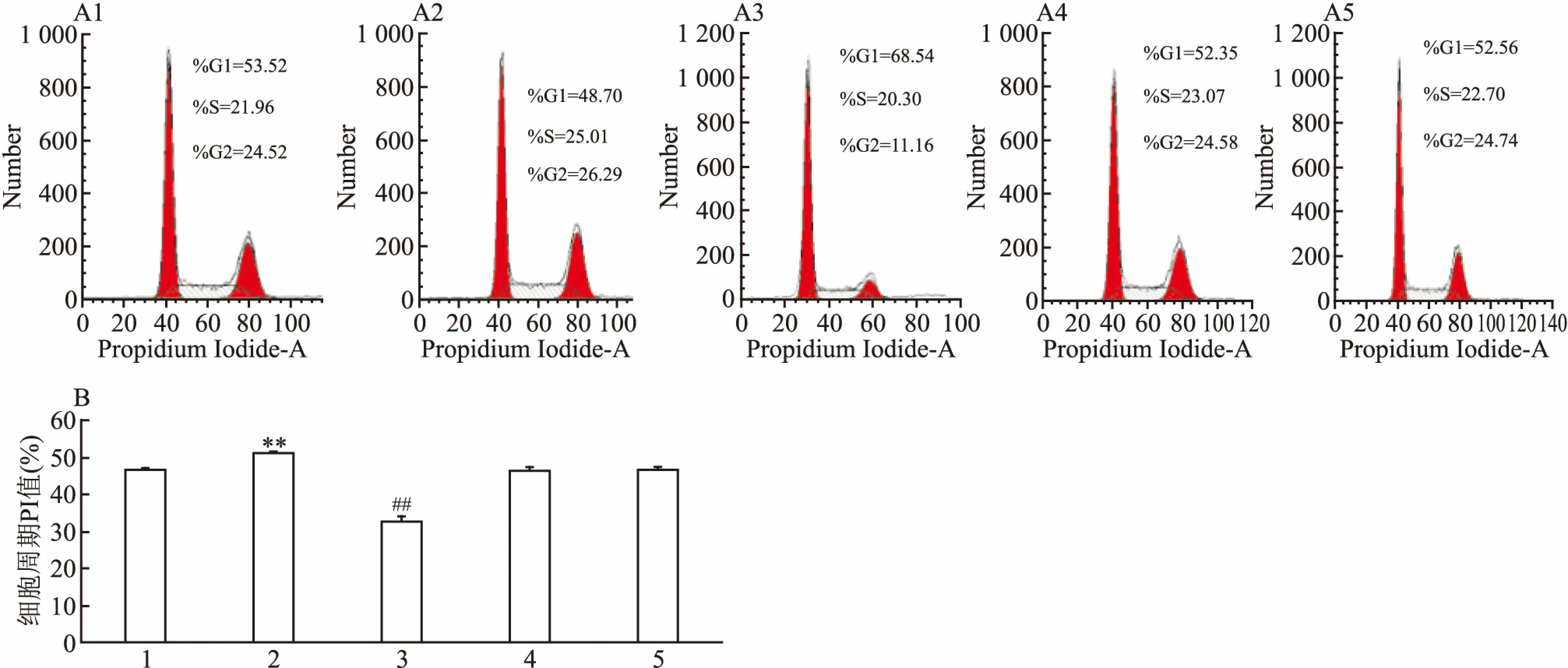
圖5 kshv-mir-k12-1-5P對SLK細胞周期的影響
A:細胞周期分布;B:細胞周期PI值(%);1:normal cell group; 2:mimics組; 3:inhibitor組;4:mimics NC組; 5: inhibitor NC組; 與 mimics NC組比較:**P<0.01;與inhibitor NC組比較:##P<0.01
CDKN1A是細胞周期相關基因,位于6號染色體上。作為一種抑癌基因,在腫瘤中廣泛低表達。細胞周期有兩個重要的檢查點:G1/S期和G2/M期。從細胞周期進程來看,G1/S期的檢查點調控比G2/M期更為重要。CDKN1A主要作用于G1/S期檢查點[14],抑制G1期向S期進展。與P53間接作用細胞周期不同,CDKN1A直接與 Cyclin / CDK復合蛋白或CDK蛋白激酶結合,負性調控細胞周期。當受到化學或物理刺激時,CDKN1A可以修復損傷的DNA,如果CDKN1A受到抑制,細胞沒有完全修復直接進入細胞周期,復制錯誤遺傳信息,將導致腫瘤的發生[15]。
本研究通過檢測熒光素酶表達活性確定了kshv-mir-k12-1-5p可特異性地作用于CDKN1A-3′UTR的結合位點,CDKN1A是kshv-mir-k12-1-5p作用的靶基因。通過體外細胞實驗發現: kshv-mir-k12-1-5p表達上調時,SLK細胞中CDKN1A 的蛋白和mRNA表達水平均明顯下降;kshv-mir-k12-1-5p表達下調時,CDKN1A 的蛋白及mRNA表達水平明顯升高,可見kshv-mir-k12-1-5p能負性調控 CDKN1A的表達。此外,本研究應用細胞周期PI法分析kshv-mir-k12-1-5p對KS細胞周期的影響,結果表明:kshv-mir-k12-1-5p過表達后KS細胞的G1期細胞數量明顯減少,S期和G2期細胞數量明顯增加;抑制kshv-mir-k12-1-5p表達后,KS細胞發生G1期細胞阻滯,S期和G2期細胞數量明顯減少。因此kshv-mir-k12-1-5p可以促進KS細胞G1/S期轉換,加速細胞周期的進程。下一步本課題組將進行體內動物實驗,明確 kshv-mir-k12-1-5p和靶基因共同參與KS發生、發展的機制,為KS的治療提供理論依據和技術支持。
綜上,kshv-mir-k12-1-5p可能通過下調或沉默靶基因CDKN1A的表達發揮細胞周期調控作用。它具有促癌基因的功能,正性調控KS的細胞周期,縮短細胞周期時間,促進G1/S期轉換。導致細胞周期調控紊亂,誘導KS的發生。而抑制kshv-mir-k12-1-5p的表達有可能成為KS的一個新的治療靶點。

