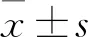
ATRA對(duì)肝癌細(xì)胞HepG2生物學(xué)行為的影響
周 青,魏 翔,張素梅,汪 淵
目前世界每年新增加的癌癥患者約1 808萬,死亡約956萬[1],在未來相當(dāng)長(zhǎng)的時(shí)間癌癥仍將是人類面臨的一項(xiàng)嚴(yán)峻挑戰(zhàn)。隨著現(xiàn)代醫(yī)學(xué)的進(jìn)步人們對(duì)癌癥的本質(zhì)有了深入的了解,腫瘤的治療也由傳統(tǒng)的手術(shù)、放療和化療發(fā)展到多學(xué)科聯(lián)合治療,并出現(xiàn)了誘導(dǎo)分化治療。誘導(dǎo)分化治療是指誘導(dǎo)分化劑作用于腫瘤細(xì)胞后腫瘤細(xì)胞重新向正常細(xì)胞分化,生物學(xué)特性逐漸向正常細(xì)胞靠攏,甚至轉(zhuǎn)變成正常細(xì)胞的現(xiàn)象。維甲酸類化合物是典型的誘導(dǎo)分化劑且在臨床廣泛使用,它包括全反式維甲酸(all-transretinoic acid,ATRA)、3,4-雙脫氫維甲酸(ddRA)、9-順維甲酸(9-cis-RA)和13-順維甲酸(13-cis-RA)等[2]。研究[3]表明ATRA對(duì)多種腫瘤細(xì)胞具有誘導(dǎo)分化、抑制增殖并促進(jìn)凋亡的作用,本文主要研究ATRA作為體外誘導(dǎo)分化劑對(duì)人肝癌細(xì)胞株HepG2在分化、凋亡、遷移和克隆形成等細(xì)胞生物學(xué)行為方面的影響。
1 材料與方法
1.1 材料與試劑人肝癌細(xì)胞株HepG2(安徽醫(yī)科大學(xué)分子生物學(xué)實(shí)驗(yàn)室保存);DMEM培養(yǎng)基(美國(guó)Gibco公司);胎牛血清(美國(guó)Clark公司);ATRA和MTT試劑(美國(guó)Sigma公司);細(xì)胞凋亡Hoechst 33258試劑盒、BCA蛋白定量試劑盒(上海碧云天公司);γ-GT、AFP檢測(cè)試劑盒(上海復(fù)興長(zhǎng)征醫(yī)學(xué)科學(xué)有限公司)等。
1.2 主要實(shí)驗(yàn)儀器二氧化碳培養(yǎng)箱、高速冷凍離心機(jī)和酶標(biāo)儀(美國(guó)Thermo公司);超凈工作臺(tái)(蘇州凈化設(shè)備公司);熒光顯微鏡DM400B和倒置顯微鏡DMI3000B(德國(guó)Leica公司);超聲破碎儀(寧波新芝公司)等。
1.3 實(shí)驗(yàn)方法
1.3.1細(xì)胞的復(fù)蘇和培養(yǎng) 將保存的HepG2細(xì)胞從液氮中取出,37 ℃水浴融化,加入含有10%胎牛血清的DMEM培養(yǎng)基中,混勻。置于37 ℃、5% CO2培養(yǎng)箱中,培養(yǎng)3 d傳代后使用。
1.3.2細(xì)胞形態(tài)的觀察和AFP、γ-GT比活性的檢測(cè) 將HepG2細(xì)胞分為對(duì)照組(含0.1%的DMSO)和ATRA加藥組(ATRA溶解于DMSO中,ATRA終濃度分別為1 μmol/L和10 μmol/L),預(yù)實(shí)驗(yàn)表明0.1%DMSO對(duì)細(xì)胞生長(zhǎng)沒有影響。待細(xì)胞密度達(dá)到80%~90%時(shí),棄去培養(yǎng)液,用PBS洗滌3遍,胰酶消化,DMEM完全培養(yǎng)基終止消化,計(jì)數(shù),用DMEM完全培養(yǎng)基調(diào)整細(xì)胞密度為6×103個(gè)/ml,細(xì)胞按2、5、14、42、72 d時(shí)間培養(yǎng),2、5 d加藥組直接在24孔板中培養(yǎng),14、42、72 d加藥組先在培養(yǎng)瓶中加藥培養(yǎng),3 d傳代1次,最后5 d移至24孔板中培養(yǎng)(調(diào)整細(xì)胞密度為6×103個(gè)/ml)。到達(dá)預(yù)定培養(yǎng)時(shí)間后在倒置顯微鏡下觀察細(xì)胞形態(tài)學(xué)的變化并拍照;收集對(duì)照組和加藥組細(xì)胞,離心取上清液檢測(cè)AFP含量;將細(xì)胞沉淀用PBS洗滌3次,加入含0.5%Triton X-100的Tris-HCl緩沖液,超聲破碎,4 ℃高速離心15 min(15 000 r/min),取上清液用BCA法蛋白定量后檢測(cè)γ-GT比活性。
1.3.3細(xì)胞增殖實(shí)驗(yàn) 細(xì)胞分組、培養(yǎng)方法和培養(yǎng)時(shí)間同上;取200 μl細(xì)胞密度為5×103個(gè)/ml的DMEM完全培養(yǎng)基加入96孔板中,每組6個(gè)復(fù)孔,在到達(dá)培養(yǎng)時(shí)間時(shí),每孔加入10 μl MTT(5 g/L),置37 ℃培養(yǎng)箱中繼續(xù)培養(yǎng)4 h,吸盡孔中培養(yǎng)基, 每孔加入100 μl DMSO,酶標(biāo)儀檢測(cè)對(duì)照組和加藥組吸光度A,細(xì)胞抑制率%=(細(xì)胞對(duì)照組OD570-加藥處理組OD570)/細(xì)胞對(duì)照組OD570×100%,重復(fù)3次,計(jì)算各組細(xì)胞抑制率。
1.3.4細(xì)胞凋亡實(shí)驗(yàn) 將硅化蓋玻片放入清潔液中浸泡,流水沖洗,再用去離子水沖洗,高壓滅菌后置于70%乙醇中浸泡,使用時(shí)超凈臺(tái)中吹干放入24孔板中,種入細(xì)胞;細(xì)胞分組、培養(yǎng)方法和培養(yǎng)時(shí)間同上,各組細(xì)胞在密度達(dá)到50%~60%時(shí)取出蓋玻片放在載玻片上固定并Hoechst染色。熒光顯微鏡下觀察細(xì)胞形態(tài)(激發(fā)波長(zhǎng)350 nm,發(fā)射波長(zhǎng)460 nm),細(xì)胞核致密濃染為凋亡細(xì)胞。每一組細(xì)胞隨機(jī)拍攝3個(gè)視野,細(xì)胞計(jì)數(shù)。重復(fù)3次,計(jì)算細(xì)胞凋亡率,凋亡率=凋亡細(xì)胞數(shù)/細(xì)胞總數(shù)×100%。
1.3.5細(xì)胞遷移實(shí)驗(yàn) 取處于對(duì)數(shù)生長(zhǎng)期的HepG2細(xì)胞,胰酶消化,DMEM培養(yǎng)基終止消化,吹打均勻后接種至24孔板中。待細(xì)胞全部長(zhǎng)滿24孔板底部,用200 μl塑料吸頭在24孔板每孔中央劃出一條直線劃痕,洗去脫落細(xì)胞,在顯微鏡下拍照作為0 h,對(duì)照組和加藥組培養(yǎng)至24、48、72 h時(shí),分別在同一觀察點(diǎn)拍照記錄細(xì)胞劃痕處的細(xì)胞遷移情況,重復(fù)3次。利用Quantity One軟件測(cè)量各孔多點(diǎn)劃痕距離取均值,細(xì)胞遷移距離為0 h的距離減去24、48、72 h處理后的距離。
1.3.6細(xì)胞軟瓊脂克隆實(shí)驗(yàn) 首先在6孔細(xì)胞培養(yǎng)板中鋪設(shè)0.6%瓊脂(每孔3 ml),冷卻凝固作為底層瓊脂;取處于對(duì)數(shù)生長(zhǎng)期的HepG2細(xì)胞,制備成單細(xì)胞懸液并稀釋到終濃度為1×103個(gè)/ml;鋪設(shè)0.3%上層軟瓊脂,按1 ∶1比例吸取2×DMEM培養(yǎng)基,加入0.6%軟瓊脂(70 ℃),迅速混勻再加入細(xì)胞懸液(細(xì)胞終濃度5×102個(gè)/ml),輕輕混勻,按每孔1.0 ml加入6孔板中,6孔板置于濕盒中室溫放置30 min,再連同濕盒一起置于二氧化碳培養(yǎng)箱,在到達(dá)各培養(yǎng)時(shí)間時(shí)每孔加入MTT染液1 ml,30 min后觀察對(duì)照組和加藥組細(xì)胞克隆的形成狀態(tài)并拍照。
2 結(jié)果
2.1 ATRA對(duì)HepG2細(xì)胞分化的影響
2.1.1HepG2細(xì)胞形態(tài)學(xué)的變化 倒置顯微鏡下觀察到HepG2對(duì)照組細(xì)胞成簇狀生長(zhǎng),細(xì)胞密度大,具有良好的光澤度,細(xì)胞形態(tài)不因培養(yǎng)時(shí)間不同而發(fā)生變化(圖1)。1 μmol/L ATRA組和10 μmol/L ATRA組細(xì)胞在第5天時(shí)可見細(xì)胞數(shù)目減少且細(xì)胞形態(tài)不規(guī)則并呈離散狀生長(zhǎng),72 d時(shí)細(xì)胞形態(tài)更為細(xì)長(zhǎng),多核細(xì)胞更少;同一處理時(shí)間段10 μmol/L ATRA組細(xì)胞形態(tài)變化比1 μmol/L ATRA組更加明顯。
2.1.2ATRA對(duì)HepG2細(xì)胞γ-GT比活性和AFP分泌量的影響 與對(duì)照組相比,同一處理天數(shù),1 μmol/L ATRA組和10 μmol/L ATRA組細(xì)胞γ-GT比活性均呈下降趨勢(shì),差異有統(tǒng)計(jì)學(xué)意義。與對(duì)照組相比,1 μmol/L ATRA組和10 μmol/L ATRA組AFP分泌量也呈下降趨勢(shì),但處理時(shí)間較短時(shí)差異無統(tǒng)計(jì)學(xué)意義;與對(duì)照組相比,1 μmol/L ATRA組從第42天起AFP值的差異有統(tǒng)計(jì)學(xué)意義,10 μmol/L ATRA組從第14天起差異有統(tǒng)計(jì)學(xué)意義。見表1。
2.2 ATRA對(duì)HepG2細(xì)胞凋亡的影響在熒光顯微鏡下可以觀察到對(duì)照組的HepG2細(xì)胞核發(fā)出均勻的藍(lán)色熒光(圖2),而1 μmol/L ATRA組和10 μmol/L ATRA組可見核致密濃染的凋亡細(xì)胞(箭頭處為凋亡小體),在第72天10 μmol/L ATRA組凋亡小體最多。統(tǒng)計(jì)顯示自第5天起1 μmol/L ATRA組和10 μmol/L ATRA組凋亡率高于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(表2)。
2.3 ATRA對(duì)HepG2細(xì)胞增殖的影響MTT實(shí)驗(yàn)結(jié)果顯示,與對(duì)照組相比,1 μmol/L ATRA組和10 μmol/L ATRA組從第2天開始生長(zhǎng)受到抑制,差異有統(tǒng)計(jì)學(xué)意義;10 μmol/L ATRA組較1 μmol/L ATRA組對(duì)HepG2細(xì)胞的抑制程度更高(表3)。
2.4 ATRA對(duì)HepG2細(xì)胞遷移的影響對(duì)照組24 h遷移距離為(7.31±3.20) μm,1 μmol/L ATRA和10 μmol/L ATRA加藥組24 h遷移距離分別為(12.28±1.97)μm和(10.50±3.12)μm;48 h對(duì)照組遷移距離為(40.03±4.68)μm,1 μmol/L ATRA和10 μmol/L ATRA加藥組遷移距離分別為(36.15±4.72)μm和(27.41±2.49)μm; 72 h對(duì)照組遷移距離為(50.36±3.14)μm,1 μmol/L ATRA和10 μmol/L ATRA加藥組遷移距離分別為(45.76±4.35)μm和(29.63±2.40)μm。統(tǒng)計(jì)學(xué)分析結(jié)果顯示,加藥組24、48、72 h細(xì)胞劃痕間傷口愈合距離均低于同期對(duì)照組(圖3),差異有統(tǒng)計(jì)學(xué)意義,10 μmol/L ATRA比1 μmol/L ATRA作用更強(qiáng)。
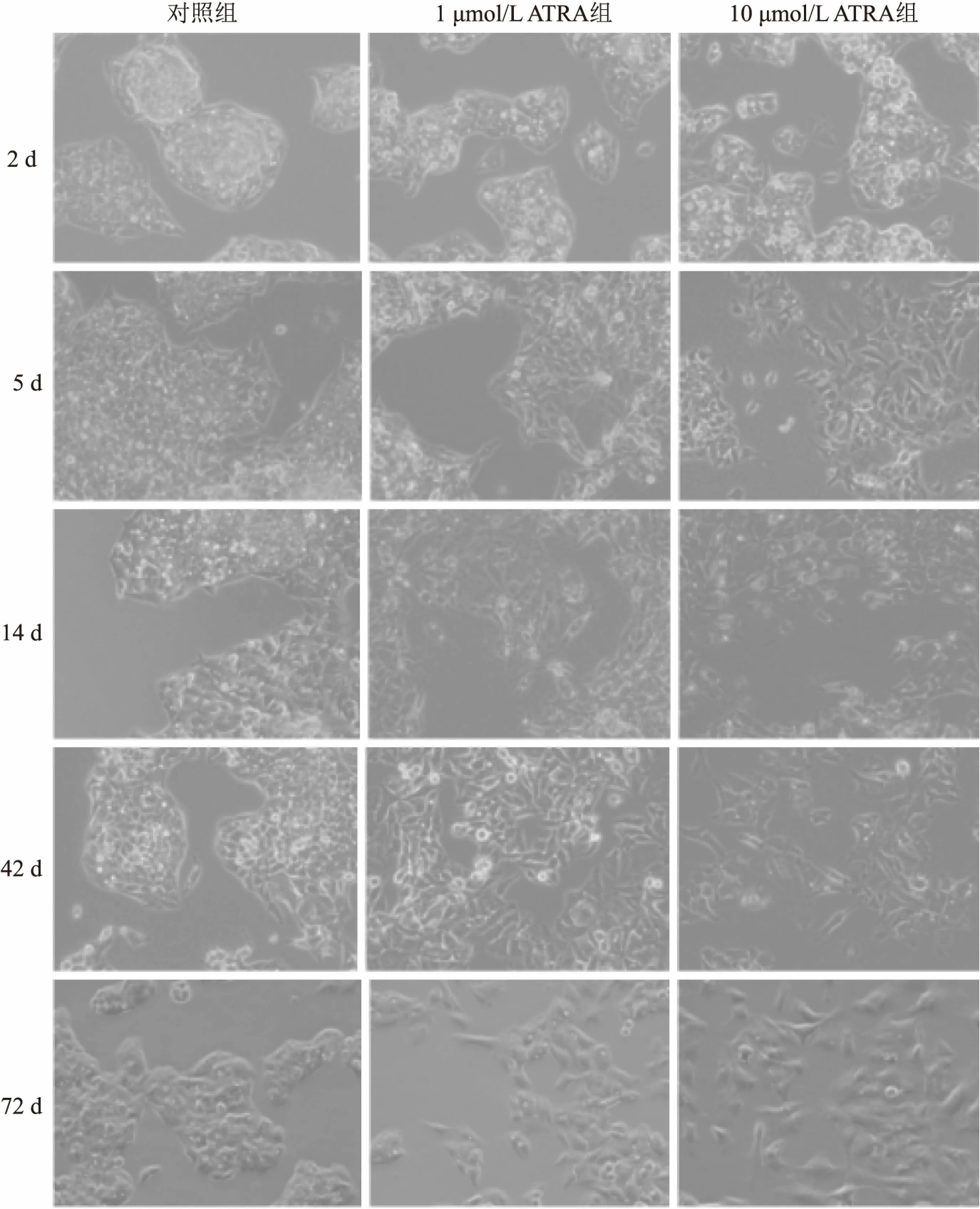
圖1 ATRA誘導(dǎo)HepG2分化在細(xì)胞形態(tài)學(xué)上的影響 ×100

表1 ATRA處理肝癌細(xì)胞HepG2細(xì)胞后 γ-GT的比活性和AFP的分泌量
與對(duì)照組比較:*P<0.05
2.5 ATRA對(duì)HepG2細(xì)胞克隆形成能力的影響軟瓊脂克隆形成實(shí)驗(yàn)表明HepG2細(xì)胞可以在軟瓊脂上形成克隆,與對(duì)照組相比,1 μmol/L ATRA組和10 μmol/L ATRA組克隆數(shù)目減少,到72 d時(shí)1 μmol/L ATRA組仍可見少量克隆,但10 μmol/L ATRA組基本無克隆生長(zhǎng)。提示HepG2細(xì)胞受到ATRA刺激后能明顯抑制HepG2腫瘤細(xì)胞在軟瓊脂中的克隆形成(圖4)。

圖2 ATRA對(duì)肝癌細(xì)胞HepG2凋亡的影響 ×200

表2 ATRA對(duì)肝癌細(xì)胞HepG2凋亡的影響
與對(duì)照組比較:*P<0.05
3 討論
誘導(dǎo)分化劑治療惡性腫瘤的理論基礎(chǔ)是誘導(dǎo)分化劑可以使腫瘤細(xì)胞的分化潛能部分或全部恢復(fù)進(jìn)而轉(zhuǎn)化為正常細(xì)胞,或誘導(dǎo)腫瘤細(xì)胞凋亡從而達(dá)到治療腫瘤的目的[4]。ATRA目前在臨床上常被用于急性早幼粒白血病的誘導(dǎo)分化治療[5]。本研究初步探討ATRA作用于人肝癌細(xì)胞株HepG2后,HepG2細(xì)胞分化、凋亡、遷移和克隆形成等生物學(xué)行為的變化。
本研究選擇γ-GT和AFP作為ATRA誘導(dǎo)HepG2細(xì)胞分化的觀察指標(biāo)。正常血清中γ-GT主要來自肝臟,當(dāng)肝細(xì)胞發(fā)生癌變時(shí)活性逐漸上升且與惡變程度正相關(guān),因此可以把γ-GT作為肝癌診斷的標(biāo)志物[6]。AFP主要由胎兒肝細(xì)胞及卵黃囊合成,正常成人無分泌,且分泌量與肝癌的惡性程度密切相關(guān),AFP是肝癌特異性標(biāo)志物[7],本研究選擇這兩個(gè)指標(biāo)作為觀察HepG2細(xì)胞分化的指標(biāo)。
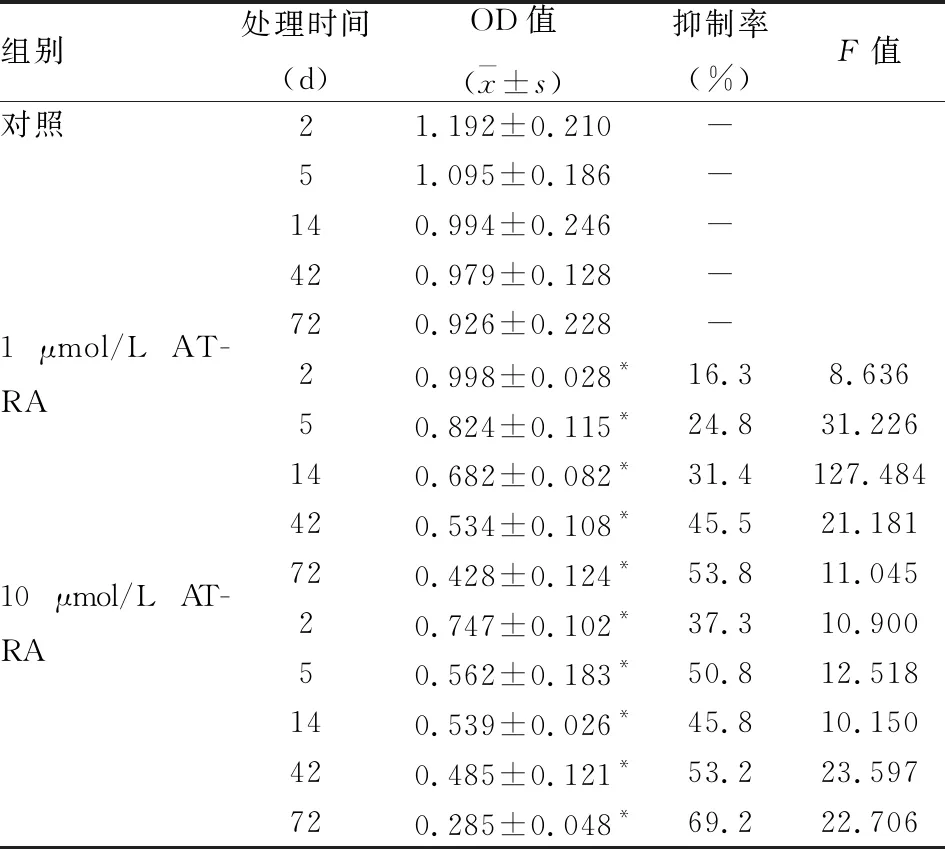
表3 ATRA對(duì)肝癌細(xì)胞HepG2增殖的影響(n=6)
與對(duì)照組比較:*P<0.05
首先觀察了1 μmol/L ATRA和10 μmol/L ATRA藥物處理組對(duì)HepG2細(xì)胞分化的影響,結(jié)果顯示對(duì)照組HepG2成簇狀生長(zhǎng),細(xì)胞密度大,具有良好的光澤度,細(xì)胞形態(tài)不隨培養(yǎng)時(shí)間長(zhǎng)短發(fā)生改變,經(jīng)過ATRA處理后HepG2細(xì)胞生長(zhǎng)離散,細(xì)胞數(shù)目減少,細(xì)胞核變小且發(fā)生凹陷和分葉,胞質(zhì)增多,并隨著作用時(shí)間的延長(zhǎng)形態(tài)學(xué)改變?cè)矫黠@,與Arisi et al[8]的研究中細(xì)胞形態(tài)學(xué)改變一致。結(jié)果分析顯示:同一處理時(shí)間段1 μmol/L ATRA組和10 μmol/L ATRA組的γ-GT比活性和AFP分泌量均低于對(duì)照組;組內(nèi)不同處理時(shí)間段之間γ-GT比活性和AFP分泌量也有差異。ATRA加藥組在誘導(dǎo)HepG2細(xì)胞分化過程中隨處理時(shí)間的增加γ-GT比活性和AFP分泌量呈下低趨勢(shì),表明ATRA處理的HepG2細(xì)胞惡性程度降低[9]。提示1 μmol/L ATRA和10 μmol/L ATRA具有誘導(dǎo)HepG2分化的作用。
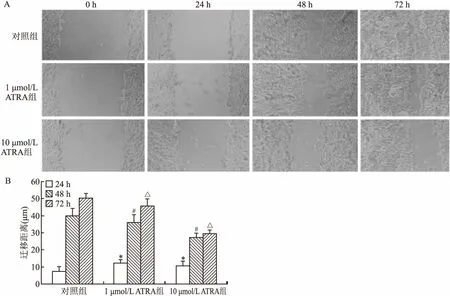
圖3 ATRA對(duì)肝癌細(xì)胞HepG2遷移的影響×100
A:細(xì)胞劃痕實(shí)驗(yàn)圖;B:細(xì)胞劃痕實(shí)驗(yàn)柱狀統(tǒng)計(jì)圖;與24 h對(duì)照組比較:*P<0.05;與48 h對(duì)照組比較:#P<0.05;與 72 h對(duì)照組比較:△P<0.05

圖4 ATRA對(duì)肝癌細(xì)胞HepG2克隆形成能力的影響
MTT試驗(yàn)結(jié)果表明,ATRA能夠抑制HepG2細(xì)胞的增殖,與對(duì)照組比較,ATRA加藥組細(xì)胞均自2 d時(shí)開始受到抑制,細(xì)胞抑制率隨處理時(shí)間的增加而增加,72 d時(shí)細(xì)胞抑制率最高達(dá)到59.043%。Hoechst染色結(jié)果顯示細(xì)胞對(duì)照組在熒光顯微鏡下細(xì)胞核發(fā)出均勻的藍(lán)色熒光,偶見凋亡細(xì)胞,而加藥組可見致密濃染的凋亡細(xì)胞、碎裂和凋亡小體。1 μmol/L ATRA處理72 d后,HepG2細(xì)胞凋亡率(6.244±1.462)%,10 μmol/L ATRA處理72 d后凋亡率為(9.458±2.246)%。說明ATRA不僅可以促進(jìn)HepG2細(xì)胞向正常細(xì)胞再分化、抑制HepG2細(xì)胞增殖還可以誘導(dǎo)HepG2細(xì)胞凋亡[10]。
根據(jù)劃痕實(shí)驗(yàn)結(jié)果可以初步研究腫瘤細(xì)胞的遷移能力,通過判斷細(xì)胞對(duì)照組與加藥組劃痕的愈合距離來判斷細(xì)胞的遷移能力強(qiáng)弱[11]。實(shí)驗(yàn)中觀察到在低濃度血清培養(yǎng)基中,1 μmol/L ATRA組和10 μmol/L ATRA組細(xì)胞劃痕間傷口愈合距離在24、48、72 h均低于對(duì)照組;提示ATRA具有抑制HepG2細(xì)胞的遷移能力,且隨著藥物濃度的增加其抑制遷移的作用也隨之增強(qiáng)。
HepG2細(xì)胞對(duì)照組在軟瓊脂上形成較多的克隆,ATRA刺激后HepG2細(xì)胞在軟瓊脂中的克隆形成減少,72 d后10 μmol/L ATRA組幾乎無克隆形成,但1 μmol/L ATRA組仍可見少量克隆。提示ATRA能夠抑制HepG2細(xì)胞在體外克隆形成能力且ATRA對(duì)HepG2克隆能力的抑制程度呈時(shí)間與劑量依賴。

