掌葉覆盆子組培快繁技術
謝從壽 陳泳和 應薛養 鄭平漢 楊福良 饒寶蓉 熊欣沁 胡建珠 陳琦輝


摘?要:為掌葉覆盆子的組培快繁篩選最佳培養基配方。以掌葉覆盆子優良單株NS8一年生枝條為外植體,在不同激素成分及濃度水平下進行組織培養試驗。結果表明:最適宜的誘導培養基為MS+6BA 1.5 mg·L-1+NAA 0.15 mg·L-1+GA3 0 mg·L-1,誘導率達到68%,芽苗健壯;最佳增殖培養基為MS+6BA 1.5 mg·L-1+NAA 0.1 mg·L-1,苗勢健壯,增殖系數達到4.87;最佳生根培養基為1/2MS+NAA 0.6 mg·L-1+IBA 0.2 mg·L-1+活性炭0.8 g·L-1,生根率達到95.3%,生根數達到5.7條,根長達到5.8 cm,根系發達,苗勢健壯。結果表明篩選出的最佳培養基配方適宜本土掌葉覆盆子品種的組培快繁,為在短期內獲得大量優質種苗及大規模商業化生產提供依據。
關鍵詞:野生資源;掌葉覆盆子;組織培養;快速繁殖
中圖分類號:S567?文獻標志碼:A?文章編號:0253-2301(2020)10-0032-05
DOI: 10.13651/j.cnki.fjnykj.2020.10.006
Abstract: The optimal medium formula was selected for the tissue culture and rapid propagation of Rubus chingii. In this paper, the fine NS8 annual branch of Rubus chingii was used as the explant to conduct the tissue culture experiments under different hormone composition and concentration levels. The results showed that the best induction medium was MS+6BA 1.5 mg·L-1+NAA 0.15 mg·L-1+GA3 0 mg·L-1, in which the induction rate reached 68%, and the bud seedlings were haleness. The best medium for proliferation was MS+6BA 1.5 mg·L-1+NAA 0.1 mg·L-1, in which the growth state of the seedlings was haleness and the proliferation coefficient reached 4.87. The best medium for rooting was 1/2MS+NAA 0.6 mg·L-1+IBA 0.2 mg·L-1+ activated carbon 0.8 g·L-1, in which the rooting rate reached 95.3%, the number of rooting was 5.7, and the root length was 5.8 cm, with well developed root system and good growth vigor of seedlings. The results showed that the selected best medium formula was suitable for the tissue culture and rapid propagation of local Rubus chingii, which would provide the basis for obtaining a large number of high-quality seedlings and large-scale commercial production in a short period of time.
Key words: Wild Resources;Rubus chingii;Tissue culture;Rapid propagation
掌葉覆盆子Rubus chingii Hu為薔薇科Rosaceae懸鉤子屬Rubus L.多年生漿果類藤本灌木,其未成熟的干燥果實具有益腎、固精、縮尿等功效[1-2],是重要的傳統中藥材,在治療亞健康及中老年保健領域得到廣泛應用。成熟果實酸甜可口,味道鮮美,營養豐富,藥食兼用,被譽為繼柑橘、獼猴桃之后的第三代新型水果[3]。福建省武夷山市和浙江省淳安縣是掌葉覆盆子的重要發源地,擁有豐富的野生掌葉覆盆子資源[4-5]。南平市農業科學研究所從2016年開始調查和收集兩地野生掌葉覆盆子,并從大量的群體中篩選出生長勢強,株型挺拔,果實碩大,果心小、風味濃郁、色澤艷麗、抗病性強的藥用和鮮食采摘型品種,可在福建、江西、浙江等南方丘陵山地種植。
掌葉覆盆子傳統的繁殖方式為采挖野生苗、種子繁殖、根蘗繁殖、分株繁殖等[6-8]。過度采挖野生苗對野生資源破壞大,種子繁殖發芽率偏低[9],根蘗和分株繁殖對母株的傷害較大,影響母樹的產量。傳統的繁殖方法,或繁殖系數過低,或株間差異較大,群體良莠不齊,同時長期采用無性繁殖,會促使病毒積累,往往造成產量和品質下降。通過組織培養方式繁殖種苗,可以對植株進行脫毒復壯,固定優良品種性狀,防止品種退化,具有繁殖周期短、繁殖速度快、繁殖系數高、植株性狀整齊一致,種苗質量好等優點。劉計權[1]研究認為,掌葉覆盆子的生根培養中無須添加外源激素也能生根,且其生長勢明顯高于非組培苗;孫長清[10]對掌葉覆盆子的生物學特性進行了較為細致的研究,發現根插條用50 mg·L-1的ABT1生根粉浸泡0.5、1 h后,可提高生根率,但出芽率下降;潘彬榮等[2]研究認為,利用莖段能誘導出不定芽,最佳誘導培養基為MS+6BA 1.5 mg·L-1+NAA 0.2 mg·L-1,最佳分化培養基為MS+KT 2.0 mg·L-1+NAA 0.4 mg·L-1,最佳生根培養基為1/2MS+NAA 0.2 mg·L-1,平均每株生根4.8條;王利平等[11]研究認為,當年生莖段可誘導出不定芽,最佳誘導培養基為MS+6BA 0.5 mg·L-1+NAA 0.01 mg·L-1,最佳繼代培養基為MS+6BA 1.0 mg·L-1+NAA 0.1 mg·L-1,最佳生根培養基為MS+NAA 0.1 mg·L-1+IBA 0.1 mg·L-1。
目前福建省掌葉覆盆子組培快繁技術的研究較少,而隨著地域和品種的不同,往往導致研究結果差異較大,所以其他地區和品種的研究只能為福建省掌葉覆盆子的組培快繁技術提供一定的數據支持。為此南平市農業科學研究所在調查、收集、選育野生掌葉覆盆子及前人工作的基礎上,開展組培快繁技術研究,期望篩選出適宜本地掌葉覆盆子品種的各培養階段最佳培養基配方,為在短期內獲得大量優質種苗及大規模商業化生產提供依據。
1?材料和方法
1.1?試驗材料
以自選的南平市野生掌葉覆盆子優良單株NS8作為供體材料,以其一年生帶芽嫩枝莖段為外植體。
1.2?試驗方法
1.2.1?外植體處理和消毒?在晴天,選擇無病蟲的健康植株,剪取一年生帶芽枝條,剪去所有葉片,用柔軟牙刷輕刷洗凈,放在洗衣粉溶液下浸泡30 min,撈起洗凈后,放在自來水下沖洗2 h,在超凈工作臺上用無菌水清洗2次,用75%酒精消毒30 s,然后用0.1%升汞溶液消毒6~12 min,再用無菌水沖洗6遍,將帶芽莖段用無菌紙吸干后接種于誘導培養基中培養。
1.2.2?不定芽的誘導?采用L16(43)正交試驗設計,對帶芽莖段最佳誘導培養基進行篩選。共選用3個激素,每個激素設4個濃度水平(mg·L-1),6
BA 0.5、1.0、1.5、2.0 mg·L-1,NAA 0、0.05、0.15、0.25 mg·L-1,GA3 0、0.3、0.5、0.7 mg·L-1,共16個處理。每個處理接種30瓶,每瓶接種2個帶芽莖段,3次重復,30 d后調查誘導率。
1.2.3?不定芽的增殖?6BA濃度為1.0、1.5、2.0 mg·L-1,NAA濃度為0.05、0.10、0.15 mg·L-1,完全隨機區組設計,共9個處理。每瓶接10個不定芽,10瓶為一重復,設3個重復,30 d后調查其增殖系數。
1.2.4?不定芽的生根培養?NAA+IBA的濃度分別為0.3 mg·L-1+0 mg·L-1、0.6 mg·L-1+0 mg·L-1、0.9 mg·L-1+0 mg·L-1、0 mg·L-1+0.2 mg·L-1、0 mg·L-1+0.4 mg·L-1、0 mg·L-1+0.6 mg·L-1、0.3 mg·L-1+ 0.1 mg·L-1、0.6 mg·L-1+0.2 mg·L-1,共8個處理,每處理接種10瓶,每瓶接10個不定芽,設3個重復,45 d后調查其生根數、根長(cm)、生根率。
1.2.5?培養條件?將消毒處理好的外植體接入誘導培養基,35 d后將誘導出的帶3~4節的小苗剪成帶芽莖段,轉接到增殖培養基上,培養15 d左右,芽苗基部長出大量的不定芽,當不定芽長到2~3 cm時,轉接到生根培養基上。誘導和增殖階段以MS為基本培養基,食用白糖30 g·L-1,卡拉膠7 g·L-1,pH 5.8。生根階段以1/2MS為基本培養基,食用白糖20 g·L-1,卡拉膠7 g·L-1,活性炭0.8 g·L-1,pH 5.6。培養條件為:培養溫度(25±1)℃,光照每天12 h,光照強度2000 lx。
1.2.6?統計及分析方法?試驗結果用Minitab 19軟件進行方差分析和Fisher LSD多重比較,顯著性水平為P<0.05。誘導率為出芽株數/無污染株數, 增殖系數為總芽數/接種芽數, 生根率為生根株數/總株數。
2?結果與分析
2.1?不同培養基對外植體誘導率的影響
帶芽莖段接種10 d后開始出現芽點,20 d后芽苗長至2~3 cm(表1)。
從表1可知,誘導率主要受6BA影響,隨著6BA濃度的升高,其誘導率呈現先升后降的趨勢。6BA濃度在0.5~1.0 mg·L-1時,誘導率為0.26~0.46,當6BA濃度為1.5~2.0 mg·L-1時,誘導率為0.64~0.77,和6BA濃度在0.5~1.0 mg·L-1相比,誘導率明顯提高,達到顯著水平。NAA會加速泡沫狀愈傷的形成,濃度越高,泡沫越多,當NAA濃度為0.25 mg·L-1時,泡沫愈傷過多,蓋住了整個外植體基部,影響誘導芽的形成和生長。GA3主要影響芽苗的長勢,對外植體的誘導沒有影響。當GA3為0.5~0.7 mg·L-1時,芽苗偏細、高。綜合來說,誘導培養基以處理Y11為最佳,誘導率達到68%,芽苗健壯。
2.2?不同培養基對外植體增殖效果的影響
增殖培養基接種7 d左右,小苗基部開始出現小芽點,15 d左右增殖苗慢慢長出。從表2可以看出,6BA和NAA對不定芽增殖系數都有先升后降的趨勢,當6BA濃度在0.5~1.5 mg·L-1時,隨著6BA濃度的增加,增殖系數也隨著增加,當6BA濃度在1.5~2.5 mg·L-1時,隨著6BA濃度的增加,增殖系數開始下降,因此過高的6BA濃度不利于增殖。NAA也有類似的規律,當NAA濃度在0.05~0.10 mg·L-1時,隨著NAA濃度的增加,增殖系數也隨著增加;當NAA濃度在0.10~0.15 mg·L-1時,隨著NAA濃度的增加,增殖系數開始下降。NAA雖然有利于不定芽的增殖,但濃度過高會產生大量的泡沫狀愈傷,覆蓋整個不定芽基部,影響不定芽的增殖和生長。
從表2和表3可知,6BA和NAA是影響增殖的最主要因素,6BA×NAA的P值=0.07>0.05,因此,6BA和NAA基本沒有互作,獨立地對增殖發揮作用。各處理之間增殖系數有先升后降的趨勢,6BA是影響增殖系數的主要因素,NAA次之,以處理Z5綜合表現最好,增殖系數為4.87,增殖苗健壯。
2.3?不同培養基對生根效果的影響
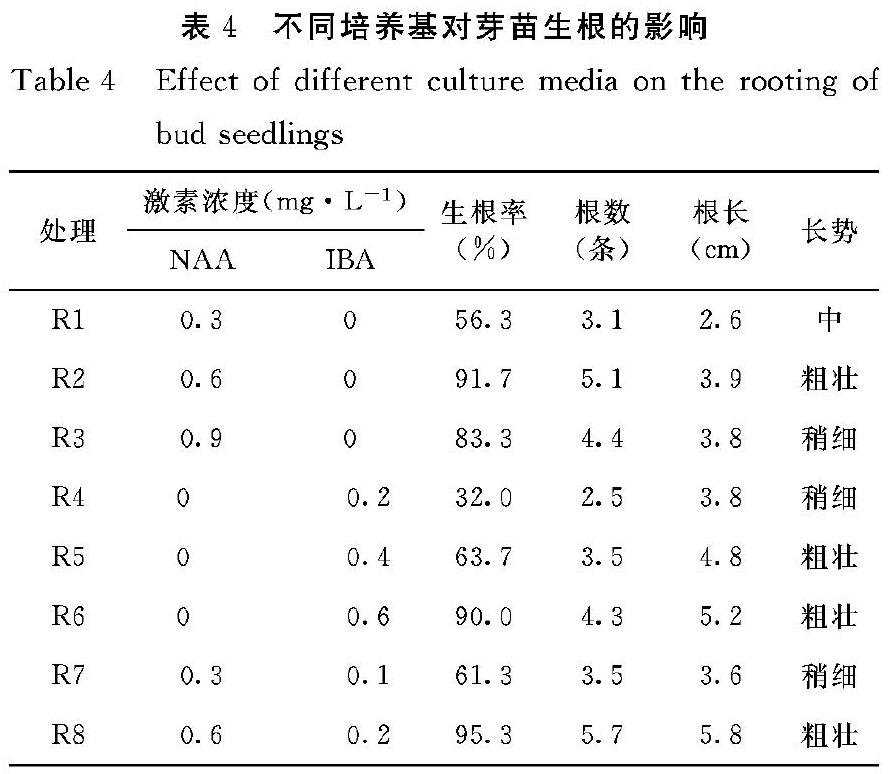
當不定芽長至30 d左右,長2~3 cm時,轉接到生根培養基中進行生根培養(表4)。
生根培養基加活性炭 0.8 g·L-1后,愈傷得到了很好的抑制,接種后基部基本沒有愈傷組織的形成,但生根較遲,直至接種15 d后,才陸續有根點出現。從表4可以看出,生根率隨著NAA濃度的增加有先升后降的趨勢,NAA濃度過低時,生根率偏低,根數偏少,根也較短,NAA濃度過高時,則會抑制根的形成。添加NAA和IBA培養基生出的根有較大差異,添加NAA培養基生出的根短而粗,添加IBA培養基生出的根細而長。NAA和IBA混合使用,則根系粗細長短較為適中。綜合而言,以處理R8培養基最好,生根率達到95.3%,根數達到5.7條,根長5.8 cm,根系發達,苗勢健壯。
3?結論與討論
掌葉覆盆子具有較高的藥用價值,是一種廣泛使用的傳統中藥材。作為藥食兼用的新型水果也得到社會的廣泛認可,進行人工栽培將產生可觀的經濟和社會效益[7]。但掌葉覆盆子長期野生生長,群體良莠不齊,扦插繁殖又較為困難,通過組織培養可在短期內對優良單株進行大量擴繁,是加快優良品種推廣進程的有效途徑。為此近年來國內對掌葉覆盆子的組培快繁做了相關研究,但隨著研究地域和品種的不同,得出的結論差異很大。劉計權[1]研究認為生根培養基中無須添加外源激素就能生根,孫長青[10]通過解剖學的研究認為覆盆子莖中無潛伏根原基,不易誘導生根,其他一些研究認為適當的培養基能誘導出不定芽、 不定根,但所使用外源激素的類型和濃度差異較大。通過對南平市農業科學研究所選育的掌葉覆盆子優良單株NS8進行組織培養研究,結果表明,利用掌葉覆盆子一年生莖段能誘導出不定芽、不定根,最佳誘導培養基為MS+6BA 1.5 mg·L-1+NAA 0.15 mg·L-1+GA3 0 mg·L-1,誘導率達到68%,芽苗健壯;最佳增殖培養基為MS+6BA 1.5 mg·L-1+NAA 0.1 mg·L-1,苗勢健壯,增殖系數達到4.87;最佳生根培養基為1/2MS+NAA 0.6 mg·L-1+IBA 0.2 mg·L-1+活性炭 0.8 g·L-1,生根率達到95.3%,生根數達到5.7條,根長達到5.8 cm,根系發達,苗勢健壯。
掌葉覆盆子屬藤本植物,其莖內無潛伏根原基存在,不易誘導生根[12],在誘導生根時可適當加大生長素濃度,最好NAA和IBA混合使用,同時要掌握好轉接時間,轉接苗太嫩或太老都會影響生根率。本研究初步認為,30~40 d是掌葉覆盆子轉接的最佳時期。
參考文獻:
[1]劉計權.應用組織培養對覆盆子快速繁殖的研究[J].中南藥學,2006,4(6):426-428.
[2]潘彬榮,羅天寬,張永鑫.掌葉覆盆子的組織培養技術[J].浙江農業科學,2010(3):508-510.
[3]丁新泉,劉敏超,閆翠香.我國第三代水果產業現狀與發展戰略[J].廣東農業科學,2013(19):206-209.
[4]江景勇,陳珍.掌葉覆盆子的研究進展[J].貴州農業科學,2015,43(10):173-176.
[5]陳炳華,劉劍秋.福建省懸鉤子屬藥用植物資源[J].中草藥,2001,32(6):551-554.
[6]朱嫦娟.掌葉覆盆子培育技術及開發利用途徑[J].現代農業科技,2015(23):94-95.
[7]潘彬榮.掌葉覆盆子優株的復選及繁殖示范推廣研究[J].安徽農業科學,2010,38(34):302-304.
[8]鄔梟楠.掌葉覆盆子山地種植技術[J].現代農業科技,2016(15):170-172.
[9]ZHU W J,XU S F,CH Y T.Research on Rapid Propagation and Domestication of Wild Raspberry Plantlets[J].Agricultural Science & Technology,2016,17(2):298-300.
[10]孫長清.掌葉覆盆子的繁殖生物學及中藥GAP研究[D].北京:中國農業大學,2005(6):1-40.
[11]王利平,陳珍,江景勇,等.優質掌葉覆盆子快繁體系的建立[J].浙江農業科學,2013(8):967-970.
[12]邵小明,孫長清.掌葉覆盆子枝插繁殖的研究[J].廣西植物,2008,28(6):816-818.
(責任編輯:柯文輝)

