胃癌組織中IFN-γ、IL-4和SOX-2蛋白表達及其與幽門螺桿菌感染的相關性分析
賈 坤,蘇建榮
首都醫科大學附屬北京友誼醫院臨床檢驗中心,北京 100050
除了目前已經明確的遺傳、環境及生物學機制外,胃癌的分子生物學發病機制成為近年來的研究熱點[1]。不同的腫瘤相關因子可通過影響上皮細胞分化和增殖過程來促進腫瘤的發展。隨著免疫組化技術的成熟,通過對病變組織中此類標志物的檢測,可于早期對胃癌的發生和進展進行預估和判斷[2]。γ-干擾素(interferon-γ,IFN-γ)和白細胞介素-4(interleukin-4,IL-4)是T淋巴細胞分泌的效應因子,能介導炎癥損傷和免疫逃逸;SOX-2(SRY-related HMG box gene 2)是具有代表性的干細胞轉錄因子,能調控正常細胞的發育和增殖,在多種惡性腫瘤中異常表達[3-5]。本研究分析了IFN-γ、IL-4和SOX-2在胃癌組織中的表達情況及其與HP感染的關系,以期為胃癌的診療提供新思路。
1 資料與方法
1.1 一般資料 選取我院病理科2018年5月至2019年5月收集的胃黏膜活檢樣本,包括胃癌樣本67例(胃癌組),胃炎樣本85例(胃炎組),胃潰瘍樣本73例(潰瘍組),均經臨床及病理確診。臨床診斷符合人民衛生出版社《外科學》第八版標準;病理樣本由兩名病理科主治醫師采用盲法得出結論。納入標準:年齡18~80歲;首次確診;留取樣本前未接受過抗腫瘤、抗炎及抗HP治療;患者本人簽署知情同意書。排除標準:胃癌非原發癌或已明確的遠處轉移;近期接受免疫制劑、激素、非甾體類藥物治療;合并自身免疫病,嚴重的心、肺、肝、腎功能不全;妊娠或哺乳期女性;臨床資料不完整者。胃炎組:男性49例、女性36例,年齡46~61歲,平均(53.7±5.6)歲。潰瘍組:男性43例、女性30例,年齡46~62歲,平均(54.9±6.2)歲。胃癌組:男性38例、女性29例,年齡50~62歲,平均(57.2±4.9)歲;TNM分期:Ⅰ期19例、Ⅱ期26例、Ⅲ期15例、Ⅳ期7例;病理分型:腺癌58例,印戎細胞癌9例。各組性別及年齡差異無統計學意義。
1.2 免疫組化檢測 石蠟包埋后切片,采用免疫組化鏈霉卵白素-生物素復合體法(SABC)染色,二氨基聯苯胺(DAB)顯色,對照組用PBS 代替一抗;高倍鏡下觀察拍照。SP及DAB試劑盒,IFN-γ、IL-4和SOX-2蛋白通用型二抗購自北京中杉金橋生物技術有限公司。相應染色步驟按說明書操作,結果由兩名病理科醫師采用盲法閱片,結論有分歧時請另一名病理科醫師閱片。IFN-γ、IL-4于胞質表達,SOX-2于細胞核表達。染色結果評分標準見表1,陽性細胞與著色強度評分的乘積≥3分為陽性,小于3分為陰性[3]。
a×b≥3分為陽性;a×b<3分為陰性
1.3 HP感染檢測 C-13呼氣試驗:于清晨空腹狀態下口服C-13尿酸,10 min后連續呼氣100~150 mL,采用紅外質譜檢測儀分析;檢測值-基線值>2.5為陽性,反之為陰性。組織學檢查:樣本經過甲醛固定、脫水、石蠟包埋、切片,Giemsa染色,1 000倍顯微鏡下觀察,樣本呈紫紅色為陽性,否則為陰性。C13呼氣及組織學檢測均為陽性,確診為HP感染[6]。
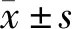
2 結 果
2.1 各組HP染色陽性率 結果(圖1)顯示:HP呈紫紅色,短桿狀,S型,以胃小凹處最多見,常呈魚群樣排列或聚集成團。胃炎組HP陽性率(91.8%,78/85)高于胃癌組(79.1,53/67)、潰瘍組(74.0%,54/73),差異有統計學意義(χ2=5.043、9.043,P<0.05);胃癌組與潰瘍組HP陽性率差異無統計學意義(χ2=0.511,P=0.475)。

圖1 Giemsa染色結果
Hp呈紫紅色,分布于胃小凹內,成團聚集
2.2 各組IFN-γ、IL-4及SOX-2蛋白表達及陽性率 結果(圖2)顯示:IFN-γ于胞質及胞膜表達,在胃癌組織中,免疫組化染色以棕黃色和褐色為主,呈強陽性表達,陽性細胞占比大;在胃炎及潰瘍組織中,染色以淡黃色為主,陽性細胞占比小。IL-4于胞質及胞膜表達,在胃癌組織中,呈淡黃色,陽性細胞占比小;在胃炎和潰瘍組織中,染色呈褐色,陽性細胞占比大。SOX-2于細胞核表達,在胃癌組織中,呈無色或淡黃色,陽性細胞占比小;在胃炎和潰瘍組織中,染色呈褐色,陽性細胞占比大。

圖2 免疫組化染色結果
A,B:IFN-γ在胃癌(A)及胃潰瘍組織(B)中的表達;C,D:IL-4在胃癌(C)及胃炎組織(D)中的表達;E,F:SOX-2在胃癌(E)及胃炎組織(F)中的表達
結果(表2)顯示:胃癌組IFN-γ蛋白陽性率高于胃炎組和潰瘍組,差異有統計學意義(P<0.05);胃癌組IL-4、SOX-2蛋白陽性率低于胃炎組和潰瘍組,差異有統計學意義(P<0.05)。
2.3 胃癌組織中IFN-γ、IL-4、SOX-2蛋白表達與HP感染相關性 Spearman秩相關分析(表3)顯示,胃癌組織IFN-γ和IL-4蛋白表達與HP感染無顯著相關性,SOX-2蛋白與HP感染明顯負相關(r=-0.732,P=0.007)。

表2 各組IFN-γ、IL-4和SOX-2蛋白表達陽性率比較 n(%)
IFN-γ:γ干擾素;IL-4:白細胞介素4;SOX-2:性別決定相關基因簇-2.*P<0.05與胃癌組相比

表3 胃癌組織IFN-γ、IL-4、SOX-2蛋白表達與HP感染相關性 n(%)
3 討 論
胃癌是世界上發病率和致死率較高的惡性腫瘤之一,其發生和發展涉及復雜的基因調控過程,且受環境因素影響。在早期無臨床癥狀的情況下,胃癌的檢出率很低,大部分患者因此錯過了最佳治療時機,這是胃癌患者生存率較低的主要原因。臨床上常通過檢測血清腫瘤標志物來進行胃癌的早期篩查,但靈敏度和特異度較低,應用價值有限。
HP感染是胃癌發病的主要生物學因素,感染HP的患者胃癌的發病風險是健康者的6~8倍,可能與以下機制有關[7-8]:(1)HP感染可觸發胃黏膜慢性炎癥損傷,導致細胞凋亡與增殖間的平衡被打破;(2)HP感染可引起周期調控蛋白異常表達,導致細胞增殖增加;(3)HP感染后在局部釋放細菌毒力因子,使端粒酶活性增加,誘發胃黏膜上皮細胞線粒體基因變異。但HP感染并非胃癌所特有,在慢性淺表性胃炎和胃潰瘍患者中HP的檢出率極高,甚至在正常人群中亦有30%~40%的感染率[9]。本研究顯示,胃炎組、潰瘍組和胃癌組HP陽性率分別為91.8%、74.0%和79.1%,胃炎組HP陽性率高于胃癌組和潰瘍組,差異有統計學意義(P<0.05),說明HP單獨檢測不能作為評價胃癌發生發展的指標。
隨著免疫組化技術的成熟,對病變組織中相關標志物表達水平的檢測可對腫瘤的發生、發展、治療反應性和預后進行評估。IFN-γ是Th1淋巴細胞分泌的主要效應因子。動物試驗[10]顯示,IFN-γ可介導慢性炎癥損傷,調控氧化應激反應,增加趨化因子對胃黏膜的浸潤程度,促進癌細胞基因異常擴增,增加上皮細胞惡變風險。IL-4由抗原或絲裂原刺激的CD4+T細胞產生,主要在穩定T淋巴細胞免疫、維持樹突狀細胞免疫提呈功能和增強免疫系統對腫瘤細胞的監視方面發揮重要作用[11]。SOX-2是決定胃黏膜上皮分化的重要轉錄因子,在早期胚胎發育和分子調控中扮演著重要角色,有學者將外源性SOX-2基因導入胃永生化細胞中,發現細胞周期明顯停滯、細胞凋亡增加,提示SOX-2在抑制細胞異常增殖方面發揮作用[12]。本研究采用免疫組化法對胃癌組織中的上述標志物的表達情況進行分析,發現IFN-γ蛋白在胃癌組織胃黏膜上皮細胞胞質中呈強陽性表達,陽性率高于胃炎組和潰瘍組,差異有統計學意義(P<0.05),IL-4和SOX-2蛋白分別在胃黏膜上皮細胞胞質和胞核中表達,胃癌組陽性率低于胃炎組和潰瘍組,差異有統計學意義(P<0.05)。提示這3種蛋白異常表達均參與了胃癌發病,其中IFN-γ蛋白表達異常升高可介導胃黏膜上皮持續的炎癥損傷,提高細胞癌基因的轉錄速度[13],IL-4蛋白表達下降使得免疫系統對腫瘤細胞的監視作用和自然殺傷性T細胞吞噬腫瘤細胞的能力降低[14]。SOX-2蛋白主要影響癌細胞的轉錄過程,其表達下降造成癌細胞轉錄上游的啟動子異常激活,加快癌細胞基因的擴增速度[12]。除此之外,本研究還分析了上述3種蛋白的表達與HP感染的相關性,證實HP感染與SOX-2蛋白表達呈顯著負相關關系(r=-0.732,P<0.05),而與IFN-γ、IL-4蛋白表達無明顯相關性(P<0.05),說明HP感染可能通過影響SOX-2蛋白表達促進胃癌發病。HP可使線粒體轉錄基因調控紊亂,影響胃黏膜上皮細胞癌基因的轉錄平衡,但不會對T淋巴細胞免疫的平衡產生影響[15],這可能是HP感染與干細胞標志物、轉錄因子SOX-2蛋白表達相關,而與th1/th2淋巴細胞效應因子IFN-γ、IL-4蛋白表達無關的原因。
綜上所述,組織IFN-γ蛋白表達上調,IL-4和SOX-2蛋白表達下調可參與胃癌的發生和發展,且HP感染可能通過影響SOX-2蛋白表達促進胃癌發生。

