手性農化產品的現狀
葉 萱 編譯
(上海市農藥研究所,上海 200032)
開發藥效高、田間用量低、選擇性增加、毒性低和環境安全、對使用者友好和經濟可行的創新農化產品與開發分子復雜度增加的化合物有關,因為已有優秀產品含有1個或多個不對稱中心結構。要實現這些宏偉目標的1個重要策略就是開發具有獨特特性的含有手性碳原子分子。許多外消旋化合物中,只有1個對映異構體具有生物活性,或1個對映異構體的活性顯著高于另一個。
對列入當前殺蟲劑抗性行動委員會(IRAC)、殺菌劑抗性行動委員會(FRAC)和除草劑抗性行動委員會(HRAC)作用機制分類表中的現代農化產品(殺蟲劑/殺螨劑/殺線蟲劑、殺菌劑和除草劑/安全劑)活性成分(2017年總數為 759個)的調查表明 227個(30%)化合物分子含有不對稱中心(圖1a)。
商業化手性農化產品中殺蟲劑、殺螨劑和殺線蟲劑占比最大(40.5%),其次為殺菌劑(34%),再為除草劑和安全劑(25.5%)(圖1b)。市場上大多數手性農化產品為外消旋體,其含有的2個對映異構體的量相等。
1 農業化學中的立體化學方法
雖然立體化學被越來越多地用于醫藥工業中藥物的設計,不同的文章和書也已對其市場和研究進行了綜述,但主要為過時的綜合文章,只有非常少的最近綜述對手性農化產品進行過介紹。
1.1 手性農化產品的重要性
在農化產品工業發展的最初階段,農化產品活性成分主要為無機化合物(1899年銅殺菌劑波爾多混合液)和真溶液(1892年,二硝甲酚即 2-甲基-4,6-二硝基酚)。后來,隨著多種類別產品的上市,手性化合物增加,以作用于鈉通道(擬除蟲菊酯殺蟲劑,93%為手性分子)或膜中甾醇生物合成(吡咯和嗎啉殺菌劑,77%為手性分子)的產品為例。

圖1 HRAC、FRAC和HRAC作用機制分類表中所有商業化農化產品中的手性產品的占比以及手性產品中不同類別的占比
今天,新穎的農化產品具有更復雜的分子結構,有一個或多個立體中心。新手性農化產品的許多先導化合物是在靶標驅動的篩選項目中發現的。此概念已影響了對手性細胞受體或結合蛋白有最佳擬合度的分子的設計。生物化學途徑、手性代謝物形成和配體-受體相互作用的知識的不斷增加支持著對最佳活性成分的發現。最后,先導化合物也可能在天然產品和動植物中發現,這是設計手性和對映異構體的巨大資源。
1.2 手性農化產品的制備
過去,工業規模選擇性制備對映異構體或分離對映異構體一般難度大、效率低、費用高。然而,近年,不對稱合成和催化已取得巨大進步,在現代農化產品的制備中已廣泛應用立體選擇性工藝。今天可用不同方法制備手性農化產品(合成或拆分外消旋物),并以高的分辨率和靈敏度進行分析(圖2 )。
圖2中方法I~V已用于工業規模高效生產手性農化產品。

圖2 制備手性農化產品的不同方法
1.2.1 立體異構體的分離
在手性拆分試劑中以結晶法誘導不對稱轉換在溴氰菊酯等數個擬除蟲菊酯殺蟲劑的生產中重要。對手性拆分試劑的主要要求為成本不太高,兩種對映異構形式易獲得,對映體過量值大。直接結晶在實踐中的局限性為在結晶過程中雜質增加。
1.2.2 手性構件的應用
手性池包含相對價低的可購買到的手性天然產品(碳水化合物、帖烯、生物堿、羥基和氨基酸),這些物質以兩種對映異構體形式存在且對映體過量百分率高。在最重要的手性構件中,蛋白和非蛋白(S)-氨基酸具有重要的地位,每年可商業得到10~105t。對于精噁唑禾草靈、精吡氟禾草靈和高效氟吡甲禾靈等芳氧苯氧丙酸類(AOPPs),只有(R)-對映異構體具有除草活性。因此,大多數工業策略為使用純對映異構體(S)-2-氯丙酸(或對外消旋物進行酶拆分和根據IV法進行生物轉化)。
1.2.3 催化不對稱合成
手性催化轉化和增強化學反應中的手性對現代農業化學重要。許多均相手性過度金屬催化劑可被用于工業規模生產工藝,如不對稱加氫、環氧化反應和雙羥化,不對稱環丙烷化或異構化(手性烯丙基胺前體到手性烯胺,例如以(R)-BINAP-Rh為催化劑)。重要的例子為在禾本科雜草除草劑(S)-異丙甲草胺(對映體過量百分比約 80%)的制備中把芳亞胺轉化為(S)-芳胺前體的均相對映選擇性催化加氫工藝(氫,Ir-josiphos催化劑)的開發。這是今天運行的最大催化不對稱轉化工藝(每年大于1萬t)。
1.2.4 酶和微生物轉化
許多大規模生物催化工藝已被開發用于生產(S)-氨基酸。在這些工業化應用路線中通過水解氨基酸酯而酶拆分氨基酸的過程重要。許多商業化應用的方法為對外消旋物進行拆分和從手性化合物前體開始的不對稱生物催化轉化。拆分反應的基本類型為外消旋物的酶拆分和不對稱(生物)催化。最近,蛋白系統已被描述用于對映選擇性環丙烷化、硅烷化和硼基化(borylation)等化學反應。典型的工業規模酶拆分的例子為酰基轉移酶、酰胺酶、乙內酰脲酶和 β-內酰胺水解酶介導生產(S)-纈氨酸、(S)-苯基丙氨酸或(S)-蛋氨酸等(S)-氨基酸。用工程化大腸桿菌的全細胞生物催化很有發展前景,具有大規模和低成本生產的潛力。本文中,外消旋物、乙內酰脲酶和氨甲酰酶即可進行動態生物催化拆分。
1.2.5 天然產物的發酵
一些次級代謝產物農化產品可通過發酵生產。不同16元大環內酯殺蟲劑如阿維菌素(阿維菌素B1a和B1b混合物,80∶20)和彌拜菌素B (彌拜菌素A3和 A4混合物,30∶70)可分別通過阿維鏈霉菌(Streptomyces avermitilis)和吸水鏈霉菌(Streptomyces hygroscopicus)大規模發酵制取。阿維菌素也是半合成埃維菌素的前體[4′′-表-(甲胺基)-4′′-脫氧埃維菌素B1a],埃維菌素的年生產量大于35 t。大環多殺菌素(是多殺菌素 A 和 D 的混合物)是由刺糖多胞菌(Saccharopolyspora spinosa)等放線菌產生。最近,半合成殺蟲劑乙基多殺菌素是對多殺菌素的L-鼠李糖部分進行特異性O-乙基化所得到。
制備手性農化產品的方法I~V的選擇取決于手性起始物池或高產率有效發酵產品的適宜菌系的可得性,這最終影響生產成本。
1.3 手性農化產品的監管
具有生物活性的立體異構體混合物的農化產品的風險評估復雜,因為每個立體異構體可能具有不同的理化特性和毒性。與非手性分子相比,外消旋農化產品的開發需要增加相當多的監管內容,因為必須對所有立體異構體進行環境和毒理研究。因為毒性也是酶反應的結果,手性農化產品常對植物、動物或人類呈現對映選擇性或立體選擇性毒性,如擬除蟲菊酯聯苯菊酯和芐氯菊酯,或1,2,4-三唑殺菌劑三唑酮。在生物化學轉換和毒性中這些選擇性概念是手性農化產品的源泉。然而,應用立體選擇性合成立體異構體可具有靶標選擇性和不希望的毒性。雖然有數種方法來評估手性農化產品的風險,但具體選用哪種方法取決于其區別不同異構體毒性的能力。美國環保局風險評估框架的綜述討論了在對手性農化產品進行風險評估時應該考慮的數個獨特問題。
⑴ 清楚地了解手性農化產品在靶標生物體內的立體化學效應(活性和無活性);⑵ 農化產品使用面積的程度是評估農藥代謝和吸附中對映選擇性的變化性的重要考慮因素;⑶ 建立對映選擇性分析方法來解釋監測數據和支持手性農化產品的登記,了解對映體互變的可能性;⑷ 手性農化產品的生態毒性測試策略,應該使用能夠評估農藥活性和無活性異構體毒性的方法;⑸ 對手性農化產品的暴露建模來預測對映特異性環境歸屬和生態毒性數據。
因此,了解手性農化產品的對映選擇性的變化對可靠的風險評估很重要。
1.4 過去10年中手性農化產品
在過去10年(2007-2017年)用作現代作物保護農藥的上市新產品(44個商業化產品)中約43%為手性物質(5個除草劑、9個殺菌劑、3個殺蟲劑、1個殺螨劑、1個殺線蟲劑),其中大多數為對映異構體外消旋混合物(47%),非對映異構體混合物(37%)或純對映異構體混合物(10.5%)(圖3a、b)。
此外,自從2015年以來,已發現手性農化產品(即2個除草劑和3個殺菌劑具有立體中心)的開發強勁增長(圖4),其增長趨勢將繼續。
但是,在近年為什么分子結構很復雜的手性農化產品的數量一直在增加?
本文分析了最近 10年中登陸全球作物保護市場的新一代手性農化產品,詳細介紹了一些代表性手性農藥,報道了具有立體中心分子對現代農業化學的貢獻。也介紹了對映異構體的生物活性和單個立體異構體的合成方法。

圖3 已知商業化農化產品(2007-2017)中手性產品的占比情況

圖4 在2007-2017年上市的非手性和手性農化產品
2 分 析
不同種類除草劑、殺菌劑、殺蟲劑/殺螨劑和殺線蟲劑列于表 1。表 1中的每個產品的對映異構體的立體化學組成(純、純對映異構體的混合物、對映異構體的外消旋混合物或非對映異構體混合物)和手性中心數量見圖3c,為以下分析的基礎。
3 手性除草劑
與除草劑抗性行動委員會作用機制分類表中所有商業化手性除草劑的25.5%占比相比,在過去10年此數值稍有增加(+0.5%,為 26%;圖 4c)。表 1列出了最新一代手性除草劑的除草劑抗性行動委員會作用機制類別和化學亞類。
在16個上市的除草劑中5個為手性分子,大多數具有一個立體中心(最多為3個),具有已知20多年的作用機制。它們包括作用于乙酰輔酶 A (CoA)羧化酶(ACCase)的代表物質噁唑酰草胺純的(R)-對映異構體,作用于纖維素生物合成的(1R,2S,3RS)-非對映異構體混合物的茚嗪氟草胺,作用于乙酰羥酸合成酶/乙酰乳酸合成酶和 4-對羥苯基丙酮酸雙加氧酶(4-HPPD)的2個非對映異構體的外消旋混合物——玉米除草劑氟吡草酮。在占比為26%的手性除草劑(圖3c)中,只有ACCase抑制劑噁唑酰草胺為純的對映異構體產品,其他所有產品為立體異構體混合物。

表1 2007-2017年上市的手性農化產品

續表
3.1 乙酰輔酶A羧化酶抑制劑
ACCase催化生物素依賴性酶乙酰輔酶A發生ATP依賴性羧化作用,形成丙二酰輔酶A。這個重要代謝酶對植物體內脂肪酸生物合成具有重要作用,已作為除草劑開發和雜草防除的引人注目的靶標25年多。
不同除草劑和除草劑前體類別例如烯己二酮類(DIMs)、苯基-吡唑啉酮(例如唑啉草酯)或(異質)芳氧苯氧丙酸類(AOPPs)抑制禾本科雜草質體中同質型(homomeric) ACCase的羧基轉移酶。自20世紀70年代以來,AOPPs已被很好地介紹過,第一部分成員為外消旋物,例如噁唑禾草靈(fenoxaprop-ethyl)。然而,所有(S)-對映異構體除草活性較弱,由于知識產權問題,一些產品以(R)-對映異構體豐富的活性成分再上市,后來氟吡甲禾靈(haloxyfop-methyl)和禾草靈(diclofop-methyl)以(R)-對映異構體上市。
這些(R)-構型的羧甲基酯除草劑前體在田間被植物葉吸收性增加,在植物活體內形成的羧酸(氟吡甲禾靈和禾草靈)(haloxyfop和 diclofop)為具有除草活性的代謝物。
酵母 ACCase復合體的羧基轉移酶與氟吡甲禾靈和禾草靈(haloxyfop和diclofop)(R)-對映異構體結合的晶體結構表明是代謝物結合于轉移酶二聚體的表面活性位點。
噁唑酰草胺的(R)-對映異構體為芽后ACCase抑制劑,能有效防除不同一年生敏感雜草,如水稻田中的稗草(Echinochloa crusgalli)。
通過對稗草葉綠體 ACCase的羧基轉移酶的活性位點 3D結構建模、分子對接和分子動態模擬研究發現噁唑酰草胺的抑制作用機制好像不同于其他ACCase抑制劑。令人驚訝的是,噁唑酰草胺不需要通過形成羧酸代謝物來激活。推斷噁唑酰草胺可能模擬生物素的作用使苯并噁唑環中的氮質子化,形成“噁唑酰草胺-H”,“噁唑酰草胺-H”中的氫結合于羧基轉移酶的活性位點而與不同區域相互作用。用1H-NMR已研究了在離體酸性條件下噁唑酰草胺的質子化。
用液相色譜質譜儀(LC-MS)已檢測到噁唑酰草胺在稗草體內的主要代謝物N-(2-氟苯基)-2-羥基-N-甲基丙酰胺。這表明分子中N-甲基丙酰胺部分與甲基酯相比具有水解穩定性。
3.2 纖維素生物合成抑制劑
腈類(氯硫酰草胺、敵草腈)、苯酰胺類(異噁酰草胺)、三唑羧基酰胺(氟胺草唑)和烷基三嗪類(三嗪氟草胺、茚嗪氟草胺) 4亞類的6個化合物為纖維素生物合成抑制劑(CBIs)。只有烷基三嗪類含有2個手性化合物。
三嗪氟草胺作為光依賴性光系統 II (PET)抑制劑,它的2個對映異構體幾乎具有相等的活性,但作為細胞分裂抑制劑,(R)-對映異構體的活性是(S)-的100倍。
對三嗪氟草胺分子的數個外消旋位點進行優化后,其作為纖維素生物合成抑制劑的除草活性提高了。引入含有第2個手性中心的雙環茚滿環系統顯著增加化合物的除草活性。
把2,6-二甲基氨基茚(2,6-dimethylindanylamino)和含有外消旋 1-氟乙基基團的氨基三嗪結合在一起可產生除草活性高的化合物。為了弄明白手性對除草活性的影響,對所有的8個立體異構體(1R,2R,6R)、(1R,2R,6S)、(1S,2S,6S)、(1S,2S,6R)、(1R,2S,6R)、(1R,2S,6S)、(1S,2R,6S)和(1S,2R,6R)進行分離,并測定它們的除草活性和作用機制。2,3-二氫-2,6-二甲基-1H-茚-1-胺(茚滿基)環系統的(1R,2S)-構型對除草活性和從抑制光合系統II轉變為抑制纖維素生物合成具有決定性作用。2個相對應的非對映異構體,主要成分(1R,2S,6R)和微量成分(1R,2S,6S)的含量比例為 95∶5,對纖維素生物合成有高的抑制活性,為茚嗪氟草胺的成分。
以(1R,2R)或(1S,2S)-構型茚滿環等取代茚嗪氟草胺茚滿環的(1R,2S)構型(圖 5)可以影響分子和靶標間的相互作用,例如(2R)-甲基團(圖 5a)或錯誤構型的(1S,2S)-茚滿環系統(圖5b)。、

圖5 茚嗪氟草胺的活性(1R,2S,6R)-立體異構體和弱活性立體異構體的疊置
熒光顯微鏡法證實茚嗪氟草胺處理后抑制植物的纖維素生物合成和引起根和細胞形態反常。茚嗪氟草胺增加了質膜上大纖維素合酶顆粒的密度,降低了粒子速度,抑制聚合反應。
已建立用對映選擇性途徑合成反式-(1R,2S)-茚滿胺,此合成途徑包括新穎的動態動力學拆分以及之后的親核取代反應。
作為最強創新烷基吡啶(alkykazine)除草劑,茚嗪氟草胺能夠防治對其他作用機制除草劑有抗性的禾本科和闊葉雜草(劑量約50~75 g/hm2)。其對單子葉雜草的活性增加,是長期防除多個侵入性冬季一年生禾本科雜草的新的替代性策略。到目前為止,還沒有發現此產品產生交互抗性。
3.3 乙酰羥酸合成酶/乙酰乳酸合酶抑制劑
支鏈氨基酸生物合成的第一步是在乙酰羥酸合成酶(AHAS),也稱為乙酰乳酸合酶(ALS)催化下進行。
外消旋pyrimisulfan對Exserohilum orzicola等禾本科、莎草和闊葉雜草具有廣譜和芽前除草活性,對移植和水植水稻有選擇性。此物質含有手性羥基取代中心和含有嘧啶部分的芳基。
用HPLC優化拆分外消旋pyrimisulfan后,分離了(S)-對映異構體。(R)-對映異構體在0.32 g/hm2對稗草的芽前防效最高,其次為外消旋體(70%~80%)、(S)-對映異構體無活性(0%)。
Pyrimisulfan在低劑量(50~75 g/hm2)對日本水稻田中的主要雜草有杰出活性,這些雜草在近年已成為嚴重問題。開發的pyrimisulfan控制-釋放制劑(如含有有效成分6.7 g/hm2的1 kg顆粒劑)以10 kg/hm2用于芽前到3葉期,能有效防除稗草屬多年生雜草和抗磺酰脲除草劑的雜草。
水稻田除草劑嗪吡嘧磺隆具有外消旋(5R,5S)-5,6-二氫-5-二氫-5-甲基-1,4,2-二嗪-3-基部分,已被市場化用于防除一年生[例如稗草、狼把草、丁香蓼(Ludwiga prostrate)、鴨舌草]和多年生(例如水莎草、Sagittara trifolia、野荸薺、螢藺)雜草。
3.4 選擇性手性開發候選除草劑
手性除草劑的開發繼續,如 4-HPPD作用機制的tolpyralate。
外消旋除草劑前體 tolpyralate防除許多禾本科和闊葉雜草,其對玉米具有優異的選擇性。該化合物作為側鏈上有1個立體中心的除草劑前體,在植物體內其手性碳酸鹽殘基裂解而形成非手性活性1H-吡唑除草劑(與1H-吡唑前體相同)。
4 殺菌劑
在最近 10年手性殺菌劑由原來的 34%強勁地增長為47%(圖3c)。表1列出了最近開發的手性殺菌劑的作用機制類別。最近10年開發的14個殺菌劑中的9個為手性分子,大多數有1個或多個立體中心。它們主要作用于呼吸鏈,以琥珀酸脫氫酶(SDH,復合體II)和細胞色素bc1(復合體III)為生化靶標。
4.1 殺菌琥珀酸脫氫酶抑制劑
在過去10年中,作用于SDH復合體II的手性殺菌劑的數量顯著增加。市場上有20個抑制SDH的殺菌劑,其中約35%具有1個或多個手性中心。吡唑-4-甲酰胺化學類別中手性化合物約占75%。大多數最近開發的抑制SDH殺菌劑對許多重要谷物作物病原菌有高的防效。它們的酰胺鏈接劑(amide linker)含有手性疏水性部分,如氟唑菌苯胺、吡唑萘菌胺、吡噻菌胺、氟唑環菌胺和苯并烯氟菌唑(表2)。
酰胺鏈接劑一般為苯基和噻吩基團(吡噻菌胺),它們被較大支鏈或雙環手性疏水部分在鄰位取代。好像酰胺鏈接劑和苯或噻吩環中手性鄰位取代的“疏水部分”間形成的角對 SDH抑制劑型殺菌劑的殺菌譜和活性大小重要。也許,此“脫芳構化”趨向于優化疏水部分。最近,討論了首次開發手性煙酰胺(含有噁唑啉的啶酰菌胺類似物)來發現新穎SDH抑制劑型殺菌劑。SDH酶(琥珀酸泛醌氧化還原酶)是由4個細胞核編碼的亞單元組成的線粒體異四聚體。SDHA和SDHB亞單元暴露于線粒體基質中,具有高度品種變化性的SDHC和SDHD為錨定SDHAB二聚體于線粒體膜的內在膜蛋白。用X-射線晶體學測定了大腸桿菌(細菌)、野豬和雞的 SDH的三維結構,得到了與羧酰胺殺菌劑的共晶體。在此基礎上,對小麥病原菌Zymoseptoria tritici進行同源建模和 SDH抑制劑對接研究。根據羧酰胺在zymoseptoria tritici泛醌-結合口袋里的結合機制,手性疏水取代物主要是與 SDHC(Ala84C, Leu85C,Val88C)和 SDHD(Ala126D)的氨基酸亞單元發生疏水相互作用。這些在暴露于線粒體內膜中脂的蛋白表面形成一個溝。在生物體系中手性重要的情況下,這個SDH靶標表面內陷的疏水溝對手性配體敏感。
商業化的抑制 SDH的吡唑-4-羧酰胺殺菌劑沒有1個對映異構體多的形式生產。目前市場上有對映異構體外消旋混合物(氟唑菌苯胺、吡噻菌胺)和具有2個(氟唑環菌胺、苯并烯氟菌唑)或3個手性中心(吡唑萘菌胺)非對映異構體混合物。

表2 從啶酰菌胺到SDHl殺菌劑的手性吡唑-4-基羧酰胺的結構過程
然而,對于氟唑菌苯胺和吡噻菌胺等,生物數據表明1個對映異構體比另一活性高(表3)。用手性硅膠相進行色譜純化得到對映體過量百分比為95%~99%的對映異構體。
推斷氟唑菌苯胺和吡噻菌胺(S)-對映異構體的較大活性與和 SDH的高度保守的泛醌結合位點的較大結合親和性有關。SDH抑制劑模擬天然配體泛醌的結合,(S)-對映異構體對真菌病原體中復合體II的偏愛與在手性結合口袋中泛醌鍵左捻(left-hand twist)有關。
吡唑萘菌胺為順式-和反式-異構體混合物,已被開發為防治香蕉生產中的葉斑病。
吡噻菌胺對白霉病(Sclerotinia sclerotiorum)、紋枯病(Rhizoctonia solani)和白絹病(Sclerotium rolfsii)等葉面和主要土傳病害有活性,對其他病害也有活性。
氟唑環菌胺已被開發為廣譜種子處理劑,對大豆、玉米和棉花等大范圍作物的種傳和土傳雪腐明梭孢(Monographella nivalis)、小麥雪腐病菌(Typhula incarnate)和絲核菌屬(Rhizoctoniaspp.)等真菌具有好的防治效果。
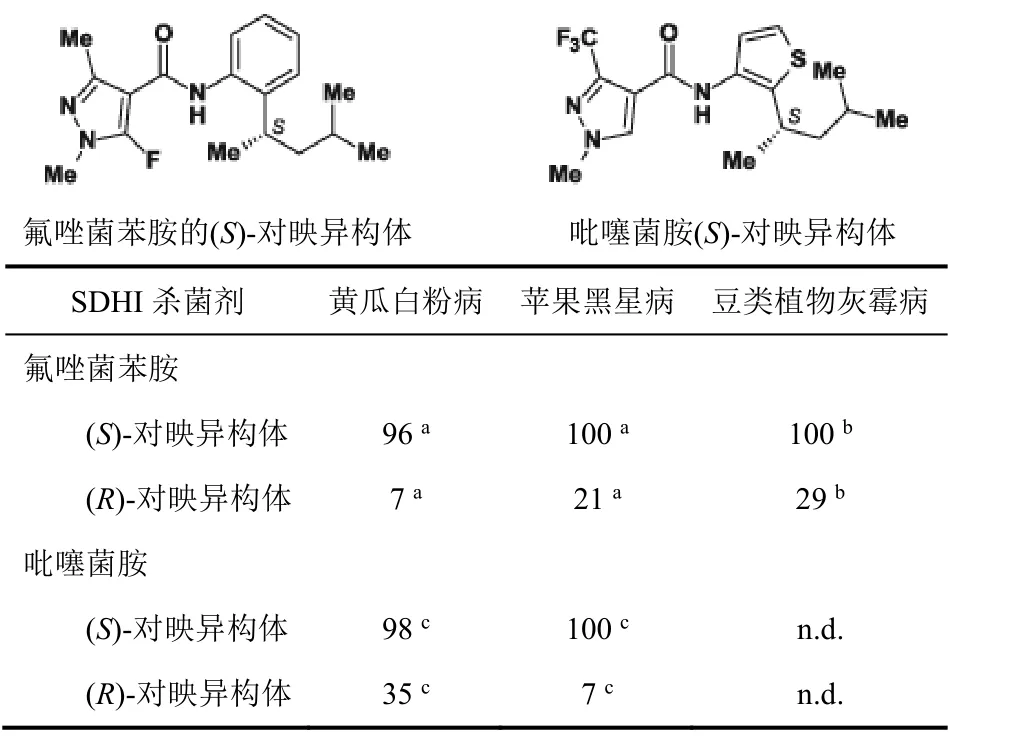
表3 分離的氟唑菌苯胺和吡噻菌胺的(S)-和(R)-對映異構體的殺菌活性對比
與吡唑萘菌胺相比,羧酰胺苯并烯氟菌唑分子中的立體中心數減少了,此化合物在9-位含有1個二氯亞甲基(=CCl2)。苯并烯氟菌唑是防治葉斑病(Z.tritici)等銹菌病原菌病害的廣譜殺菌劑,對大豆銹病(Phakopsora pachyrhizi)有優異的活性。
氟吡菌酰胺(R=H)的構效關系(SAR)表明[-H2C-CH2-]片段可接納甲基(R=Me)。這可能激勵了外消旋氟唑菌酰羥胺的開發,此物質含有[-MeHCCH2-]片段、另一N-甲氧基團和等排的3-二氟甲基-1-甲基吡唑和2,4,6-三氟苯基部分。
氟唑菌酰羥胺的(2S)-對映異構體和制備富含(2S)-異構體的物質的工藝可能申請了專利。
最近,在阿根廷,氟唑菌酰羥胺和苯醚甲環唑混合物被引入防治甜椒白粉病和番茄灰斑病等病害。
4.2 甲氧基丙烯酸酯Qol殺菌劑(醌外部抑制劑)
2個天然殺菌劑oudemansin A(真菌Oudemansiella mucida產生)和myxothiazole A(橙色粘球菌Myxococcus fulvus產生)含有典型的“甲氧基丙烯酸酯藥效團”和側鏈上有2個或3個立體中心,作用于呼吸鏈復合體 III/細胞色素 bc1。目前市場上有20個作用于此位點的合成甲氧基丙烯酸酯QoI殺菌劑。只有屬于3個不同化學類別的3個物質(15%)分子中有1個立體中心。
它們為外消旋噁唑菌酮(噁唑烷二酮)、(S)-咪唑菌酮(咪唑啉酮)和外消旋 mandestrobine,都具有甲氧基乙酰胺藥效團。好像新的(R,S)-2-甲氧基-N-甲基乙酰胺藥效團中立體中心的位置受到了 2個唑酮(azolone)類噁唑菌酮和(S)-咪唑菌酮的立體中心的影響。
以適宜的(R,S)-氰醇(乙醛和氰化鈉反應)為前體,引入Mandestrobin的藥效團(R=2,5-二甲基苯氧基)-甲基)于分子中(圖 6)。

圖6 以(R,S)-氰胺和(R,S)-2-羥基乙酰胺為前體合成mandestrobin的(R,S)-2-甲氧基-N-甲基乙酰胺藥效團
(R,S)-氰醇的腈官能基發生水解形成(R,S)-2-羥基-乙酰胺,之后雙甲基化(酰胺和羥基)生成mandestrobin。
4.3 氧化甾醇結合蛋白抑制劑
氟噻唑吡乙酮(oxathiapiprolin)(圖7)是對卵菌綱病原菌引起的病害有特別高的活性的新穎類別哌啶基噻唑異噁唑啉類殺菌劑的第一個成員。其抑制氧化甾醇結合蛋白,低劑量對葡萄、馬鈴薯和蔬菜病害有優異的預防、治療和殘留活性。
在氟噻唑吡乙酮前,發現了(5R,S)-對映異構體的外消旋混合物,合成了不同手性重要分子,并評估了它們的殺菌活性。例如制備了第二先導結構(1R)-N-[(1R)-1-苯乙基]-4-噻唑-甲酰胺,此物質具有1個吡唑乙酰胺部分(第一個先導物含有2-氯-苯基乙酰胺,圖7)。
雖然(1R)-對映異構體以10 mg/L對卵菌綱病原菌引起的病害有優異的預防和治療活性,但對應的(1S)-對映異構體活性低。在研究限制性構象的項目中,開發了手性中心區域附近的環化,例如把α-甲基(a)環化到苯基的羧基氧位置和(b)苯基鄰位。
在保持(1R)-構型的情況下,第一次修飾產生非活性分子;第二次修飾產生的(1R)-[1,2,3,4-四氫-1-萘基]酰胺的活性提高25倍多,其(1S)-對映異構體活性顯著低。令人驚奇的是,制備的苯甲基酰胺生物電子等排體外消旋(5R,S)-(4,5-二氫-5-苯基-3-異噁唑基)-2-噻唑基化合物在0.4 mg/L對卵菌綱病原菌病害有相似水平的預防和治療活性。在這種情況下發現,(5R)-對映異構體比相應的(5S)-對映異構體的活性高。4,5-二氫-異噁唑啉的SAR表明5-取代對高 殺菌活性重要,故進行了廣泛的取代研究。
進行二次5-取代后得到含有平面外扭曲的苯環的[5,5]-螺類似物,其活性約增加 5倍。也可以在(5R,S)-4,5-二氫-異噁唑啉的 5-位引入 2,6-二取代苯環產生此扭曲結構,生成殺菌活性增加500倍的第二先導結構,產生氟噻唑吡乙酮。
氟噻唑吡乙酮的(5R)-對映異構體比相對應的(5S)-對映異構體的活性高。不過,可以推斷上市外消旋產品的決定是基于其優異的活性和較低的生產成本,因為使用非手性起始化合物。
4.4 羧酸酰胺殺菌劑
羧酸酰胺包括非手性肉桂酸酰胺(烯酰嗎啉、氟嗎啉)、外消旋扁桃酸酰胺(例如雙炔酰菌胺)和手性纈氨酸酰胺氨基甲酸酯(benthiavalicarb, iprovalicarb和valifenalate)。
外消旋二肽valifenalate為纈氨酸酰胺氨基甲酸酯類最新成員,對疫霉屬、霜霉屬和Plamopara sp.等卵菌綱菌有活性。此產品可用于不同蔬菜和葡萄或馬鈴薯等其他作物。
可通過對(4S)-N-4-(1-甲基乙基)-2,5-二氧-3-噁唑烷羧基-1-甲基乙基酯中間體[從手性構件(S)-纈氨酸得到]的 5-環裂解和外消旋(R,S)-β-氨基-4-氯-苯丙酸甲基酯進行等制備此類殺菌劑。
作用機制研究表明這些殺菌劑通過直接作用于纖維素合酶 3 (CesA3)抑制纖維素的生物合成而作用于磷脂生物合成和細胞壁的沉積(FRAC F5)。
4.5 選擇性手性開發候選殺菌劑
不同作用機制的殺菌劑的開發例子說明了手性殺菌劑的開發繼續。
例如 UK-2A具有殺菌活性,是從放線菌屬(Streptomyces sp. 517-02)分離得到的天然代謝物。在1998年就介紹了UK-2A的合成。此發酵產品被用作前體,其 3-羥基-4-甲氧基-吡啶-2-基部分被 O-烷基化,得到1個新的手性和半合成的防治小麥和香蕉的主要真菌病原菌的吡啶酰胺殺菌劑fenpicoxamid。
Fenpicoxamid具有新穎的生化殺菌作用機制,用于谷物,抑制線粒體電子傳遞鏈中的線粒體復合體III,抑制Qi泛醌結合位點細胞色素c還原酶。對抗性釀酒酵母(Saccharomyces cerevisiae)的突變分析和分子對接研究表明UK-2A與antimycin A作用于相同位點。它強烈地抑制引起小麥葉枯病的真菌病原體Zymoseptoria tritici、小麥穎枯病病菌(Leptosphaeria nodorum)和水稻Pleomorphomonas oryzae等子囊菌綱真菌的離體生長(表4)。
殺菌劑前體fenpicoxamid在Zymoseptoria tritici活體內O-3-(異丁氧基)-甲氧基殘基裂開轉化為天然代謝物UK-2A,活性增加15倍。
Tolprocarb的(S)-對映異構體對水稻稻瘟病菌(Magnaporthe grisea)活性高,好像不同于傳統黑色素生物合成抑制劑。其制備基于商業化的手性構件(S)-纈氨酸和進一步的反應步驟能夠在立體中心沒有外消旋化下進行。

表4 fenpicoxamid和天然產品UK-2A對離體真菌生長的抑制作用
4.5.1 Tolprocarb離體抑制聚酮合酶活性
甾酮生物合成抑制劑特別是 36甾酮-C14-去甲基酶抑制劑是最重要的廣譜殺菌劑,約81%含有手性中心。其中沒有一個產品以富含1個對映異構體的產品或純的對映異構體上市,因為每一種立體異構體的作用(殺菌和植物生長調節作用)都是需要的。所有去甲基酶抑制劑抑制特異性細胞色素 P450酶,此酶能夠對農業病原菌的甾酮生物合成途徑中中間體C24-亞甲基二氫羊毛甾醇進行C14-氧化去甲基化。最近,新外消旋類二苯醚三唑(biphenyl ether-like triazole)殺菌劑mefentrifluconazole的登記在進行。
氟吡菌胺的(S)-對映異構體的活性是其外消旋物的2倍。因此,推斷手性開發的候選SDH抑制劑fluindapyr和inpyrfluxam有相似地特點,即(S)-對映異構體結合于真菌病原體復合體II (SDH)。
5 殺蟲劑
在過去的10年中,商業化手性殺蟲劑、殺螨劑和殺線蟲劑(圖 1b)的占比從 40.5%下降到 27%(圖3e)。表 1列出了最近開發的手性殺蟲劑(16%)的類別。3個上市的殺蟲劑為手性物質:2個為半合成天然產品乙基多殺菌素和雷皮菌素(lepimectin),1個為抑制昆蟲煙堿乙酰膽堿受體(nAChR)的 2個非對映體的外消旋混合物氟啶蟲胺腈(sulfoxaflor)。
5.1 煙堿乙酰膽堿受體競爭性調節劑
市場上11個nAChR競爭性調節劑型殺蟲劑中約27%為手性分子。
除了外消旋新煙堿類呋蟲胺和從煙草屬植物分離的生物堿(S)-煙堿外,最近開發的屬于新穎亞砜亞胺類殺蟲劑氟啶蟲胺腈全球上市,其為非對映體混合物。
呋蟲胺的(S)-(+)-對映異構體比(R)-(-)-對映異構體的活性高,這顯示在它們與海蝸牛(Aplysia californica)的乙酰膽堿結合蛋白(AChBP)的興奮劑結合口袋的結合位點的相互作用上。相反(S)-(+)對映異構體和外消旋呋蟲胺對 nAChR靶標位點幾乎有相同的親和性,殺蟲活性也幾乎相同。
氟啶蟲胺腈含有 2個手性中心(硫原子和與 3-三氟甲基-吡啶環相連的碳原子),由4個立體異構體(1S,2S)、(1S,2R)、(1R,2R)和(1R,2S)組成(圖 8)。

圖8 預測的氟啶蟲胺腈立體異構體的結合親和性
雖然氟啶蟲胺腈的4個立體異構體可用色譜分離,但單一異構體在溶解狀態下迅速轉化為非對映異構體對。因此,難以研究每個非對映異構體的結合親和性。然而,根據預測的結合親和性(Ki/nM),可以推測 4個異構體對氟啶蟲胺腈的活性都有貢獻。從野生型 nAChR的定量構效關系(QSAR)模型的立體異構體的結合位置可知,立體異構體間的主要差異來自2個手性中心甲基團的方向。好像1-位的手性中心比硫原子對氟啶蟲胺腈的結合親和性有更重要的影響。然而,因為氟啶蟲酰胺的對映異構體能夠轉化為非對映異構體,所以氟啶蟲酰胺以 4種非對映異構體的混合物市場化。
由計算預測到(1R,2R)-立體異構體以很強的作用結合于nAChR的活性位點。(1R,2S)-和(1S,2R)-立體異構體(圖8)的Ki與外消旋氟啶蟲胺腈的(Ki=265 nM)相差不是很多,而(1S,2S)-立體異構體只有弱的親合力(Ki=1318 nM)。基于這些結果和較低的結合親合力,桃蚜(Myzus persicaeR81T) nAChR的R81T突變對氟啶蟲胺腈的影響好像遠小于對所有新煙堿類殺蟲劑的。
5.2 煙堿乙酰膽堿受體變構調節劑
大環多殺菌素類多殺菌素(多殺菌素A和D的混合物)是 nAChR變構調節劑的第一個成員。從放射菌刺糖多孢菌(Saccharopolyspora spinosa)產生的此天然衍生發酵產品對許多鱗翅目昆蟲,以及雙翅目、薊馬、螨和螞蟻有殺蟲活性。
多殺菌素分子有3個手性結構,聚酮大環內酯四環、D-forosamine糖和三-O-烷基-L-鼠李糖,它們的相互作用對殺蟲活性重要。
第 2個成員為半合成殺蟲劑乙基多殺菌素(圖9),是用在QSAR分析中好像有應用前景的人工神經元網絡(ANN)策略在多殺菌素的 L-鼠李糖部分上進行特異性O-乙基化和合成化學衍生而來。
ANN建模預測表明 L-鼠李糖-3′-O-乙基化與 2′或 4′-O-乙基化相比使活性增加,這已通過試驗證實。對大環內酯四環修飾(來自于 ANN建模法)(L-鼠李糖-3′-O-乙基化)和 5,6-雙鍵的加氫(來自 QSAR)設計出乙基多殺菌素。為了使乙基多殺菌素的發酵式生產應用于實踐,通過高通量篩選項目發現了產生所需的 L-鼠李糖-3′-去甲基多殺菌素 J (和多殺菌素L)的改良的突變菌株(通過基因工程)。
從遺傳上來說,這些突變為編碼相對應的3′-O-轉甲基酶的spnK基因發生的單點突變。最后,對多殺菌素J進行特異性L-鼠李糖-3′-O-乙基化和5,6-雙鍵還原;而對于多殺菌素L由于其大環內酯四環6-位甲基的存在阻止了5,6-雙鍵的加氫,只進行了L-鼠李糖-3′-O-乙基化反應,由此對多殺菌素J (主要成分)和L (微量組分)進行進一步的半合成修飾。

圖9 以多殺菌素J和L為前體,進行L-鼠李糖-3′-O-乙基化制備半合成殺蟲劑乙基多殺菌素
5.3 谷氨酸門控氯離子通道競爭性調節劑
4個大環內酯類殺蟲劑阿維菌素、甲氨基阿維菌素苯甲酸鹽、彌拜霉素和雷皮菌素已作為谷氨酸門控氯離子通道(GluCl)競爭性調節劑商業化用于作物保護。發酵的埃維菌素和彌拜霉素家族不僅作為農化產品,而且在動物健康領域重要,以前已被介紹過。
雷皮菌素是S. hygrocopicus發酵物彌拜霉素B(A3和 A4內酯混合物)的半合成衍生物[13-位具有(Z)-[(甲氧基亞氨基)-苯乙酰基]氧殘基],因此也是2個大環內酯的混合物(R=6′-乙基的 A4內酯為主要成分,R=6′-甲基的 A3內酯為微量組分)。其具有廣譜殺蟲活性(雙翅目和鱗翅目害蟲、葉螨、卷蛾、薊馬和粉虱),可用于柑橘、葡萄、茶和蔬菜。
5.4 選擇性手性開發候選殺蟲劑
手性殺蟲劑的開發繼續,例如不同作用機制的3個例子。
非手性魚尼汀受體(RyR)調節劑例如氯蟲苯甲酰胺和溴氰蟲酰胺激勵著外消旋鄰甲酰氨基苯甲酰胺環溴蟲酰胺的合成和開發。(R,S)-1-環丙基乙基酰胺取代甲基酰胺基團得到新的專利分子。好像 RyR能與酰胺側鏈中的手性中心作用。
Fluxametamide是外消旋異噁唑啉殺蟲劑(包含順式/反式-異構體甲肟基團),對不同鱗翅目、纓尾目和雙翅目有高的殺蟲活性,也有殺螨活性(葉螨科)。雖然(S)-對映異構體更有效,但由于缺少經濟有效的不對稱技術,有可能在接下來幾年中,只能生產外消旋混合物。結構相關的商業化外消旋異噁唑啉殺體外寄生蟲藥afoxolaner、fluralaner、lotilaner和 sarolaner也都以外消旋物生產。Fluxametamide是新穎的配體門控氯離子拮抗劑,抑制 γ-氨基丁酸(GABA)門控氯離子通道和GluCls。
雙丙環蟲酯(afidopyropen)是昆蟲香草酸型瞬時受體電位通道的有效的特異性調節劑。其是煙曲霉(Aspergillus fumigatus)產生的天然產物 pyripyropen A的半合成衍生物。發酵產品pyripyropen A在堿性條件下分子中的立體中心不發生外消旋作用而發生O-脫乙酰基。在發生O-酰化作用后,2個羥基與環丙烷羰基氯發生 O-酰化反應,產生 afidopyropen。三-O-酰化副產物(R=環丙基羰基)易被循環用于生產O-脫酰化pyripyropen A。Afidopyropen對豌豆蚜等刺吸式害蟲有活性。
6 殺螨劑
以下為一個罕見事例,即外消旋殺螨劑前體在害蟲體內轉化為有毒性的非手性形式。外消旋β-酮腈丁氟螨酯(圖10)是殺螨劑前體,分子中有1個立體中心。混合物在活體內形成非手性丁氟螨酯烯醇代謝物后對葉螨和柑橘全爪螨(Panonychus citri)有高度選擇性。
丁氟螨酯在其2-甲氧基乙酯發生水解后,已知立體中心(α碳原子)發生自然(非酶作用)脫羧基,在葉螨體內易轉化為非手性殺螨活性的烯醇代謝物。丁氟螨酯在特別低的濃度能抑制復合體II中的線粒體電子傳遞。

圖10 外消旋丁氟螨酯在葉螨體內其2-甲氧基乙酯發生水解,再發生脫羧反應形成非手性烯醇代謝
外消旋丁氟螨酯在田間土壤中的消損具有對映異構體選擇性,因為(αR)-(+)-丁氟螨酯對映異構體易于降解[(αR)-(+)-和(αS)-(-)-丁氟螨酯的半衰期為12.2 和 13.6 d]。
7 殺線蟲劑
有機磷(OPs)被用于防治植物病害、昆蟲、線蟲和螨以及防除雜草。91個殺蟲乙酰膽堿酯酶(AChE)抑制劑(氨基甲酸酯、有機磷)中,約 26%物質具有手性中心。8%氨基甲酸酯為手性分子,約34%有機磷為手性化合物。已發現對映異構體對家蠅活性有差異,例如乙酰甲胺磷和甲胺磷;在所有的情況下,(R)-對映異構體活性最高。
這些類別的不同成員已被用作非揮發性殺螨劑多年。一些產品例如氨基甲酸酯殺線蟲劑涕滅威已退出了市場。AChE活性中心峽谷的功能結構具有一定剛度,對穩定催化三分子重要,具有一定構象柔性能夠與高親和性的AChR配體相互作用。
有機磷被認為是羧酸的類似物,特別是在酶反應中的過度狀態,也可能是生理磷的抗代謝物。AChE立體選擇性可能是差異化柔度或最優化的催化專一性活性中心的剛性環境變異小所致。
外消旋有機磷imicyafos對AChE有抑制活性,以新的觸殺性殺線蟲劑上市。此物質對根結線蟲、根腐線蟲和胞囊線蟲有活性,可用于果樹、包括馬鈴薯的蔬菜和其他果園或溫室作物。
8 結 論
手性農化產品和開發中的農化產品例表明農藥分子中的立體中心有重要的效果。在過去 10年中SDH抑制劑型殺菌劑的不斷增加的重要性以及對SDH靶標和配體的優先構型[氟唑菌苯胺和吡噻菌胺(S)-對映異構體活性高]知識的增加已導致含有手性鄰-取代“疏水”取代物的許多殺菌劑(5個外消旋產品)上市。Fluindapyr和inpyrfluxam,2個進一步外消旋SDH抑制劑候選物在不久的未來將上市。
盡管發現了以手性(R)-構型先導物結構開始的新的殺菌劑類別,但最后商業化產品氟噻唑吡乙酮為外消旋物。此外,殺蟲劑氟啶蟲胺腈含有2個不對稱中心,已以4個立體異構體的混合物上市,因為單個異構體能快速轉化為非對映體。
一些新手性農藥前體例如殺螨劑丁氟螨酯和除草劑 tolpyralate在螨體內或寄主植物中進行活體轉化,生成生物活性非手性農化產品。例如手性殺螨劑前體丁氟螨酯轉化為殺螨的非手性活性烯醇代謝物,此代謝物對葉螨有活性。選擇性手性開發的候選物tolpyralate在被植物代謝前,其含有的1個立體中心側鏈增加此物質在植物體內的生物利用度。
農化產品工業繼續搜尋具有生物活性和易得到的手性天然產品。用半合成方法選擇性結構修飾可能開發新的和創新手性農化產品,例如半合成殺蟲劑乙基多殺菌素和天然產品pyripyropen A衍生開發的 afidopyropen或開發的用于谷物防治病害的殺菌劑前體fenpicoxamid。
然而,手性分子的開發需要經濟有效的不對稱方法,故大部分手性農化產品也將主要以外消旋物生產,如選擇性手性開發候選物 pyrimisulfan(除草劑)、mefentrifluconazole(殺菌劑)或 fluxametamide(殺蟲劑)等。
未來,酶拆分以及不對稱(生物)催化等生物催化路徑的改進和進一步擴展,將會成為農業化學工業非常重要的問題。

