蘋果樹腐爛病菌染色質重塑因子Vmles4的功能研究
杜紅霞,聶嘉俊,馮雅瓊,劉建英,黃麗麗
(西北農林科技大學植物保護學院,旱區作物逆境生物學國家重點實驗室,陜西 楊凌 712100)
近年來蘋果產業在我國發展迅猛,其種植面積與總產量均位居世界第一,而蘋果樹腐爛病卻嚴重制約著蘋果產業的發展。該病是由Valsamali=Cytosporamali引起的一種真菌性病害,主要危害蘋果樹枝干,輕則樹枝樹干枯死,蘋果減產,重則造成絕產甚至毀園。因此深入揭示該病原菌的分子致病機理對病害高效防控意義重大。
真核生物的遺傳信息通常存儲在高度壓縮的染色質中,因此,染色質的結構在基因的表達調控中具有重要意義。真核生物在進化中產生的各類染色質重塑因子,利用ATP水解的能量對染色質基本結構核小體進行改裝,進而改變染色質結構參與對基因的調控[1]。染色質重塑因子根據功能域劃分為SWI/SNF、ISWI、CHD和INO80/SWR1[2]。INO80染色質重塑因子最早在釀酒酵母細胞中發現[3],由15種不同的亞基組成,能調控細胞內多個基因的表達,結合在INO80不同結構域上的不同亞基形成了3個主要的功能區:(1)N端調控功能區:包括亞基les1、les3、les5和Nhp10;(2)HSA功能區:包括亞基Arp4、Arp8和les4;(3)SNF2-ATPase功能區:包括AAA+ATPase(Rvb1和Rvb2)、Arp5、les2和les6亞基[4]。
INO80染色質重塑因子及其亞基參與多種細胞過程且功能多樣。如擬南芥INO80缺失突變體植株表現為弱化矮小且重量減少[5];醫學方面的研究發現,沉默肺癌細胞INO80、肺癌細胞的形成速率明顯下降[6],另外,癌細胞中敲除了INO80后發現部分基因的表達上調或下調[7],而酵母細胞中Nhp10亞基缺失導致INO80對DNA結合活性降低[8],缺失les3基因的酵母細胞端粒伸長并且位置發生改變[1],并且缺失INO80催化亞基或Arp5-Ies6核心亞基的酵母細胞基因組內15%的基因表達受到影響[9]。因此,揭示INO80及其亞基在腐爛病菌致病中的作用具有重要價值。本研究從V.mali全基因組數據[10]中鑒定到一個染色質重塑因子INO80亞基基因Vmles4,利用缺失突變體揭示該基因對病菌營養生長、致病力的影響,同時探索其對致病相關次級代謝合成酶基因VmNRPS12和VmNRPS14的影響,這將有助于進一步揭示染色質重塑因子在腐爛病菌致病中的功能。
1 材料和方法
1.1 材料與試劑
1.1.1 菌種來源 蘋果樹腐爛病菌(Valsamali=Cytosporamali)野生型分離菌株03-8,由西北農林科技大學植物保護學院果樹病害病原生物學及綜合防治研究團隊的研究室分離并保存;pFL2質粒(含有Trp合成基因neo,G418抗性),由西北農林科技大學許金榮教授惠贈。
1.1.2 致病性測定材料 蘋果樹葉片和枝條均為采自楊凌美庭快樂農場的富士品種,葉片為表面平整的初夏葉片,枝條為粗細均勻的1~2 a生枝條。
1.1.3 主要試劑 P505高保真酶(Phanta Max Super-Fidelity DNA Polymerase,諾維贊)、DNA膠回收試劑盒(Gel Extraction Kit D2500,OMEGA)、崩潰酶(Driselase,Sigma)、裂解酶(Lysing enzyme,Sigma)、Taq DNA聚合酶、定量Mix(Genstar)、G418(MP)、華越洋核酸提取試劑盒、反轉錄試劑盒(Thermo)及其他實驗室常規化學藥品和試劑,試驗中所需引物均委托上海生工生物工程股份有限公司進行合成。實驗用到的引物序列見表1。
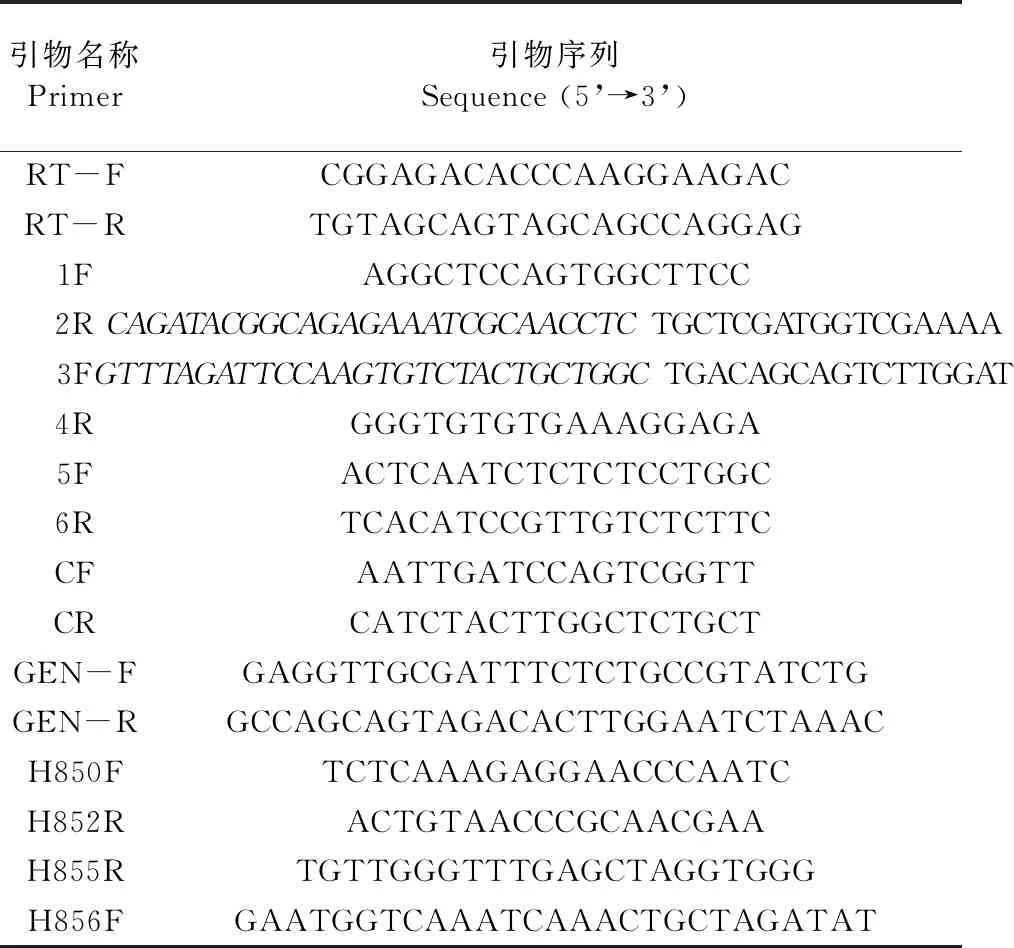
表1 本實驗所用引物
1.2 實驗方法
1.2.1Vmles4的侵染表達模式分析 將活化好的野生型菌株03-8的菌餅接種于健康的離體富士枝條上,取6、12、24、48、72 h 5個時間點的病健交界處皮層組織樣品,以純培養72 h的菌絲組織為對照,按照核酸提取試劑盒(華越洋)和反轉錄試劑盒(Thermo)說明書操作進行總RNA的提取并合成cDNA,反轉錄引物采用Oligod(T)18,以G6PDH為內參基因,用2-ΔΔCt法計算Vmles4相對表達量,每個反應3次平行重復,試驗重復3次后取均值。
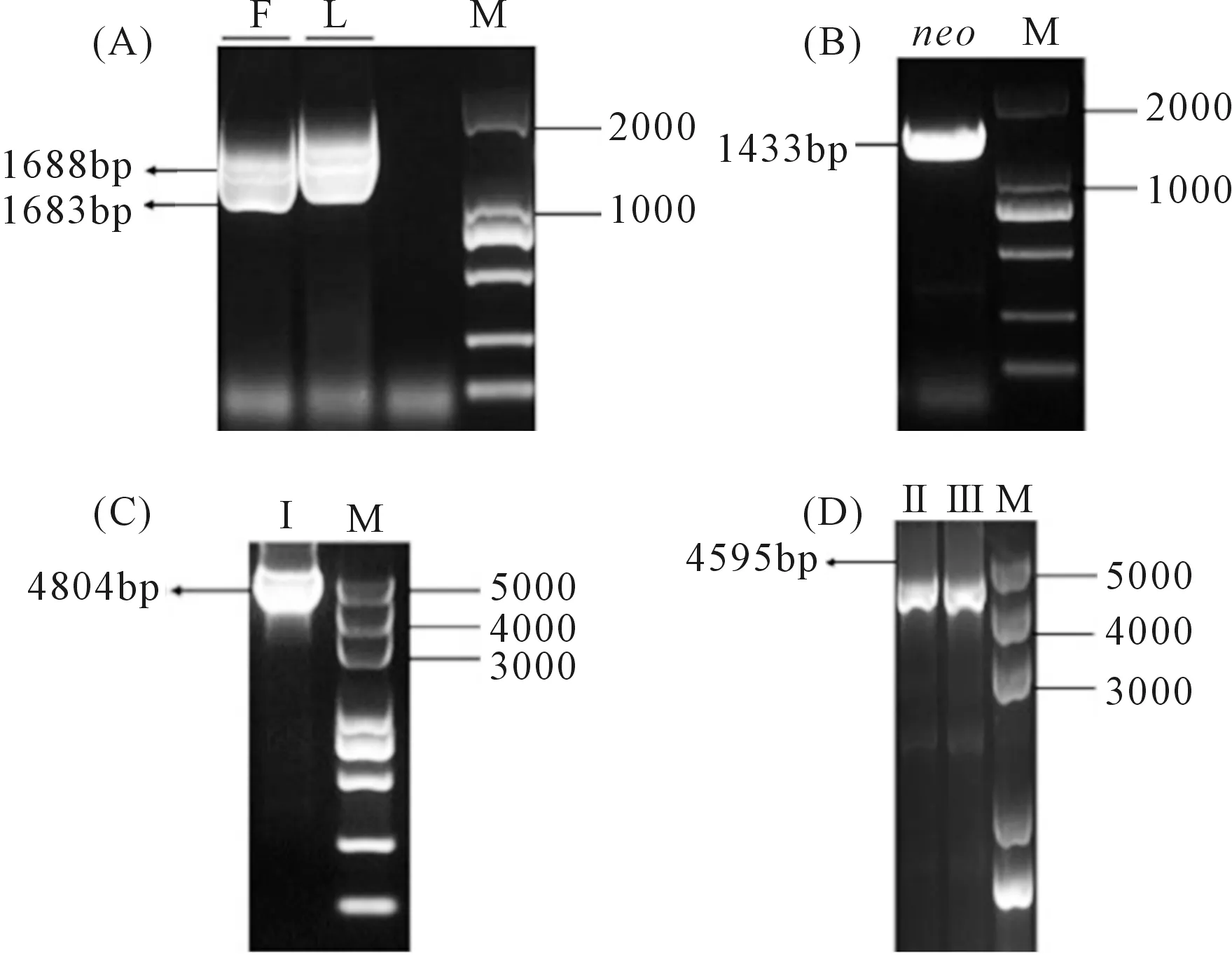
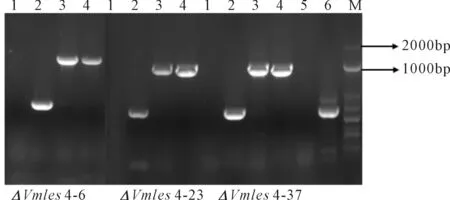
1.2.2 突變體的獲得 基于本實驗室前期的病菌全基因組測序分析結果得到目的基因序列,用Premier5.0軟件設計定量引物qRT-F/qRT-R,上游引物1F/2R,下游引物3F/4R,巢氏引物CF/CR,檢測引物5F/6R。其中引物2R和3F的5′端帶有同G418兩端同源的序列(斜體序列)。以蘋果樹腐爛病菌的基因組DNA(1 402 ng·μl-1)為模板,擴增目的基因的上下游片段,以pFL2質粒為模板,擴增neo基因片段,回收各個擴增片段,用Double-joint PCR三步法構建基因敲除載體,用PEG介導法將敲除載體導入原生質體中,含有200 μg·mL-1G418抗生素的PDA培養基培養皿篩選轉化子,提取其DNA,4對引物PCR檢測后得到3個陽性突變體,將其保存在20%的甘油中并于-20 ℃冰箱保存。
1.2.3 表型分析 活化好的野生型03-8及突變體菌株,用打孔器(d=5 mm)在菌落邊緣打菌餅,接種在含有12 ml PDA培養基的培養皿中央,25℃黑暗培養48 h后,觀察菌落的生長情況并用十字交叉法測量菌落的直徑,每組設置3個重復,試驗重復3次后取均值。
1.2.4 致病力測定 離體葉片接種參照韋潔玲等[11]的方法。葉片用自來水沖洗干凈后,用0.6%的次氯酸鈉(NaClO)溶液消毒5 min,用滅菌ddH2O水沖洗3次,每次5 min,一次性1 ml注射器針頭刺傷葉片正面制造傷口,用直徑為5 mm的打孔器在活化好的菌落邊緣打孔制成菌餅,再將菌餅接種在葉片正面的傷口上,以PDA為空白對照,滅菌的脫脂棉蘸纏于葉柄防止水分的散失,葉片置于托盤內25℃保濕培養,3~4 d后用十字交叉法測量葉片病斑的大小,每個菌株設置5個重復,試驗重復3次后取均值。離體枝條接種參照臧睿等[12]的方法。將枝條剪成10 cm左右的小段,自來水沖洗干凈,0.6%的次氯酸鈉溶液進行表面消毒15 min,用滅菌ddH2O水沖洗3次,待其晾干,融化的石蠟將枝條兩端封口,打孔器(d=5 mm)在枝條上破壞其韌皮組織打孔制造傷口,用打孔器(d=5 mm)將活化好的野生型及突變體菌株打菌餅,菌餅接種在枝條制造的傷口上,野生型菌株作為陽性對照,25 ℃保濕培養,7 d后測量并記錄枝條病斑縱向擴展長度,每個菌株設置6個重復,試驗重復3次后取均值。
1.2.5VmNRPS12及VmNRPS14表達量 參照1.2.1小節的方法枝條接種野生型03-8與突變體菌株ΔVmles4,取接種后24 h的樹皮組織(以純培養菌絲體為對照),提取RNA并合成cDNA,qRT-PCR檢測NRPS12及NRPS14基因的相對表達量,試驗重復3次后取均值。
2 結果與分析
2.1 侵染期Vmles4的表達分析
運用qRT-PCR技術分析Vmles4在不同時間的相對表達水平,結果如圖1,Vmles4在病菌接種6 h顯著上調表達,上調達6.2倍。說明該基因在蘋果樹腐爛病菌侵染前期發揮重要作用并且可能參與致病過程。
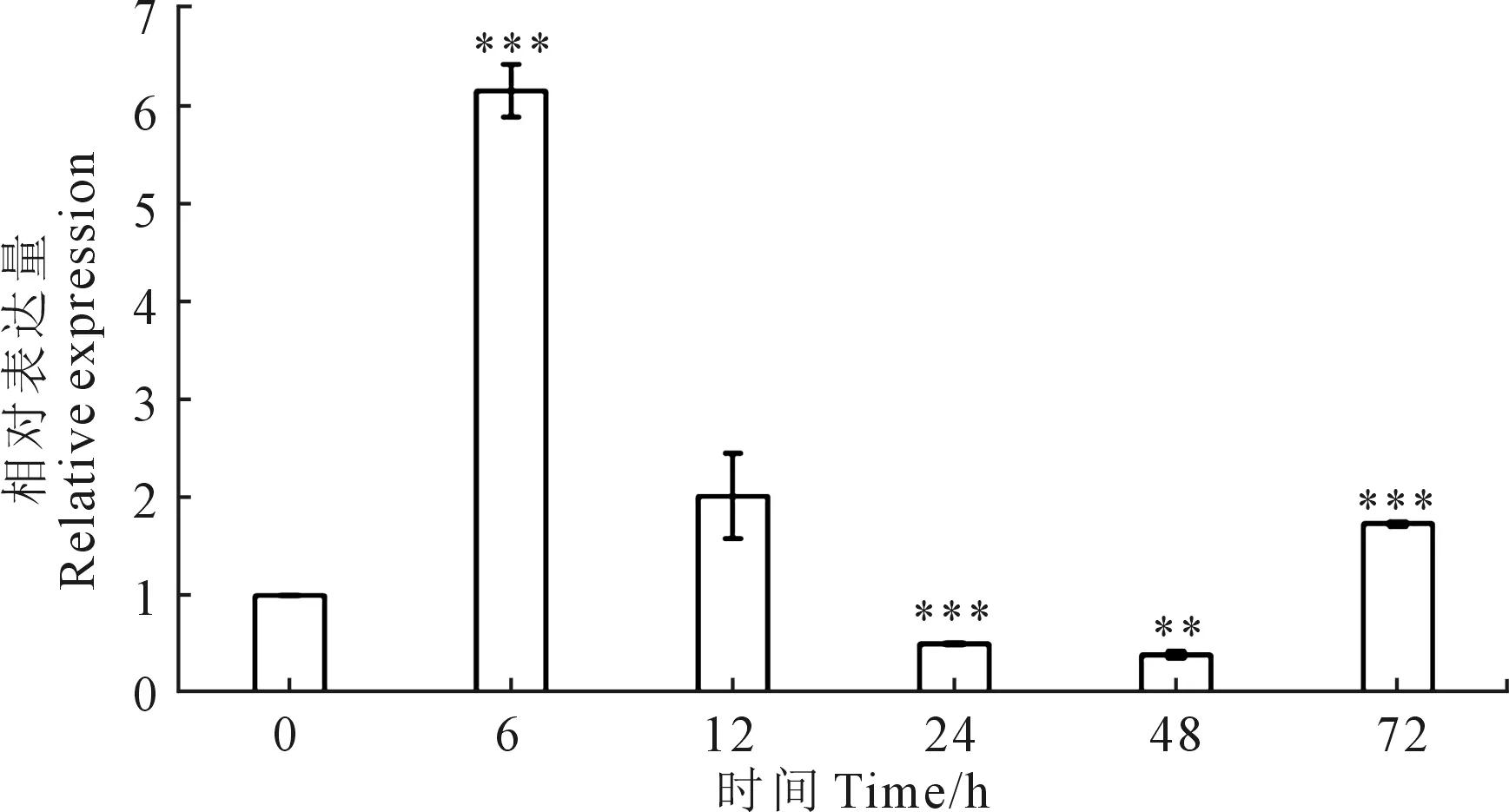
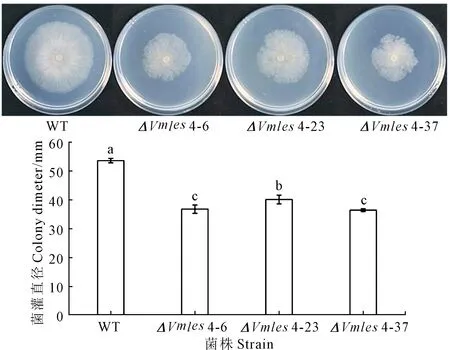
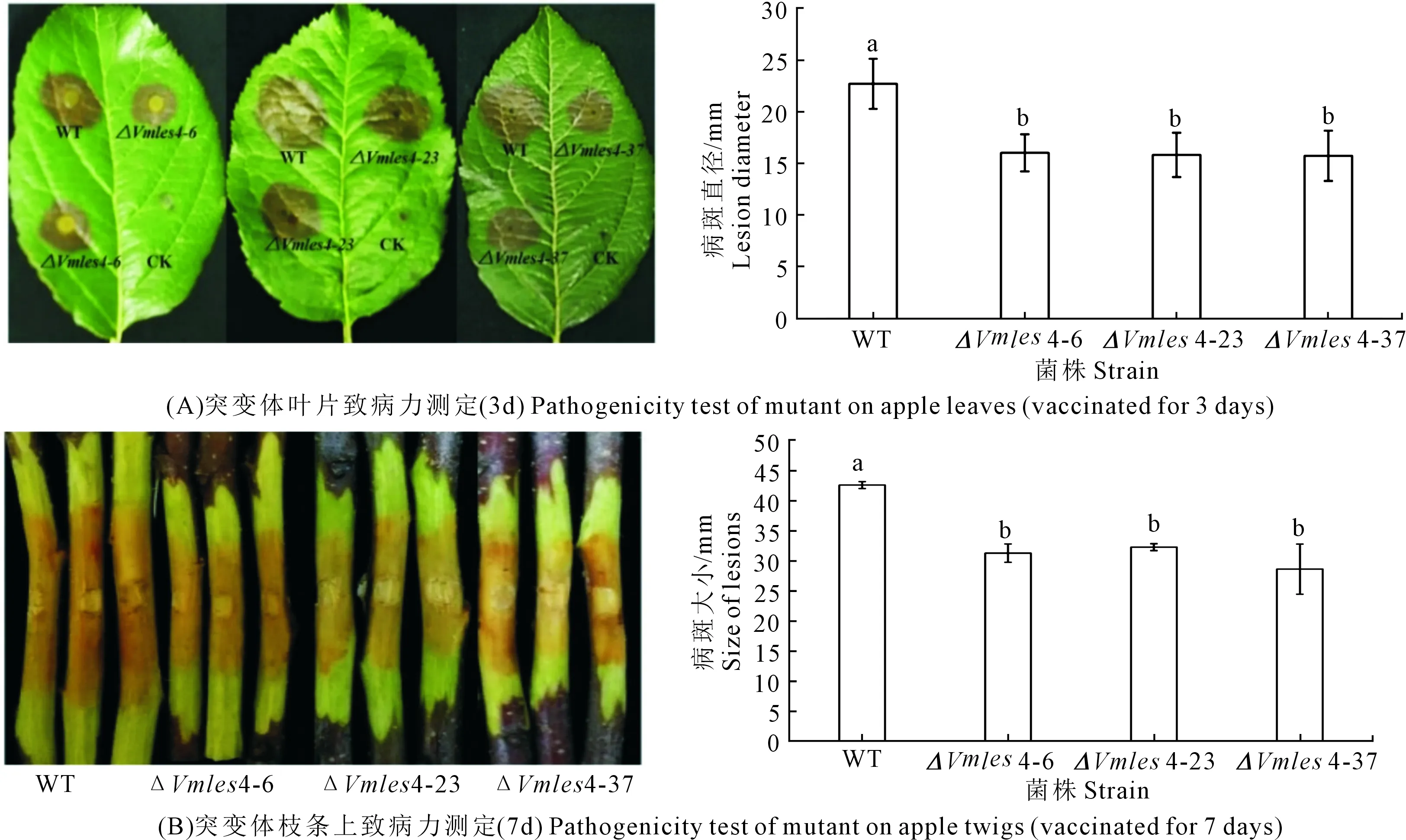
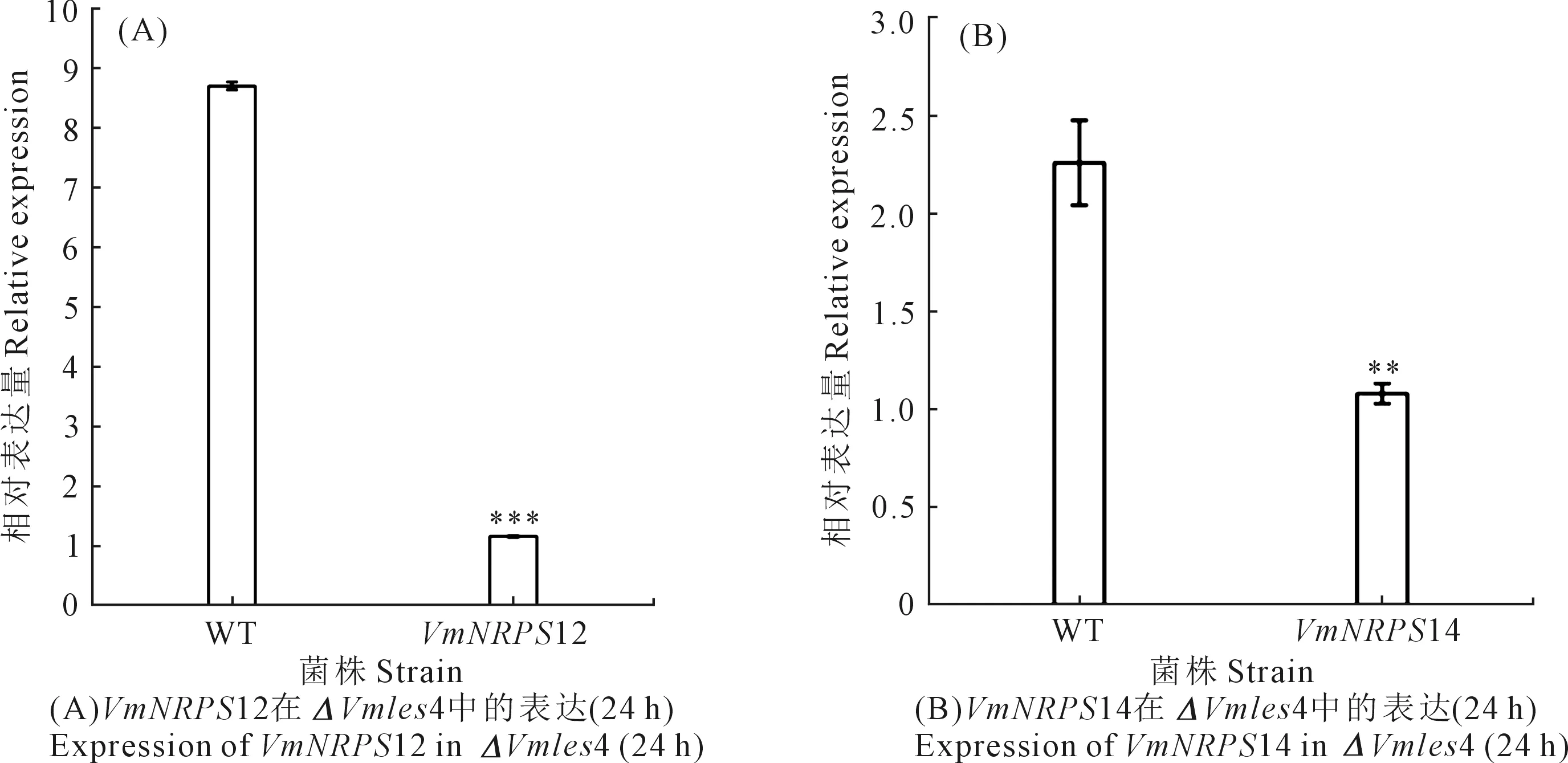
注:試驗重復3次,取平均值。利用SPSS 23.0分析差異顯著性。*表示顯著性差異(0.01 Vmles4上下游片段的擴增,片段大小分別為1683 bp和1688 bp(見圖2A);抗性基因neo片段擴增片段大小為1433 bp(圖2B);Double-joint PCR融合上游、下游和neo片段,片段大小為4804 bp(圖2C);CF/CR巢式PCR構建敲除載體,片段大小為4595 bp(圖2D);PEG介導的原生質轉化方法得到轉化子,用4對引物檢測后得到3個基因缺失突變體(圖3)。 注:(A):Vmles4上下游片段擴增; F:目標上游片段; L:目標下游片段; M:DL2000 marker;(B):neo基因擴增 M:DL2000 marker;(C)-(D):構建敲除載體 Ⅰ:Double-joint PCR融合基因片段; Ⅱ and Ⅲ:巢式PCR片段; M:DL5000。Note: (A):Amplification of upstream and downstream of Vmles4; F:target upstream; L:target downstream; M:DL2000 marker; (B):Amplification of neo cassette; M:DL2000 marker;(C)-(D):Construction of the knockout vector; Ⅰ:fusion fragment of double-joint PCR; Ⅱ and Ⅲ:nested PCR fragment; M:DL5000. 1:目的基因 The target gene;2:neo基因 neo cassette;3:上游片段 Upstream region;4:下游片段 Downstream region;5:陰性對照 Negative control;6:陽性對照 Positive control;M:DL2000 marker 在PDA培養基上生長48 h后,與野生型菌株03-8相比,Vmles4突變體菌落較白、菌絲較稀少,生長速率平均下降達28%,且生長不規則(圖4)。表明Vmles4基因影響菌落的形態和生長速率。 注:試驗重復3次,取平均值。利用SPSS23.0在P=0.05水平上分析差異顯著性。不同小寫字母表示兩者間存在顯著差異。下同。Note: The expriment was repeated three times and the mean value was taken. SPSS23.0 was used to analyze the difference at 0.05 level. Different lowcase letters indicate significant differences between the two strains. The same below. 與野生型03-8相比,Vmles4缺失突變體分別在離體葉片上病斑直徑平均下降22.5%,在枝條上病斑長度平均下降27%(圖5)。表明Vmles4基因的缺失使病原菌在葉片和枝條上的致病力下降。 圖5 野生型菌株03-8及突變體ΔVmles4的致病力測定及分析 VmNRPS12和VmNRPS14基因在野生型03-8及ΔVmles4菌株侵染樹皮24 h的qRT-PCR結果顯示(圖6),VmNRPS12和VmNRPS14在ΔVmles4菌株中的相對表達量均顯著低于野生型,分別下調86.5%和50%(圖6)。表明Vmles4正調控了基因VmNRPS12和VmNRPS14的表達。 圖6 VmNRPS12和VmNRPS14基因在野生型03-8和突變體ΔVmles4侵染枝條24 h的相對表達量 本研究就蘋果樹腐爛病菌染色質重塑因子INO80亞基Vmles4基因在V.mali中的功能進行了初步探究。Vmles4在接種離體蘋果樹枝條6 h后的相對表達量顯著上調;有文獻報道,真菌中一些起作用的致病基因在侵染初期會出現上調表達的情況[13],這與本研究對侵染期Vmles4表達模式分析結果相符,說明Vmles4是一類毒性基因,可能參與致病。與野生型03-8比較,3個敲除突變體的生長速率及其在葉片和枝條上的致病力均顯著下降,說明Vmles4基因確實參與了致病。對擬南芥染色質重塑因子核心亞基的研究發現,其參與了多種發育過程[14],且缺失INO80基因后,植株生長受到限制;INO80重塑因子的N端調控域與HAS功能區Arp4 Arp8 les4亞基結合后,改變亞基Arp8的構象,構象改變后的Arp8與核小體上的組蛋白結合緊緊抓住核小體,隨后亞基Arp5-les6將SNF2-ATPase功能區Rvb蛋白亞基募集過來[15],Rvb1和Rvb2亞基具有螺旋酶的活性[16],Rvb1和Rvb2與其他的亞基結合后,在超螺旋位置與核小體上的DNA結合,打開堿基,并阻止組蛋白H2A與DNA的接觸[17],將核小體上的DNA暴露出來,便于轉錄因子和RNA聚合酶等結合;INO80亞基間通過以上方式共同合作重塑染色質,來調控基因的表達。 本研究對致病基因VmNRPS12[17]及NRPS類相關基因VmNRPS14在INO80亞基Vmles4突變體中的相對表達量進行定量PCR,結果發現其表達能力顯著下降。酵母和Hela細胞INO80亞基缺失后,基因組內基因也出現上調或者下調表達的現象,與本研究中Vmles4缺失后,VmNRPS12和VmNRPS14基因的表達量出現下降相符。本研究中位于HAS功能區的亞基Vmles4基因缺失后,病菌的致病力顯著下降。有文獻報道,HAS功能區與核小體組蛋白及DNA的結合有關[18],Vmles4導致致病性下降的原因可能是Vmles4缺失后,致病基因的轉錄因子等無法與DNA結合,使得致病基因的表達下降,無法發揮毒性功能最終導致了致病力的降低。本研究只是初步探究了染色質重塑因子INO80亞基Vmles4基因的毒性功能及其對VmNRPS12及VmNRPS14表達的調控功能,然而蘋果樹腐爛病的致病是一個復雜的過程,INO80染色質重塑因子作為一類由多亞基組成的保守調控因子,各個亞基之間到底以怎樣的相互作用來影響V.mali的致病和調控能力將會是一個新的研究方向。2.2 敲除突變體的獲得
2.3 突變體的表型觀察
2.4 突變體致病力的測定
2.5 ΔVmles4對VmNRPS12及VmNRPS14表達量的影響
3 結論與討論

