沉默LIMK1抑制人胃癌MGC803細胞遷移與侵襲
(1.湖南省腫瘤細胞與分子病理學重點實驗室,湖南省胃癌研究中心,南華大學腫瘤研究所,湖南 衡陽 421001;2.株洲市中心醫院腫瘤科,湖南 株洲 412007)
胃癌是最常見的惡性腫瘤之一,據2018年報告,全球每年新發病例約100萬,死亡78.3萬,發生率與死亡率分別居于第五位與第三位[1]。我國是胃癌高發地區,發生率與死亡率僅次于肺癌而位于第二。由于胃癌患者就診時大多已經發生侵襲與轉移,治療效果較差[2-3]。從而,探討胃癌侵襲轉移機制與治療靶點是非常關鍵的問題。
LIM激酶(LIM kinase, LIMK)屬于絲氨酸/蘇氨酸蛋白激酶,LIMK家族有兩個成員,即LIMK1和LIMK2。LIMK通過磷酸化和失活肌動蛋白解聚因子調節肌動蛋白聚合,調控腫瘤細胞增殖、細胞周期、侵襲轉移等功能[4]。研究顯示,LIMK1在胃癌中高表達與腫瘤大小、淋巴結轉移及TNM分期有關。沉默LIMK1可抑制細胞增殖與遷移侵襲,并且,體內抑制腫瘤生長和腹膜轉移,表明lIMK1可用作胃癌治療的潛在靶點[5]。課題組人員前期工作證明,LIMK1在結腸癌中高表達,與腫瘤分化程度、腫瘤大小、淋巴結轉移、TNM分期及不良預后密切相關[6]。本研究采用miR干擾技術沉默LIMK1基因后,探討其對人胃癌MGC803細胞增殖、細胞周期與遷移侵襲的影響。
1 材料與方法
1.1 細胞培養
人胃癌MGC803細胞由本實驗室保存,于含10%小牛血清的RPMI1640培養基中,37 ℃,5%CO2、飽和濕度的培養箱內傳代培養。
1.2 主要試劑
LIMK1(ab39641)與β-actin(ab3280)抗體(Abcam公司)。Total RNA Kit(Omega公司),RT reagent kit(TaKaRa公司),PCR試劑盒(Promega公司)。BCA蛋白定量試劑盒(美國Pierce公司),ECL發光檢測試劑盒(北京中杉金橋生物技術有限公司),pcDNATM6.2-GW/EmGFpmiR干擾質粒、LipofectamineTM2000、殺稻瘟菌素(invitrogen公司)。質粒抽提試劑盒與壯觀霉素(Sigma公司)。Transwell小室(Corning公司),Matrigel(BD公司)。小牛血清(杭州四季青生物工程公司),RPMI-1640培養基(Gibco公司)。
1.3 構建穩定LIMK1基因沉默的MGC803細胞
1.3.1 構建miR-LIMK1干擾質粒 根據LIMK1(Genebank accession number:NM_002314.2)基因序列設計并合成4對miRNA oligomers,構建pcDNATM6.2-GW/EmGFpmiR-LIMK1干擾質粒,miRNA oligomers設計、干擾質粒構建和測序由invitrogen公司完成。見表1。

表1 miRNA oligomers序列
1.3.2 抽提重組質粒 在LB固體培養基上(加壯觀霉素50 μg/mL)劃菌,用10 μm Tip頭挑選單個散在的菌落,洗脫于4~5 mL的含壯觀霉素50 μg/mL的LB液體培養基,37 ℃恒溫、轉速為220-235,轉搖菌14-16 h。根據質粒抽提試劑盒步驟提取質粒。
1.3.3 LIMK1-miRNA/MGC803轉染株的篩選 人胃癌MGC803細胞1×105/mL接種于24孔培養板,37 ℃、5%CO2培養24 h。將0.8 μg的質粒(4個miR-LIMK1干擾質粒與陰性干擾質粒)加入無血清opti-MEM培養基中,最終體積為50 μm(A液)。取2 μm LipofectamineTM2 000加入48 μm無血清opti-MEM的EP管內,輕輕搖勻,放置3~5 min(B液)。將A液與B液混勻,得混合液C,放置20 min。培養箱中取出24孔培養板,棄去培養液,PBS洗2-3次,opti-MEM培養液洗2-3次,加入400 μm的無血清opti-MEM培養液。將100 μm混合液C加到24孔培養板孔內,輕搖培養板使之混勻。將培養板放回37 ℃、5%CO2培養箱培養4~6 h,將無血清opti-MEM培養液更換為10%胎牛opti-MEM培養液。48 h后將24孔培養板孔內細胞以1∶10比例傳代。24 h后換成2.5 μm殺稻瘟菌素+500 μm培養基/每孔,篩選陽性克隆,每3天換液一次,2周后可見陽性克隆,倒置熒光顯微鏡下觀察,可見細胞發綠色熒光。10 μm Tip頭挑取綠色熒光的陽性單克隆細胞至24孔板,待形成陽性單克隆細胞后再挑取至24孔板,反復3-4次,最后移入培養瓶培養并凍存。
1.4 RT-PCR
RNA試劑盒提取細胞總RNA,AMV酶作用下逆轉錄合成cDNA。見表2。PCR反應條件:94 ℃,5 min;94 ℃,40 s,Tm,45 s,72 ℃ 1 min 20 s,28個循環;72 ℃ 10 min。5 μL的PCR產物經1%的瓊脂糖電泳,溴化乙錠染色,IS1000圖像分析軟件讀取條帶灰度值,相對值以LIMK1與β-actin灰度值之比表示。
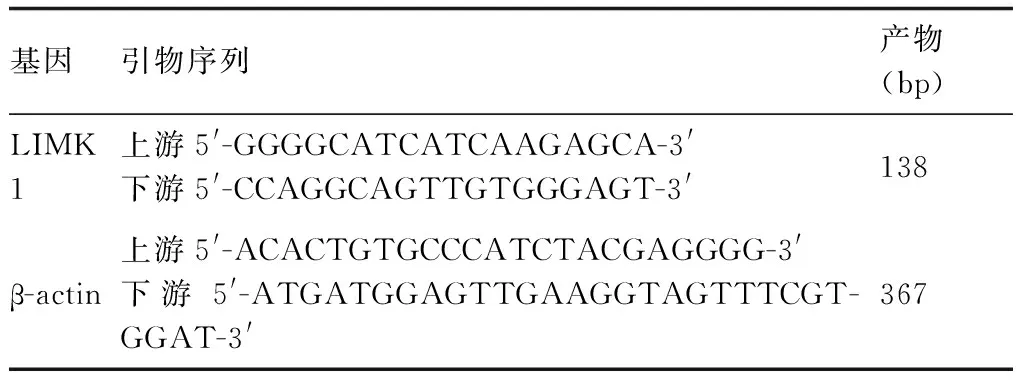
表2 PCR引物序列
1.5 Western Blot
收集細胞,提取細胞總蛋白,BCA法測定蛋白濃度,每組取等量樣本進行SDS-PAGE凝膠電泳,電泳后轉膜,封閉1 h,加一抗,4 ℃過夜,TBST洗膜,加二抗孵育1 h,洗膜,采用ECL發光法,最后X片曝光、顯影、定影。
1.6 MTT檢測細胞增殖
取對數生長期各組MGC803細胞,接種到96孔板,每組設置6個復孔,細胞貼壁4~6 h后進行常規培養;更換細胞培養基為150 μL RPMI-1640完全細胞培養基,加20 μL 5 mg/mL MTT溶液,培養4 h;終止培養,吸棄孔內培養上清液,加150 μL DMSO溶液,搖床上常溫平搖10~15 min,使結晶物充分溶解,酶聯免疫檢測儀測量各孔在OD570nm處的吸光值;最后計算細胞增殖抑制率,細胞增殖抑制率=(1-實驗組OD570值/對照組OD570)×100%。
1.7 流式細胞術檢測
取對數生長期各組MGC803細胞,1 000 r/min離心5 min,收集細胞,預冷PBS吹打重懸,離心沉淀,重復一次。4 ℃預冷的75%乙醇固定細胞,冰盒送檢。樣本上機前離心洗滌,棄上清,加1 g/L碘化丙啶50 μL,振蕩混勻,避光置冰箱30 min,上機檢測時300目尼龍網濾過,計數10 000個細胞,進行細胞周期分析。
1.8 劃痕實驗
調整細胞濃度為1×106/mL,吸1 mL細胞懸液接種于6孔板,每組3個平行樣本。RPMI 1640培養液37 ℃、5%CO2培養,直至形成細胞單層。用10 μL Eppendorf Tip在細胞板上劃痕,無血清培養液洗3次,加新鮮的無血清培養基。顯微鏡下測量劃痕區相對距離,實驗重復3次。
1.9 侵襲實驗
將基質膠稀釋液鋪置在Transwell小室中,100 μL細胞接種至小室上腔,取500 μL含10%胎牛血清培養液添加至下腔,37 ℃、5%CO2培養36 h后取出,擦棄小室上層細胞并用4%多聚甲醛固定10 min,0.1%結晶祡染色,PBS液洗滌,晾干。顯微鏡下隨機選取4個高倍視野進行細胞計數,取平均值。每組細胞設3個復孔。
1.10 統計學處理
采用統計學軟件SPSS13.0對數據進行統計分析:實驗重復3次,所得數據采用均數±標準差,組間區別用t檢驗分析,P<0.05為差異有統計學意義。
2 結 果
2.1 LIMK1 pcDNATM 6.2-GW/EmGFP-miR質粒構建、抽提與篩選轉染
構建人LIMK1-microRNA重組質粒pcDNATM6.2-GW/EmGFPmiR,測序結果與設計序列完全相符(圖1A)。negative-miR與LIMK1-miR 1-4質粒載體的甘油菌液中提取質粒,4 μL 1%瓊脂糖凝膠電泳(圖1B)。將重組質粒轉染MGC803細胞24 h后,倒置熒光顯微鏡可見綠色熒光。加殺稻瘟菌素篩選2周后,可見陽性克隆細胞(圖1C),挑選克隆細胞加低劑量殺稻瘟菌素繼續培養(圖1D)。
2.2 RT-PCR與Western blot檢測轉染后LIMK1 mRNA與蛋白的變化
圖2顯示,轉染LIMK1-miR后,LIMK1 mRNA表達明顯下降,并以LIMK1-miR 4干擾效率最好(P<0.05)。LIMK1-miR1-4細胞較未轉染組LIMK1表達分別下降30%、28%、72%、75%,LIMK1-miR4組最明顯(P<0.05),陰性轉染組與未轉染組間差異無顯著性(P>0.05)。根據RT-PCR與Western blot結果,LIMK1-miR4細胞作為后續實驗。
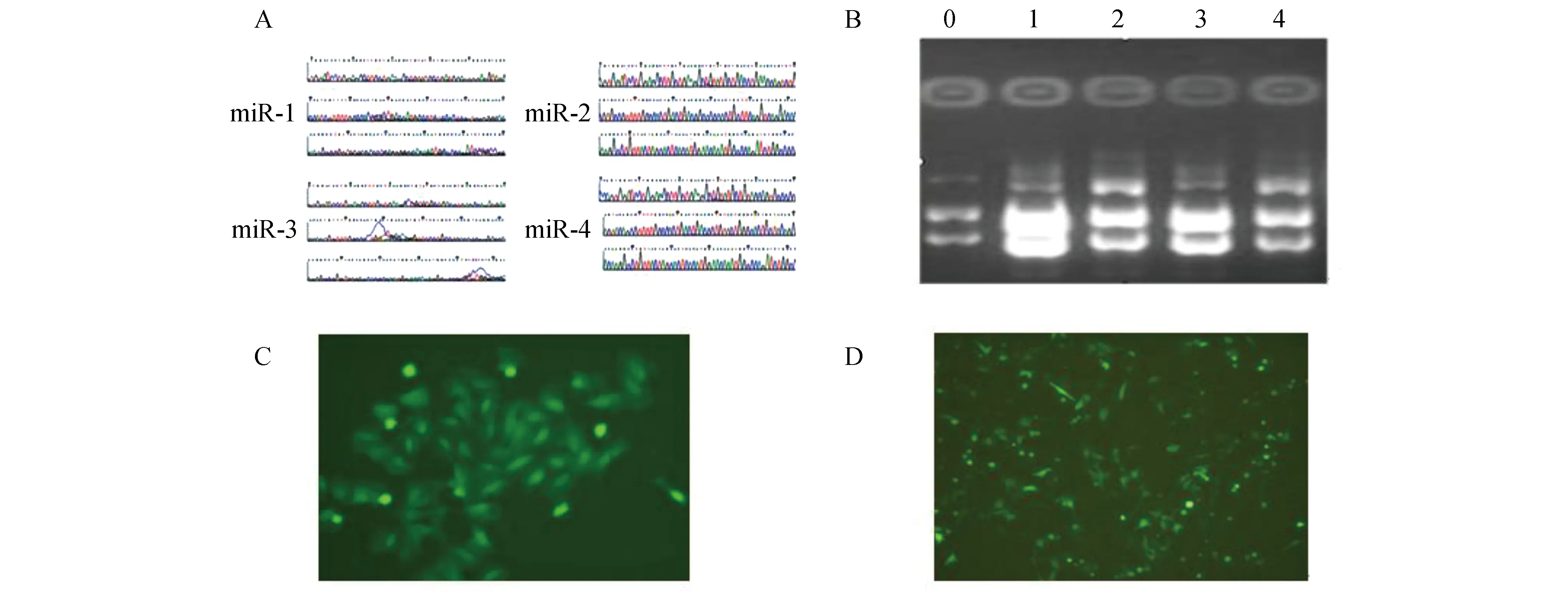
圖1 穩定低表達LIMK1基因細胞系的建立A:重組質粒測序圖; B:干擾質粒的抽提.0:negative-miR;1:LIMK1-miR 4; 2:LIMK1-miR 3; 3:LIMK1-miR 2;4:LIMK1-miR 1; C:熒光顯微鏡檢測殺稻瘟菌素篩選后的陽性細胞克隆; D:熒光顯微鏡檢測陽性細胞克隆擴增培養
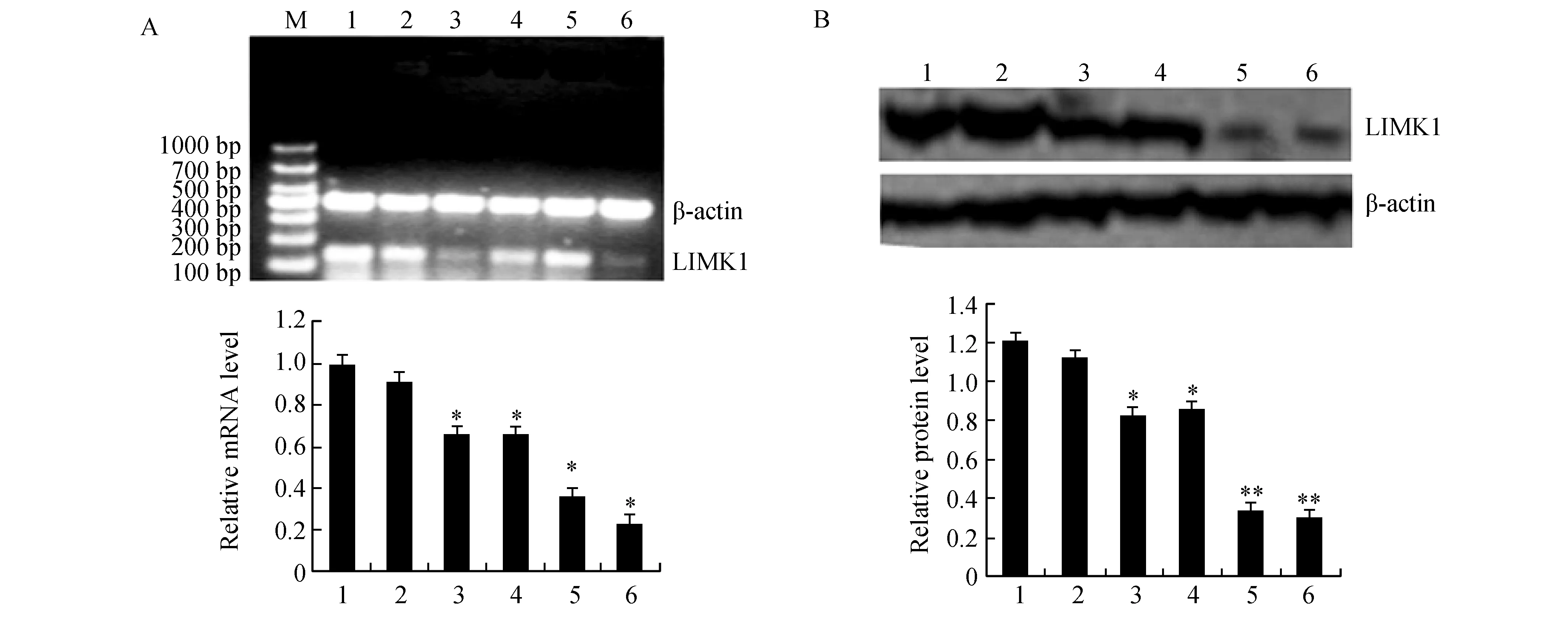
圖2 RT-PCR與Western blot檢測各組LIMK1 mRNA與蛋白的表達情況A:RT-PCR; B: Western blot. M: mark; 1:MGC803; 2: negative-miR; 3: LIMK1-miR1; 4: LIMK1-miR2; 5: LIMK1-miR3; 6: LIMK1-miR4與MGC803和Vector比較,*P<0.05;與LIMK1-miR1和LIMK1-miR2比較,**P<0.05
2.3 沉默LIMK1對MGC803細胞增殖及周期的影響
表3所示,LIMK1沉默組細胞在24、48、72、96 h分別較對照組與空載體組的抑制率為61.0%、36.9%、12.1%、1.6%和54.7%、46.2%、13.5%、1.5%(P<0.05)。表明沉默LIMK1可呈時間依賴性抑制MGC803細胞增殖。圖3與表4所示,LIMK1沉默組G2/M期17.96%明顯高于MGC803組11.45%和空載體組11.68%(P<0.05)。表明沉默LIMK1可阻滯MGC803細胞G2/M期的作用。
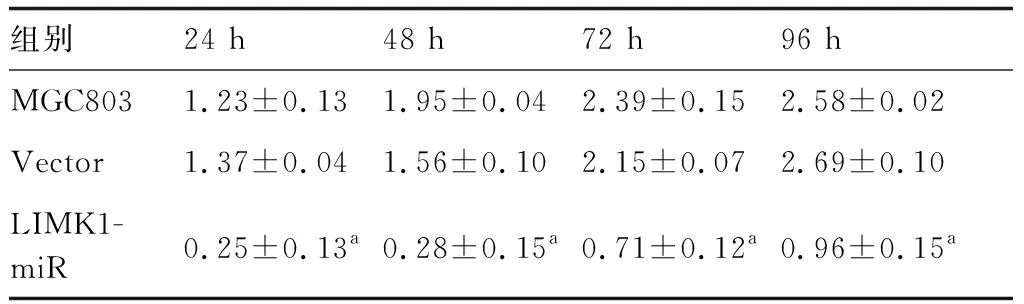
表3 沉默LIMK1對MGC803細胞增殖活性的影響 (OD570值)
與MGC803和Vector比較,aP<0.05

圖3 沉默LIMK1對MGC803細胞周期的影響A:MGC803; B:Vector; C:miR-LIMK1
表4 沉默LIMK1對MGC803細胞周期的影響
與MGC803和Vector比較,aP<0.05
2.4 沉默LIMK1對MGC803細胞遷移的影響
圖4顯示,0 h時,各組劃痕距離大體相同。24h后,未干擾組與陰性干擾組明顯變窄(P<0.05)。干擾組劃痕距離較未干擾組與陰性干擾組明顯增寬(P<0.05)。表明沉默LIMK1可抑制MGC803細胞遷移。
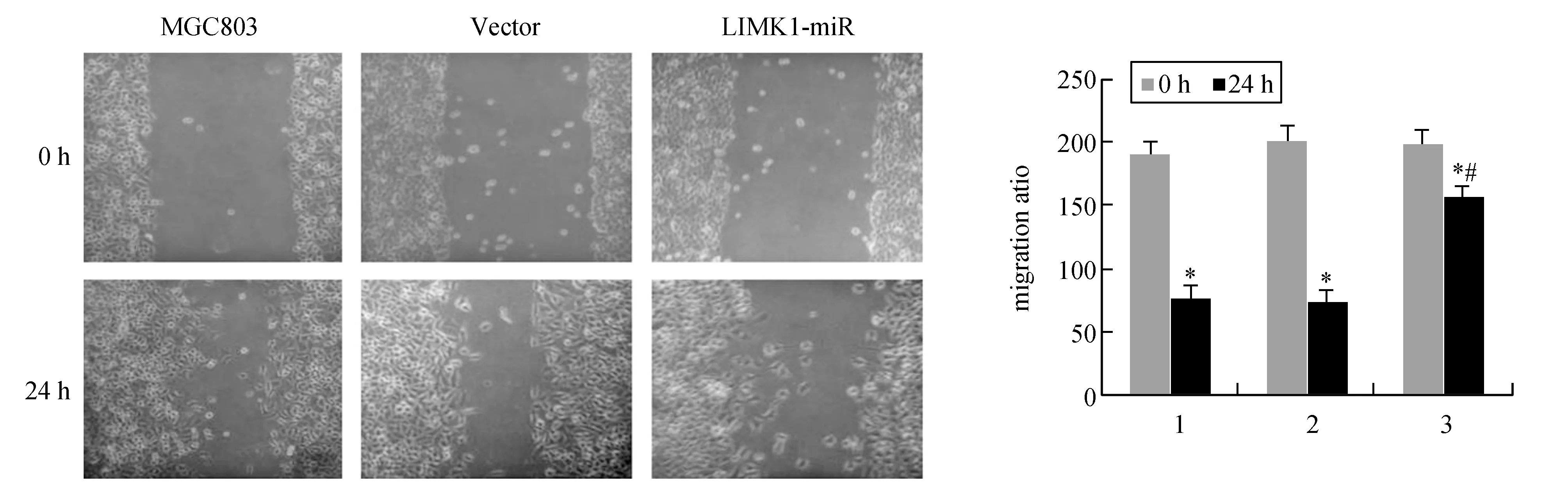
圖4 沉默LIMK1對MGC803細胞遷移的影響(10×)1:MGC803;2:Vector;3:LIMK1-miR.與0 h比較,*P<0.05;與MGC803和Vector 24 h比較,#P<0.05
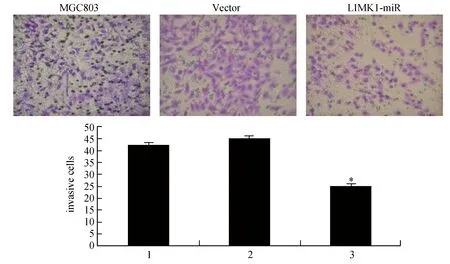
圖5 沉默LIMK1對MGC803細胞侵襲的影響(20×)1:MGC803;2:Vector;3:LIMK1-miR與MGC803和Vector比較,*P<0.05
2.5 沉默LIMK1對MGC803細胞侵襲的影響
圖5顯示,24 h后,沉默組穿膜細胞較未干擾組與陰性干擾組明顯減少(P<0.05)。表明沉默LIMK1可抑制MGC803細胞侵襲。
3 討 論
大量研究表明,LIMK1在結腸癌、胃癌、乳腺癌、前列腺癌、肺癌、口腔鱗狀細胞癌與食管癌等腫瘤中高表達與遷移侵襲有關[4-11]。有人發現,LIMK1和LIMK2表達不平衡在結直腸癌(CRC)進展中起重要作用,LIMK2隨著腫瘤從癌前病變向晚期CRC的進展而逐漸下調,阻滯G1-S細胞周期抑制細胞增殖,并限制EMT抑制細胞轉移的能力。相反,LIMK2表達減少可增強核β-catenin積累和激活Wnt信號通路,促進EMT。而LIMK1自始至終在CRC進展中高表達,擔任LIMK2通過β-catenin核易位的競爭性抑制劑。因此,LIMK1和LIMK2兩者的聯合作用為CRC進展機制與抗癌治療的研究提供了新的認識[4]。LIMK1在細胞漿和核高表達與腫瘤轉移和患者預后不良密切相關。增強LIMK1在細胞質和細胞核表達可促進EMT與激活PI3K/Akt信號通路,顯著增加細胞的增殖和遷移,促進移植瘤的生長和轉移,而沉默LIMK1效果相反。表明LIMK1在亞細胞水平上促進CRC的進展起著關鍵作用[7]。在PC-3和DU145人前列腺癌細胞中,ROCK通過靶向LIMK1和MMP-2促進細胞增殖和遷移,而敲除ROCK可下調p-LIMK1和MMP-2,減少細胞遷移和侵襲[9]。
近年來,發現一些miRNAs的靶基因是LIMK1,在抑制腫瘤侵襲與轉移中起著重要作用。如LIMK1是miR-128-3p的直接靶基因,miR-128-3p可通過下調LIMK1/Cofilin1通路抑制乳腺癌的進展[8]。LIMK1是miR-138的直接靶點。miR-138可通過靶向LIMK1/cofilin信號通路抑制NSCLC細胞的遷移和侵襲。因此,miR-138/LIMK1/cofilin可能是治療NSCLC的潛在治療靶點[10]。在口腔鱗狀細胞癌(OSCC)組織和細胞系中,miR-106a水平顯著下降,LIMK1表達顯著增加。miR-106a可直接靶向LIMK1抑制OSCC細胞的增殖和EMT[11]。基于微陣列的基因表達譜顯示,miR-384和Bax在食管鱗狀細胞癌(ESCC)中表達較低,而LIMK1、cofilin和Bcl-2在ESCC中表達較高。miR-384靶向并下調LIMK1阻斷LIMK1/cofilin通路,抑制細胞增殖、侵襲、細胞周期、LNM和腫瘤生長,促進ESCC細胞凋亡,最終抑制ESCC的發生發展[12]。
本研究結果顯示,采用RNA干擾技術成功構建穩定沉默LIMK1基因的MGC803細胞,并且發現沉默LIMK1可呈時間依賴性抑制MGC803細胞增殖,阻滯G2/M期,抑制細胞遷移與侵襲。
目前,研發抑制LIMK1的有效抑制劑和小分子化合物成為抗腫瘤治療的新途徑。研究發現,小分子化合物LC-0882可通過阻斷PAK4/LIMK1/cofilin信號通路顯著抑制人胃癌細胞的增殖與侵襲,因此,新型化合物LC-0882可能為胃癌治療提供一種新的化療途徑[13]。從草藥分離出來的曲霉醇(Curcolonol,CCL)可降低LIMK1的活性和cofilin 1磷酸化抑制乳腺癌細胞遷移與F-actin聚合,沉默LIMK1可增強CCL的抑制作用[14]。低納米級的LIMK1和LIMK2抑制劑通過下調p-cofilin抑制乳腺癌細胞侵襲[15]。氧化苦參堿可下調p-LIMK1和p-Cofilin抑制人胃癌細胞遷移和侵襲[16]。在三種倍半萜烯中,絲蘭內酯可顯著抑制LIMK1表達、cofilin1磷酸化、F-actin聚合和增殖與遷移[17]。
課題組成員前期工作證明,LIMK1與ADF分別在結腸癌中高表達,與腫瘤分化程度、腫瘤大小、淋巴結轉移、TNM分期及不良預后密切相關[6]。此外,發現二烯丙基二硫(Diallyl disulfide,DADS)可通過下調LIMK1-ADF/cofilin通路抑制結腸癌細胞遷移與侵襲和移植瘤生長[6,18]。并且,DADS可通過下調TGFβ1、Rac1、βcatenin、Vimentin和上調E-cadherin抑制胃癌細胞EMT以及移植瘤形成[19]。然而,DADS是否可阻斷LIMK1/cofilin通路抑制胃癌細胞遷移侵襲,尚待進一步研究。

