銀北鹽堿區植物根際土壤酶活性及微生物群落特征*
田平雅,沈 聰,趙 輝,張 瑩,代金霞
銀北鹽堿區植物根際土壤酶活性及微生物群落特征*
田平雅,沈 聰,趙 輝,張 瑩,代金霞?
(寧夏大學生命科學學院,西部特色生物資源保護與利用教育部重點實驗室,銀川 750021)
開展鹽堿區耐鹽植物根際微生物群落多樣性研究,對于鹽堿土壤的植被恢復和生態修復具有重要意義。運用Biolog 微平板技術,對寧夏銀北鹽堿區6種耐鹽植物根際土壤酶活性及微生物群落代謝功能多樣性進行研究。結果表明:不同植物根際土壤理化性質和酶活性存在一定的差異。與裸地相比,6種植物能顯著提高鹽堿地土壤酶活性,苜蓿根際土壤三種酶活性顯著高于其他植物。土壤平均顏色變化率(AWCD)隨培養時間的延長而逐漸增加,大小順序依次為苜蓿(MX)、芨芨草(JJC)、檉柳(CL)、柳枝稷(LZJ)、苦豆子(KDZ)、枸杞(GQ)和裸地土壤(CK),根際土壤與鹽堿裸地土壤之間差異顯著(<0.05)。土壤微生物群落香農指數、辛普森指數和麥金塔指數均以苜蓿根際土壤最高,芨芨草次之,二者較其他土壤差異顯著(<0.05)。不同植物根際土壤微生物碳源利用能力存在差異,苜蓿根際土壤微生物的利用率顯著高于其他土壤(<0.05),碳水化合物類是根際土壤微生物的主要碳源,其次為氨基酸類和羧酸類,胺類的利用率最小。主成分分析顯示,對PC1 和PC2 起分異作用的主要碳源為碳水化合物類和羧酸類。綜合各項指標,均表現為植物根際土壤優于鹽堿裸地,其中苜蓿和芨芨草能顯著提高土壤微生物群落功能多樣性,對鹽堿地根際微環境的養分循環具有積極意義。
鹽漬化土壤;根際微生物;土壤酶活性;群落多樣性;Biolog 法
土壤微生物在生態系統的物質循環和能量轉化中占有特別地位,在土壤形成和肥力積累過程中起著極為重要的作用[1]。根際是土壤-植物生態系統物質交換的活躍界面。根際微生物作為重要的物質轉化調節器,其生物活性、種類特征能反映土壤的肥力和植物的營養狀況,是對包括植物、土壤和氣候在內的環境因素綜合影響的響應[2-3]。研究表明,地上植被通過其凋落物和根系分泌物顯著影響著土壤微生物的群落特征。因此,研究根際微生物群落特征有助于從植被-土壤-微生物三者的互作關系了解植被恢復對土壤環境生物學方面的改善狀況[4]。
土壤鹽堿化通常與荒漠化過程相伴而生,造成環境資源的破壞和農業生產的巨大損失,是目前全球最嚴重的環境問題之一。開發和利用鹽堿地資源已成為廣大鹽堿地區進一步挖掘農業現有發展潛力的一條重要出路。位于寧夏銀川北部的鹽堿區屬我國5大鹽堿土區的西北半干旱鹽堿土區,蒸發量遠高于降水量,土壤鹽堿化已成為影響寧夏農業生產和經濟發展的限制性因素之一,改良銀北地區的鹽堿土壤對寧夏農牧業發展以及生態環境的保護具有重要意義。
鹽漬化土壤中各種微生物類群的數量和分布,是土壤成分和不同植被類型共同作用的結果,目前國內關于鹽漬化土壤和改良后土壤微生物多樣性的基礎研究很多,從耐鹽植物根際微生物的角度去分析土壤鹽漬化發生的改變及植物根際土壤微生物群落變化的研究卻很少[5]。微生物群落功能多樣性作為土壤微生物生態學特征的關鍵指標之一,廣泛應用于評價土壤中微生物的群落狀態和土壤的肥力特征。其中Biolog 分析法是一種以微孔板碳源利用為基礎的定量分析方法,通過揭示不同土壤微生物群落對碳源利用的差異性,來反映群落功能多樣性。開展鹽堿區植物根際土壤微生物的群落功能多樣性,對于鹽堿土壤的植被恢復和生態重建具有重要意義。本研究以寧夏銀北鹽堿地中的6種耐鹽植物根際土壤為研究對象,通過比較分析其土壤性質、相關酶活性和土壤微生物群落功能多樣性特征,科學評價不同植物對鹽堿土壤的改良效果,以期為加速該區鹽堿地的植物修復和生態重建奠定基礎。
1 材料與方法
1.1 研究區概況
研究區位于銀川北部鹽堿區平羅縣西大灘農場(38°50′23.8″ N,106°23′54.1″ E),該地區常年干旱少雨,蒸發量大,富水性差,主要土壤為鹽堿土,氣候為中溫干旱氣候,植被類型以耐鹽堿植物為主,主要有苜蓿()、枸杞()、柳枝稷()、芨芨草()、苦豆子()、檉柳()等。
1.2 樣品采集與分析
于2017年6月采集6種植物根際土壤,其中苜蓿(MX)、枸杞(GQ)、柳枝稷(LZJ)采集的是人工種植4年的植被下土壤,芨芨草(JJC)、苦豆子(KDZ)、檉柳(CL)采集的為野生植被下土壤,同時以裸地土壤為對照(CK)。
用五點取樣法采集植物根際土壤。去除土壤表層雜草和凋落物后在植株的根部一側小心挖掘,待該側植株根系露出后,用毛刷刷取黏附在根表面的土壤,或用剪刀直接剪取帶有浮土的須根刷取根表土壤。各樣點土樣混勻,封入滅菌的離心管,置于冰盒帶回實驗室。部分新鮮土樣用于土壤微生物群落功能多樣性測定; 剩余部分風干磨細過0.25 mm篩用于土壤理化性質及酶活性測定。
用梅特勒-托利多pH計測定土壤pH(土水比1︰2.5); 用DDS-307型電導率儀測定土壤的電導率以反映土壤全鹽含量; 用重鉻酸鉀(K2Cr2O7)氧化法測定土壤有機質含量; 采用凱氏定氮法、鉬銻抗比色法和氫氧化鈉堿熔—火焰分光光度法測定土壤全氮、全磷和全鉀含量; 采用堿解擴散法、NaHCO3浸提法和醋酸銨浸提—火焰光度法測定土壤速效氮、有效磷和速效鉀含量。采用苯酚鈉—次氯酸鈉比色法、磷酸苯二鈉比色法、3,5-二硝基水楊酸比色法測定土壤脲酶、堿性磷酸酶和蔗糖酶活性[6]。
1.3 土壤微生物群落功能多樣性測定
土壤微生物功能多樣性用Biolog 方法進行測定[7-8]:稱取5.0 g土壤樣品加入裝有45 mL無菌生理鹽水的三角瓶中,150 r·min–1振蕩30 min,冰浴2 min后靜置15 min,獲得土壤樣品表面和內部的微生物懸浮液。將土壤懸液梯度稀釋為10–3g·mL–1,在超凈工作臺中用移液槍將制備好的土壤懸液接種至Biolog 微平板(美國Biolog 公司)的各孔中,每孔150 μL,蓋好蓋子置于28℃培養箱中避光培養7 d,每隔24 h用酶標儀讀取在590 nm波長的數值。
1.4 數據分析
平均顏色變化率(average well color development,AWCD)可以評判微生物群落的整體活性,即對碳源利用的總能力:
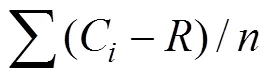
式中,為各反應孔在590 nm的吸光度值,為對照孔的吸光度值,為Biolog 微孔板反應孔數,為31,–小于零的孔,計算中記為零,即C–≥0。
采用培養168 h的數據計算微生物群落的多樣性指數。香農指數用于評估豐富度:

式中,P為第孔的相對吸光值與整個平板相對吸光值總和的比率。
辛普森指數是用于評估常見種優勢度的指數:
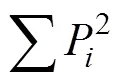
式中,P為第孔的相對吸光值與整個平板相對吸光值總和的比率。
麥金塔指數用于評估群落均一度:
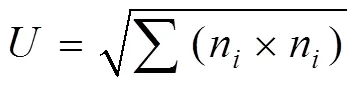
式中,n為第孔的相對吸光值。
采用Excel 和SPSS 19.0 軟件進行數據處理、方差分析和主成分分析(PCA)。
2 結 果
2.1 不同植物根際土壤理化性質和酶活性
由表1可知,不同植物種類對土壤理化性質的影響有顯著的根際效應。相較于裸地土壤而言,6種植物根際土壤的電導率顯著降低,除柳枝稷根際外,其余土壤pH均有所降低,表明植物的生長能夠有效降低土壤的鹽漬化程度。根際土壤的全氮、全磷、全鉀和速效氮含量大多顯著高于裸地土壤,而有效磷含量則顯著較低,速效鉀含量在各根際土壤中由高到低依次為芨芨草、柳枝稷、裸地、苦豆子、枸杞、檉柳和苜蓿。
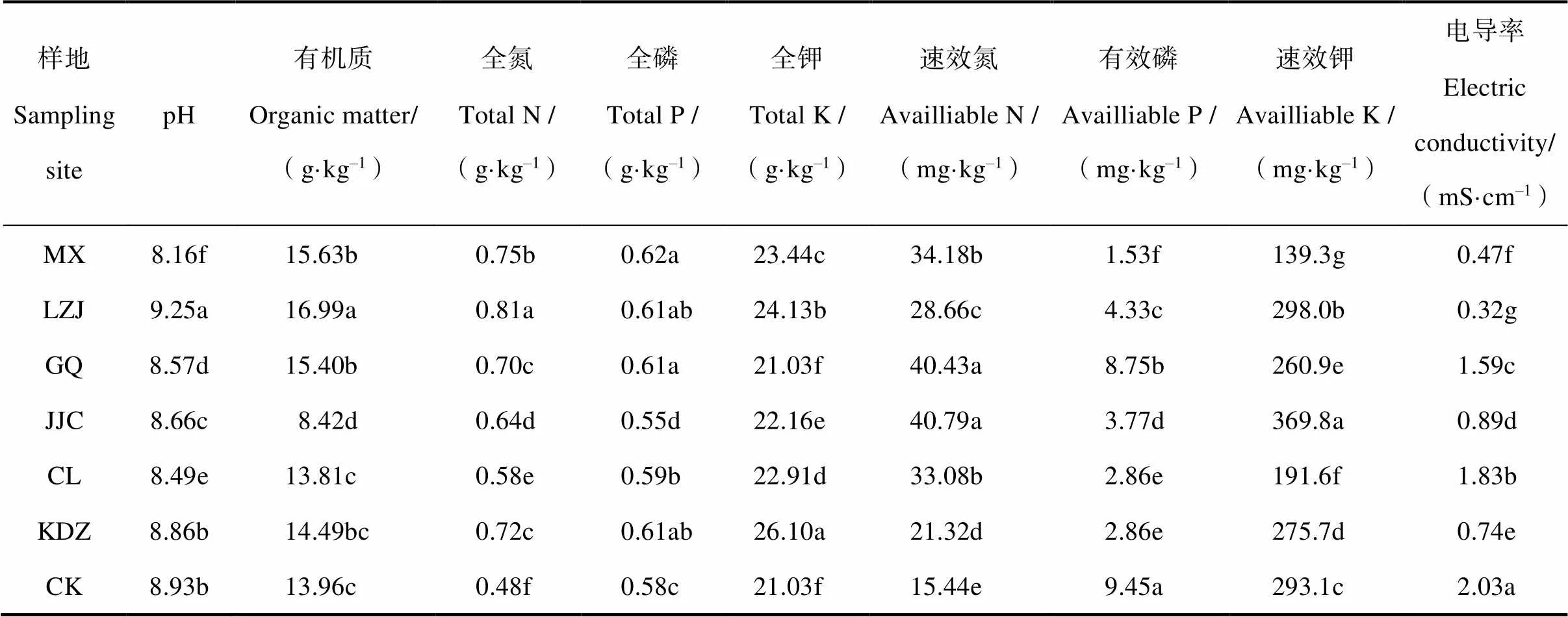
表1 不同耐鹽植物根際土壤理化性質
注:同一列數據不同字母表示處理之間差異達5%顯著水平; MX:苜蓿,LZJ:柳枝稷,GQ:枸杞,KDZ:苦豆子,JJC:芨芨草,CL:檉柳,CK:裸地,下同。Note:Different letters in the same row mean significant difference at 5% level; MX:LZJ:GQ:KDZ:JJC:CL:CK:bare soil. The same below.
由表2可以看出,與裸地相比,6種植物能顯著提高鹽堿地土壤酶活性,其根際土壤蔗糖酶活性由高到低為:枸杞、苜蓿、柳枝稷、芨芨草、檉柳、苦豆子和裸地; 脲酶活性依次為:苜蓿、柳枝稷、枸杞、苦豆子、檉柳、芨芨草和裸地; 堿性磷酸酶酶活性依次為:柳枝稷、苜蓿、苦豆子、枸杞、芨芨草、裸地和檉柳。總體而言,3種土壤酶活性表現出共同的特征,即人工種植的苜蓿、枸杞和柳枝稷根際土壤酶活性高于野生的苦豆子、檉柳和芨芨草,裸地土壤最低,說明人工種植3種耐鹽植物提高了土壤肥力,有效促進了鹽漬化土壤的改良。
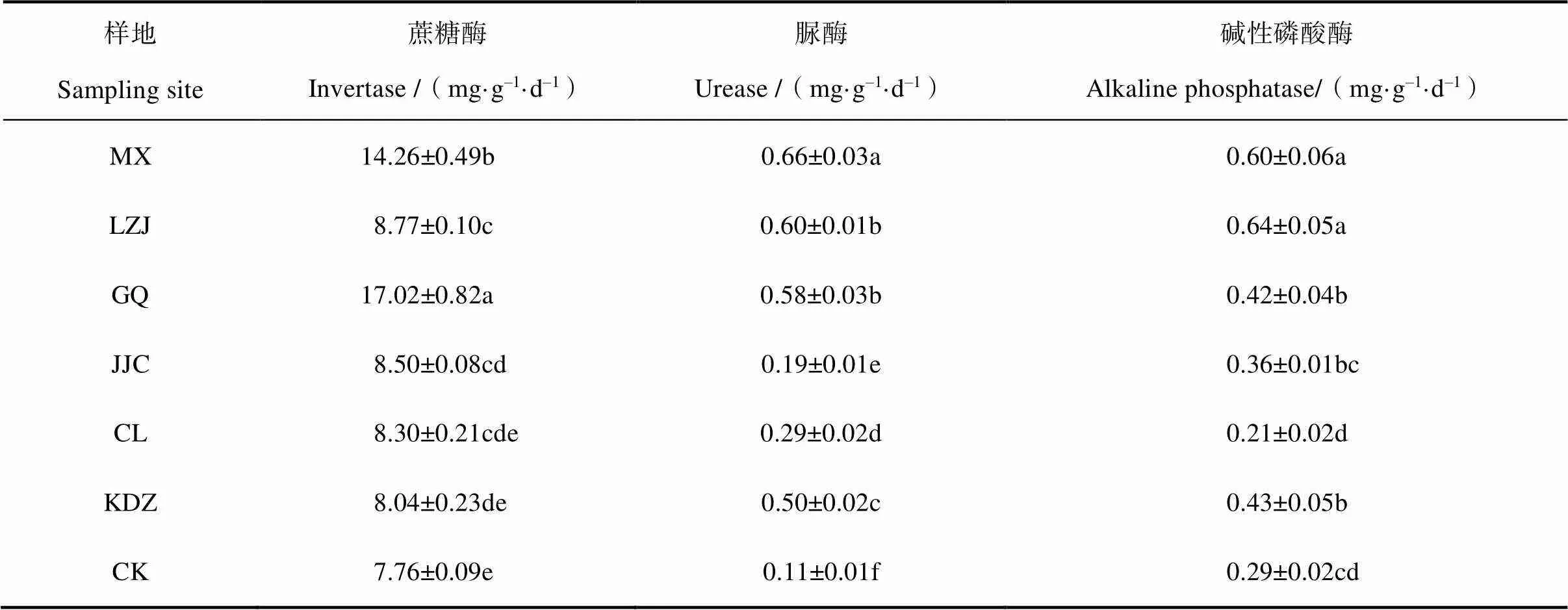
表2 不同耐鹽植物根際土壤酶活性
2.2 土壤微生物群落總碳源利用的動力特征
土壤微生物群落功能多樣性是土壤微生物群落狀態與功能的指標,反映土壤中微生物的生態特征[9]。利用不同植物根際土壤AWCD的3次重復平均值,繪制AWCD隨時間動態變化曲線(圖1)。土壤微生物利用碳源的總體變化趨勢:隨著培養時間的延長,其利用碳源的量也隨之增加,不同植物根際土壤平均顏色變化率存在較大差異。在48 h之前,AWCD為0.008~0.141,說明土壤微生物在剛開始階段對碳源利用率不高。48 h以后,不同根際土壤的AWCD出現變化,苜蓿根際土壤的AWCD增速明顯,表明其土壤微生物利用碳源的能力加強,生物活性增加。168 h之前,苜蓿和芨芨草根際土壤的AWCD較高,其他4種植物根際土壤的AWCD非常接近,說明此時苜蓿和芨芨草對碳源的利用率遠遠高于其他植物和裸地。168 h之后,6種植物根際土壤的AWCD均高于裸地土壤,并逐漸趨于平緩。對168 h時AWCD值的顯著性分析表明(表3),6種根際土壤與裸地之間差異顯著(<0.05),苜蓿和芨芨根際土壤的AWCD顯著高于其他植物,說明二者根際微生物對碳源消耗量最多,微生物活性最高,其次為檉柳和柳枝稷,與苦豆子和枸杞之間均無顯著差異,表明其根際土壤微生物對碳源的利用程度相當,微生物活性較相似。

圖1 不同植物根際土壤微生物群落 AWCD 隨時間的變化
2.3 土壤微生物群落多樣性指數
碳源代謝的多樣性指數分析可以準確地反映微生物群落功能多樣性的變化,多樣性指數值越大表明土壤微生物群落功能多樣性越高,反之亦然。香農指數()、辛普森指數()和麥金塔指數()是表征群落多樣性的常用指數,是研究群落物種數及其個體數和分布均勻程度的綜合指標。本實驗采用Biolog 微平板培養168 h的數據進行微生物代謝多樣性分析(表3)。結果表明不同植物根際土壤微生物群落多樣性存在差異。香農指數、辛普森指數和麥金塔指數均以苜蓿根際土壤最高,芨芨草次之,二者較其他土壤差異顯著(<0.05)。香農指數在各植物根際土壤的大小順序是苜蓿、芨芨草、枸杞、裸地、柳枝稷、檉柳和苦豆子;辛普森指數為苜蓿、芨芨草、枸杞、柳枝稷、檉柳、裸地和苦豆子;麥金塔指數為苜蓿、芨芨草、檉柳、苦豆子、柳枝稷、枸杞和裸地。土壤微生物群落功能多樣性在一定程度上受到植被類型的影響,總體上看苜蓿和芨芨草根際土壤微生物群落種類最多且較均勻,優勢菌生長旺盛,碳源利用程度較高。苦豆子根際土壤微生物種類少且分布不均勻。
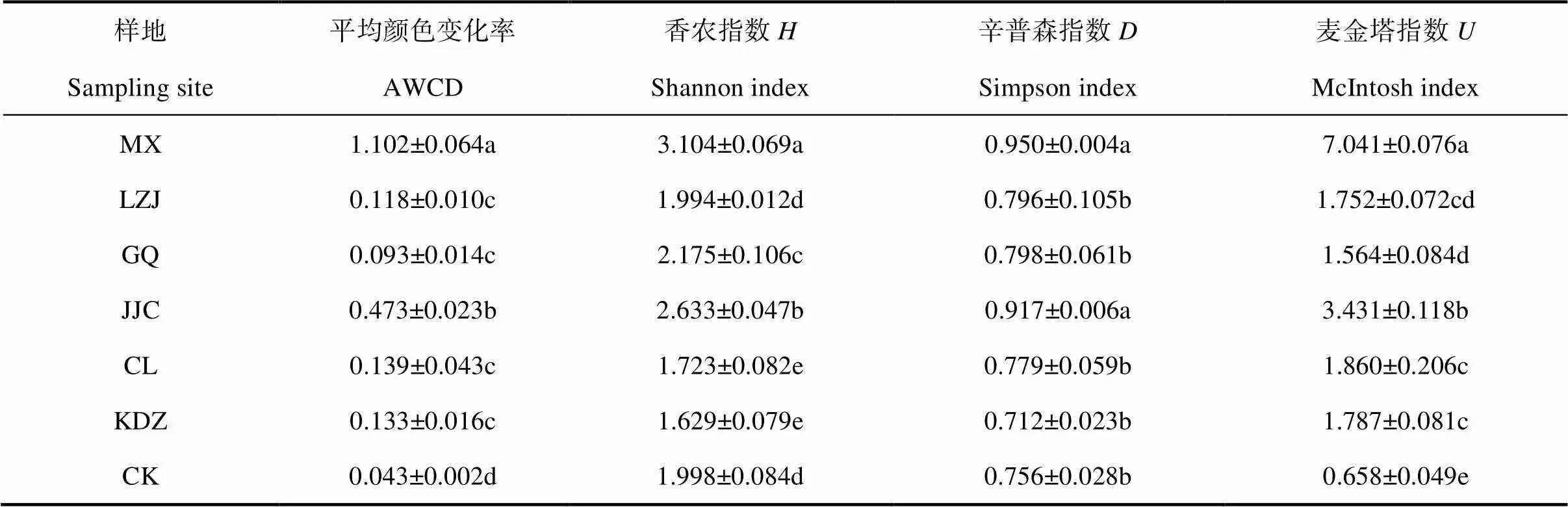
表3 不同植物根際土壤微生物群落多樣性指數
2.4 土壤微生物群落利用碳源的類型
本研究中所用的31種碳源按化學基團的性質可以分為6類,分別是碳水化合物類、氨基酸類、羧酸類、胺類、酚酸類和聚合物類。隨著培養時間的延長,微生物對6類碳源的利用率也在逐漸增加。選取培養168 h時的碳源利用率進行分析,不同植物根際微生物對6類碳源利用能力的大小存在差異(圖2)。苜蓿根際微生物對6類碳源的利用率顯著高于其他土壤,芨芨草對胺類和酚酸類的利用很小,但對另外4類碳源的利用率顯著高于柳枝稷、檉柳、苦豆子和枸杞。總體而言,碳水化合物類是銀北鹽堿土壤中微生物的主要碳源,其次為羧酸類和氨基酸類,胺類的利用率最小。
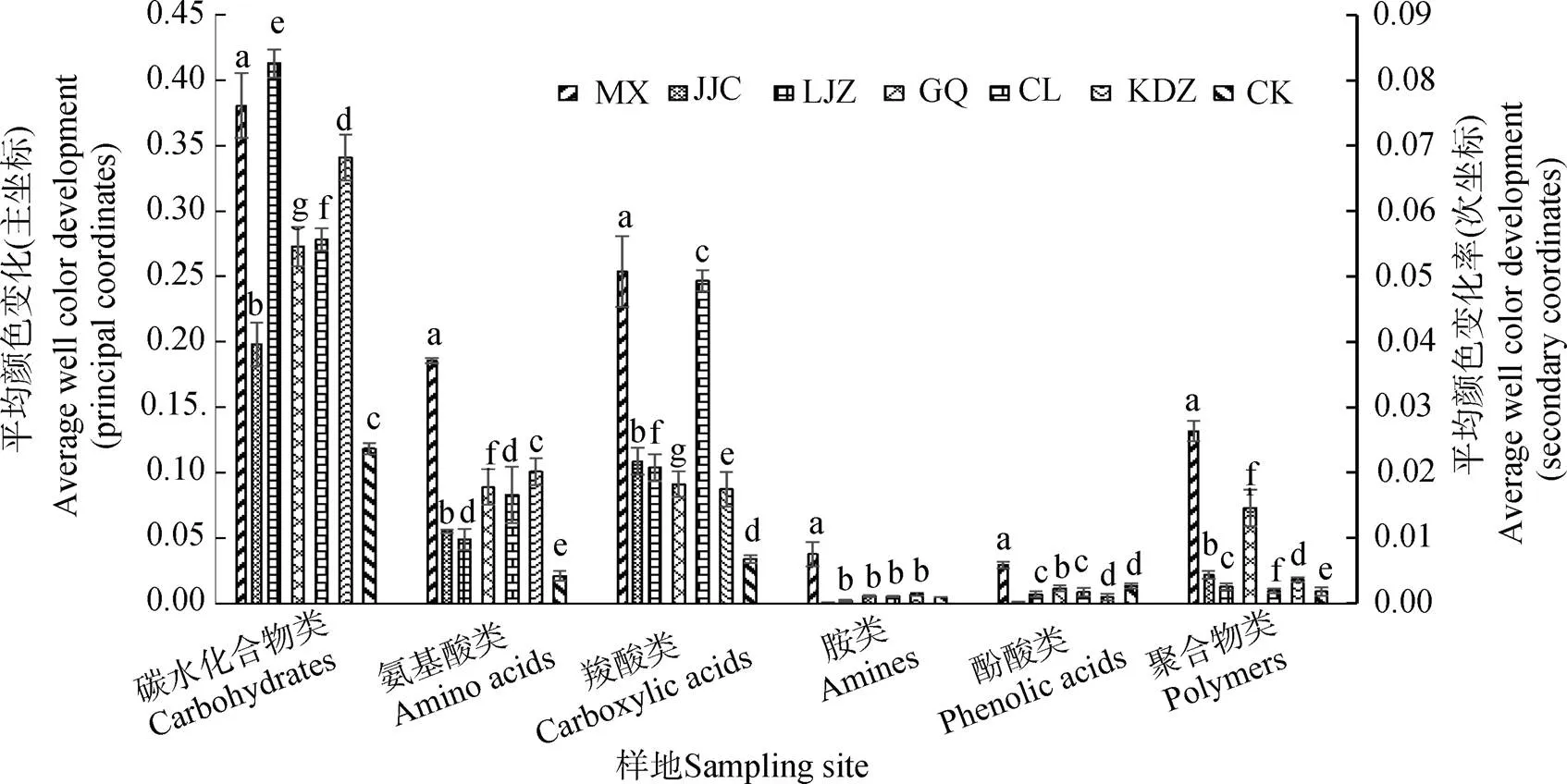
注:主坐標表示苜蓿(MX)和芨芨草(JJC)土樣的AWCD值,次坐標表示柳枝稷(LZJ)、枸杞(GQ)、檉柳(CL)、苦豆子(KDZ)和裸地(CK)土樣的AWCD值。Note:The principal coordinates represent average well color development of the soils in the rhizosphere of M.sativa (MX) and A. splendens (JJC); the secondaryaverage well color development of the soils in the rhizosphere soil of P. virgatum (LZJ),L. barbarum (GQ),T. chinensis (CL),S. alopecuroides (KDZ) andin bare soil (CK).
2.5 土壤微生物群落代謝功能主成分
利用培養168 h的AWCD值,對不同植物根際土壤微生物利用單一碳源特性進行主成分分析(Principal component analysis,PCA),同時提取特征值大于1的主成分的特征根及方差貢獻率,揭示不同根際土壤微生物群落對碳源利用模式的差別。本研究共提取出4個主成分,累計貢獻率達95.38%。其中第1主成分(PC1)的特征根為23.01,方差貢獻率為74.23%; 第2主成分(PC2)的特征根為3.41,方差貢獻率為11%; 其余2個主成分貢獻率小于10%。從中提取可以聚集單一碳源變量的數據變異(累積方差貢獻率)為85.23%的前2個主成分PC1,PC2來分析微生物群落功能多樣性。
由圖3可見,在PC1軸上,苜蓿和芨芨草分布在正方向,苦豆子、檉柳、柳枝稷、枸杞和裸地土分布在負方向; 在PC2軸上,苜蓿、枸杞、苦豆子分布在正方向,柳枝稷、芨芨草和裸地土分布在負方向,檉柳在坐標軸左右。表明苜蓿、芨芨草、枸杞和柳枝稷的根際土壤微生物群落有各自獨特的碳源利用模式,苦豆子和檉柳與裸地土分布較近,說明這兩種植物根際土壤與裸地土壤微生物群落具有相似的碳源利用特征。初始因子載荷反映了主成分與碳源利用的相關程度,因子載荷絕對值越接近于1,表示該碳源對主成分的影響越大。如表4所示,與第一主成分相關性較高(因子載荷>0.5)的碳源有27個,主要包括碳水化合物類(9個)、氨基酸類(6個)、羧酸類(6個)、酚酸類(2個)、胺類(1個)、聚合物類(3個),可見影響PC1的主要為碳水化合物類、氨基酸類和羧酸類; 與第二主成分相關性較高的碳源有6個,主要包括碳水化合物類(1個)、羧酸類(2個)、酚酸類(1個)、胺類(1個)、聚合物類(1個)。因此可以認為對于本實驗土壤樣品,對土壤微生物群落功能多樣性差異貢獻較大的碳源是碳水化合物類和羧酸類。
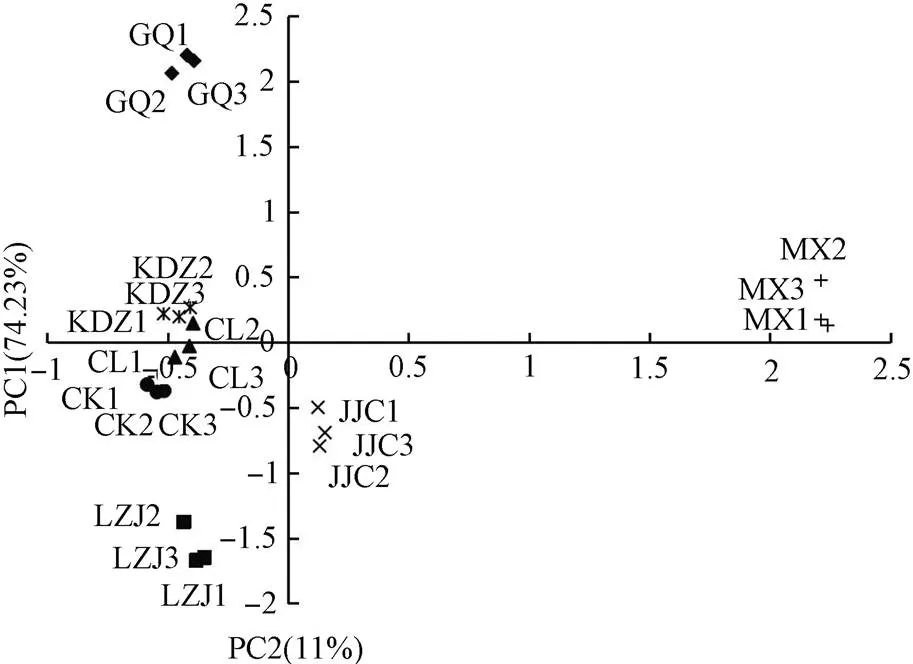
圖3 不同耐鹽植物根際土壤微生物群落代謝功能主成分
3 討 論
根際微生物在土壤形成和肥力積累過程中起著極為重要的作用,是生態環境變化的敏感指標[10-11]。根際微生物的分布與活動,一方面反映環境、植物對微生物的分布習性、群落組成、種群演替及其功能的影響,另一方面說明對植物生長、土壤肥力及物質循環和能量轉化現狀和趨勢的相關性[12-13]。已有的研究表明,不同的植被類型通過根系分泌物的種類、凋落物的數量和組成影響土壤理化性質和酶活性[14-15]。寧夏銀北鹽漬化土壤中6種植物根際土壤的電導率和pH與裸地相比多有顯著下降,全氮、全磷、全鉀和速效氮含量則明顯增加,3種土壤酶活性也顯著高于裸地,說明耐鹽堿植物能夠有效降低土壤的鹽漬化程度,提高根際土壤肥力,反映了土壤肥力狀況與植物營養的密切關系。而6種根際土壤中速效磷的含量顯著低于裸地,速效鉀含量在鹽堿裸地中也高于苦豆子、枸杞、檉柳和苜蓿根際。微生物群落功能特征與土壤理化性質緊密相關[16]。植物與土壤微生物之間通過凋落物和根系分泌物建立起密切的聯系,植物種類的不同會直接影響根際微生物的功能類群,這些功能類群又會通過解磷、固氮、分泌代謝產物等促進土壤中有機物的分解和營養元素的礦化。根際土壤中解磷解鉀菌通過產生酸性物質增加土壤中可溶性磷鉀的含量,這些可溶性磷鉀又被植物吸收利用,從而使6種根際土壤有效磷鉀的含量低于裸地土壤。
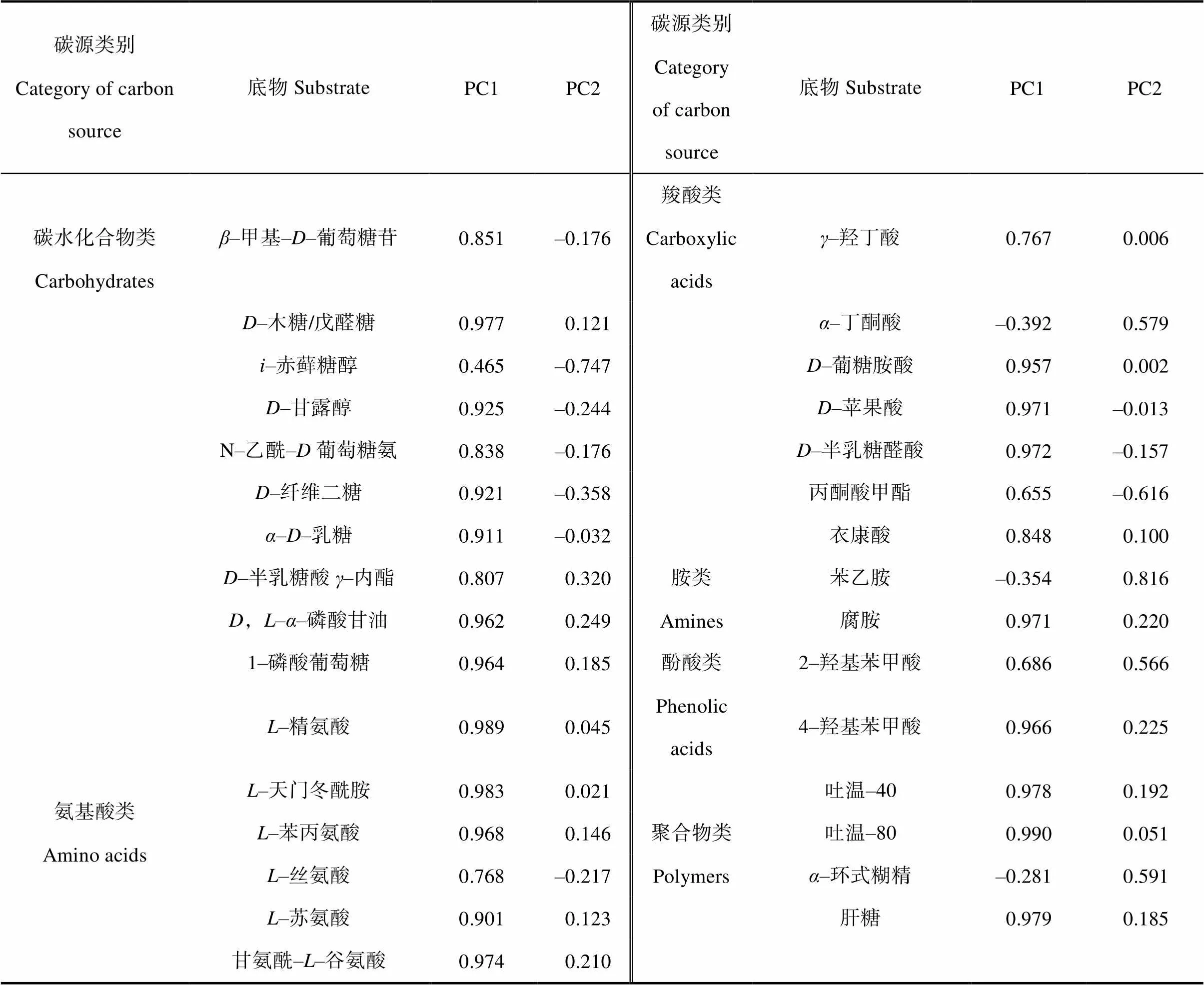
表4 PC1、PC2的碳源載荷因子
土壤微生物群落多樣性反映了群落總體的動態變化,它可以通過檢測微生物碳源利用程度來反映。從不同植物根際土壤微生物碳源利用的AWCD的變化情況,可以看出6種耐鹽植物根際土壤微生物群落對碳源底物的利用能力明顯強于鹽堿裸地。苜蓿根際微生物對碳源利用能力最強,芨芨草次之,其他4種植物根際土壤碳源利用能力相近。碳源代謝的多樣性指數也表明苜蓿和芨芨草根際功能微生物群落多樣,碳源利用程度較高。在六類碳源中,碳水化合物類和羧酸類是6種植物根際土壤微生物的主要碳源,其次為氨基酸類、酚酸類和聚合物類,胺類碳源的利用率最小,說明碳水化合物類和羧酸類是6種耐鹽植物土壤微生物群落變化的敏感碳源。這與吳則焰等[17]的研究結果一致。
微生物的群落組成存在生境異質性,土壤微環境和植被狀況是影響土壤微生物群落種類和分布的關鍵因素。滕應等[18]認為植物向根際土壤分泌的碳水化合物類越多,根際微生物對碳底物利用的能力越強。杜瀅鑫等[19]的結果表明,同一科的植物根際微生物對碳源的代謝特征比較相似,不同科植物根際微生物對碳源的代謝特征存在著一定的差異。本研究并未得出相同的結果,如苜蓿和苦豆子同為豆科植物,芨芨草和柳枝稷同為禾本科植物,無論從碳源利用的多樣性水平上,還是利用程度上,同科植物間都存在顯著差異。這是因為植物生長過程中會向根部土壤釋放大量的碳源,碳源在不同根系土壤中的有效性不一樣,同時植被凋落物的分解又增加了土壤有機質及養分的含量,加之不同植物根系分泌物的種類和性質不同,這些差異打破了原有根際微環境中的生態平衡,資源的異質性影響了根際微生物的群落結構組成[20-21]。不同的微生物群落由于種群的競爭機制,或者對各類底物的適應性不同,表現出對不同碳源的利用強度存在一定的差異[22]。因此,盡管在立地條件基本一致的情況下,不同植物根際土壤微生物碳源利用的程度和種類也會有差異。此外,土壤微生物群落多樣性也與土壤鹽堿度有關,研究結果顯示苜蓿和芨芨草根際土壤的pH和電導率明顯低于苦豆子和柳枝稷,微生物活性顯著增高,表明較高鹽堿環境對土壤微生物的生長有抑制作用,這與李鳳霞等[23]研究結果一致。
土壤微生物活性、數量以及豐富的多樣性代表著微生物群落的穩定性,對植物的生長發育和群落結構的演替都具有重要作用。土壤微生物和地上植被是相輔相成、不可分割的整體。它們互相影響、互相制約,為生態系統的多樣性和穩定性提供有利條件[24]。一般在鹽漬化土壤中,微生物活性增高說明土壤的鹽堿性狀況得到了改善,微生物類群及數量愈趨平衡,土壤生態系統更為持續穩定[25]。研究表明,不同耐鹽植物根際土壤微生物活性顯著高于空裸地,說明耐鹽植物能夠改善土壤環境,抑制土壤返鹽,改善土壤肥力,是干旱荒漠區進行生物改良鹽堿土的寶貴植物資源。
4 結 論
寧夏銀北地區土壤鹽漬化嚴重,不同耐鹽植物根際土壤不論是土壤理化性質、酶活性,還是反映土壤微生物代謝功能多樣性的平均顏色變化率、功能多樣性指數和碳源利用程度上,多表現為植物根際土壤優于鹽堿裸地,且6種耐鹽植物根際土壤微生物群落多樣性存在差異,其中苜蓿和芨芨草能顯著提高土壤微生物群落功能多樣性,對鹽堿地根際微環境的養分循環有積極意義。
[1] Raaijmakers J M,Mazzola M. Soil immune responses. Science,2016,352:1392—1393.
[2] Hayat R,Ali S,Amara U,et al. Soil beneficial bacteria and their role in plant growth promotion:A review. Annals of MicroBioloy,2010,60(4):579—598.
[3] Zhou X G,Gao D M,Liu J,et al. Changes in rhizosphere soil microbial communities in a continuously monocropped cucumber(L.)system. European Journal of Soil Biology,2014,60:1—8.
[4] Xiang Z Y,Zhang L,Zhang Q F,et al. Soil nutrients and microbial functional diversity of different stand types in Qinghai. Scientia Silvae Sinicae,2014,50(4):22—31. [向澤宇,張莉,張全發,等. 青海不同林分類型土壤養分與微生物功能多樣性. 林業科學,2014,50(4):22—31.]
[5] Li M,Sun Z J,Chen W M,et al. Summary of microbial community and the effects of the biological amelioration on saline soil in Ningxia. Journal of Anhui Agricultural Sciences,2014,42(4):1042—1046. [李明,孫兆軍,陳衛民,等. 寧夏地區鹽漬化土壤微生物群落的研究現狀及生物改良對其的影響. 安徽農業科學,2014,42(4):1042—1046.]
[6] Wang X J,Zhou Y M,Wang X X,et al. Responses of soil enzymes in activity and soil microbes in biomass to warming in tundra ecosystem on Changbai Mountains. Acta Pedologica Sinica,2014,51(1):166—175. [王學娟,周玉梅,王秀秀,等. 長白山苔原生態系統土壤酶活性及微生物生物量對增溫的響應. 土壤學報,2014,51(1):166—175.]
[7] Zhao Z T,Zheng J,Wu Z Y,et al. Features of mangrove soil microbial community withinvaded. Journal of Forest and Environment,2017,37(2):169—173. [趙紫檀,鄭潔,吳則焰,等. 互花米草入侵下紅樹林土壤微生物群落特征. 森林與環境學報2017,37(2):169—173.]
[8] Zhang H,Lü J L,Cao Y F,et al. Decomposition characteristics of different plant straws and soil microbial functional diversity. Acta Pedologica Sinica,2014,51(4):743—752. [張紅,呂家瓏,曹瑩菲,等. 不同植物秸稈腐解特性與土壤微生物功能多樣性研究. 土壤學報,2014,51(4):743—752.]
[9] Cao Y C,Tan X P,He W X,et al. The metabolism characteristics of microbial community in different forest soil in Qinling Mountains Area. Acta Ecologica Sinica,2016,36(10):2978—2986. [曹永昌,譚向平,和文祥,等. 秦嶺地區不同林分土壤微生物群落代謝特征. 生態學報,2016,36(10):2978—2986.]
[10] Yi H Y,Gong Y B,Chen L W,et al. Soil nutrient status and microbiological properties in the mountain forests/arid valley ecotone in the upper reaches of Minjiang River after converting farmland to forest. Research of Soil and Water Conservation,2010,17(2):130—135. [易海燕,宮淵波,陳林武,等. 岷江上游山地森林/干旱河谷交錯帶退耕還林后土壤養分變化和微生物分布特征. 水土保持研究,2010,17(2):130—135.]
[11] Li X Z,Rui J P,Mao Y J,et al. Dynamics of the bacterial community structure in the rhizosphere of a maize cultivar. Soil Biology & Biochemistry,2014,68:392—401.
[12] Pii Y,Penn A,Terzano R,et al. Plant-microorganism-soil interactions influence the Fe availability in the rhizosphere of cucumber plants. Plant Physiology and Biochemistry,2015,87:45—52.
[13] Velasco A G V,Kowalchuk G A,Ma?ero F J G,et al. Increased microbial activity and nitrogen mineralization coupled to changes in microbial community structure in the rhizosphere of Bt corn. Applied Soil Ecology,2013,68:46—56.
[14] Luo Q,Huang B L,Tang Z X,et al. Carbon source utilization of microbes in saline soil of three vegetation types in Xinjiang. Chinese Journal of Applied & Environmental Biology,2013,19(1):96—104. [羅倩,黃寶靈,唐治喜,等. 新疆鹽漬土3種植被類型土壤微生物碳源利用. 應用與環境生物學報,2013,19(1):96—104.]
[15] Li J,Yu X Y,Tang M. Effects of different plants on soil microbial biomass and enzyme activities in Zhifanggou Watershed of Loess Plateau. Acta Botanica Boreali-Occidentalia Sinica,2013,33(2):387—393. [李靜,蔚曉燕,唐明. 黃土高原紙坊溝流域不同植物對土壤微生物生物量和土壤酶活性的影響. 西北植物學報,2013,33(2):387—393.]
[16] Hoogmoed M,Cunningham S C,Baker P,et al. N-fixing trees in restoration plantings:Effects on nitrogen supply and soil microbial communities. Soil Biology & Biochemistry,2014,77(7):203—212.
[17] Wu Z Y,Lin W X,Chen Z F,et al. Characteristics of soil microbial community under different vegetation types in Wuyishan National Nature Reserve,East China. Chinese Journal of Applied Ecology,2013,24(8):2301—2309. [吳則焰,林文雄,陳志芳,等. 武夷山國家自然保護區不同植被類型土壤微生物群落特征. 應用生態學報,2013,24(8):2301—2309.]
[18] Teng Y,Huang C Y,Long J,et al. Functional diversity of microbial community in herbage rhizosphere of reclaimed red soils. China Environmental Science,2003,23(3):72—76. [滕應,黃昌勇,龍健,等. 復墾紅壤中牧草根際微生物群落功能多樣性. 中國環境科學,2003,23(3):72—76.]
[19] Du Y X,Xie B M,Cai H S,et al. Structural and functional diversity of rhizosphere microbial community of nine plant species in the Daqing Saline-alkali soil region. Acta Ecologica Sinica,2016,36(3):740—747. [杜瀅鑫,謝寶明,蔡洪生,等. 大慶鹽堿地九種植物根際土壤微生物群落結構及功能多樣性. 生態學報,2016,36(3):740—747.]
[20] Caracciolo A B,Bustamante M A,Nogues I,et al. Changes in microbial community structure and functioning of a semiarid soil due to the use of anaerobic digestate derived composts and rosemary plants. Geoderma,2015,245/246:89—97.
[21] Sulkava P,Huhta V. Habitat patchiness affects decomposition and faunal diversity:Amicro cosm experiment on forest floor. Oecologia,1998,116(3):390—396.
[22] Grayston S J,Wang S Q,Campbell C D,et al. Selective influence of plant species on microbial diversity in the rhizosphere. Soil Biology & Biochemistry,1998,30(3):369—378.
[23] Li F X,Wang X Q,Guo Y Z,et al. Microbial flora and diversity in different types of saline-alkali soil in Ningxia. Journal of Soil and Water Conservation,2011,25(5):107—111. [李鳳霞,王學琴,郭永忠,等. 寧夏不同類型鹽漬化土壤微生物區系及多樣性. 水土保持學報,2011,25(5):107—111.]
[24] Liu Z F,Fu B J,Zheng X X,et al. Plant biomass,soil water content and soil N:P ratio regulating soil microbial functional diversity in a temperate steppe:A regional scale study. Soil Biology & Biochemistry,2010,42:445—450.
[25] Cao G D,Chen J H,Wang S M,et al. Study on soil microbial properties under different halophytes types. Xinjiang Agricultural Sciences,2012,49(3):523—530. [曹國棟,陳接華,王邵明,等. 不同鹽生植被類型下土壤微生物特性研究. 新疆農業科學,2012,49(3):523—530.]
Enzyme Activities and Microbial Communities in Rhizospheres of Plants in Salinized Soil in North Yinchuan, China
TIAN Pingya, SHEN Cong, ZHAO Hui, ZHANG Ying, DAI Jinxia?
(School of Life Science, Ningxia University, Key Lab of Ministry of Education for Protection and Utilization of Special Biological Resources in the Western, Yinchuan 750021, China)
It is of great significance to vegetation restoration in and eco-remediation of saline-alkali soils to unfold researches on microbial community diversity in the rhizospheres of salt-tolerant plants in saline-alkali soils.In this research, the biolog ecoplate technology was used to study soil enzyme activities and metabolic function diversity of the microbial communities in the rhizospheres of six salt-tolerant species of plants species in saline-alkali soils North Yinchuan.Results showed physical and chemical properties and enzyme activity of the rhizosphere varied somewhat with species of the plant. Compared with bare soil, rhizosphere soils of the salt-tolerant plants were significantly higher in soil enzyme activity, especially the rhizosphere soil ofin the activity of three kinds of soil enzymes. In general, the average well color development (AWCD) of the rhizosphere soils increased with the processing of culture and in terms of AWCD, the five species of plants followed an order of(MX),(JJC),(CL),(LZJ),(KDZ),(GQ), all being much higher than that in the bare soil (CK) (<0.05). The soil microbial community in the rhizosphere soil ofwas the highest in Simpson index, Shannon index and McIntosh index, and followed by that of, and the two differed significantly from that of the others (<0.05). Soil microbial community in the rhizosphere soil varied with species of the plant in ability to utilize carbon resources. The one in the rhizosphere soil ofwas significantly higher than that of the others in carbon utilization ability (<0.05). Carbohydrates were the main carbon source for soil microbes in rhizosphere soil, and followed by amino acids and carboxylic acids, and amines the last. Principal component analysis demonstrates that the main carbon sources that differentiated between PC1 and PC2 were carbohydrates and carboxylic acids.All the findings demonstrate that all the indices are higher in the rhizosphere soil than in the bulk soil or soil of the bare saline-alkali field, particularly in theandfields, which demonstrates that the plants significantly improve functional diversity of the soil microbial community, thus contributing positively to nutrient recycling in the rhizosphere micro-environment in saline-alkali lands.
Saline-alkali soil; Rhizosphere microbial; soil enzyme activities; Community diversity; Biolog method
S154.36
A
10.11766/trxb201807050359
田平雅,沈聰,趙輝,張瑩,代金霞. 銀北鹽堿區植物根際土壤酶活性及微生物群落特征[J].土壤學報,2020,57(1):217–226.
TIAN Pingya,SHEN Cong,ZHAO Hui,ZHANG Ying,DAI Jinxia. Enzyme Activities and Microbial Communities in Rhizospheres of Plants in Salinized Soil in North Yinchuan,China[J]. Acta Pedologica Sinica,2020,57(1):217–226.
* 國家自然科學基金項目(31760027)、寧夏自然科學基金項目(NZ16001)、國家重點研發計劃項目(2016YFC0501307)和寧夏高校項目(NGY2016009)資助Supported by the National Natural Science Foundation of China(No. 31760027), the Natural Science Foundation of Ningxia(No. NZ16001),the National Key R&D Program of China(No. 2016YFC0501307)and the Project for Colleges and Universities of Ningxia(No. NGY2016009)
,E-mail:daijx05@163.com
田平雅(1993—),女,寧夏中衛人,碩士研究生,主要從事微生物資源與利用研究。E-mail:564967039@qq.com
2018–07–05;
2018–10–29;
2018–11–28
(責任編輯:盧 萍)

