苯酚脅迫下多刺裸腹溞實時定量PCR內參基因的篩選
王 茜 劉文秀 高 菲 王 蘭
(山西大學生命科學學院, 太原 030006)
枝角類是生態毒理學中常用的化學物質生態毒性評價模型之一[1]。多刺裸腹溞(Moina macrocopa)作為常見的枝角類, 是除大型溞(Daphnia magna)和蚤狀溞(Daphnia pulex)之外的又一理想材料, 是山西省水體中的優勢物種, 全身透明、繁殖率高、對農藥等化學品具有高的敏感性[2], 常被用于水環境的生物監測。目前關于多刺裸腹溞分子生物學方面的研究較少, 相關分子生物學信息匱乏,限制了外源化學物質對其毒性效應的分子機制的研究。
實時定量PCR(Quantitative Real-Time PCR,qRT-PCR)是在傳統聚合酶鏈式反應(Polymerase chain reaction, PCR)的基礎上發展起來的一項新的核酸定量技術[3], 操作快速靈敏、具有特異性強、定量準確、檢驗范圍廣等特點, 隨著技術的不斷成熟, 廣泛應用于多個領域[4]。qRT-PCR主要有絕對定量和相對定量兩種方法, 其中相對定量不需要已知的標準品, 相對簡便因而被大量采用[5], 但前提是需要穩定的內參基因。
內參基因是指在對某一個目的基因進行定量研究時, 在實驗條件下待測樣品中表達相對恒定的一類基因, 其作用是校正目的基因的定量過程[6]。常用的內參基因大多是管家基因(House-keeping gene), 包括編碼組蛋白基因、線粒體蛋白基因、編碼核糖體蛋白基因、生物代謝途徑中各種關鍵酶的基因等, 如rRNA、β-actin、cyclophilin、hsp、gapdh、rpl13等[7]。這些管家基因大多參與了生物體基本代謝活動, 因而具有穩定表達的特性[8]。但內參基因并非在所有生理條件下都能穩定表達, 在特定實驗條件或某些組織細胞中各基因的表達穩定性有差異[9], 至今還未發現一個適合所有條件下基因表達分析的內參基因[10]。鎘脅迫斑馬魚(Danio rerio)后,ef1a、rpl13a、gapdh和rplp2分別是在腎脾臟、肝臟、鰓和腸道中穩定表達的內參基因[11]。弧菌免疫后擬穴青蟹(Scylla paramamosain)的血細胞選擇ef1a、UPQ作為內參基因, 但其他組織選擇18S rRNA和ef1a作為內參基因[12]。因此, 在進行目的基因相對定量分析中, 不同的實驗條件甚至同一實驗條件不同組織都需要進行內參基因的篩選。目前對多刺裸腹溞進行實時定量PCR分析研究的報道較少[13], 有關內參基因的信息缺乏。鑒于此, 本研究設計合成了多刺裸腹溞β-actin、16S rRNA和12S rRNA的特異性引物, 利用內參基因表達水平(Ct值)[11,14]、GeNorm[15]、NormFinder[16]和BestKeeper[17]四種方法分析了苯酚脅迫下各基因的表達穩定性, 從中篩選出最佳內參基因, 為進一步研究苯酚脅迫下多刺裸腹溞相關目的基因的表達奠定基礎。
1 材料與方法
1.1 實驗動物
多刺裸腹溞(Moina macrocopa)采自山西省太原市小店區北張村, 在本實驗室經過三代以上孤雌生殖培養, 其敏感度達到GB/T 13266—91的要求[18]。
1.2 實驗方法
苯酚處理及樣品采集選取健康狀況良好的一日齡幼溞, 分別接種到盛有不同濃度苯酚(0、0.25、0.75、1.25、1.75和2.25 mg/L)的燒杯中, 水溫控制在(25±1)℃, 光照周期為光:暗=16h:8h。培養期間不喂食。在苯酚染毒處理后, 將存活的多刺裸腹溞過濾、用DEPC水清洗、吸掉多余水分, 稱量0.1 g置于提前裝有1 mL Trizol的無RNA酶的EP管中, 于-80℃保存。實驗重復3次, 每次2個平行。
總RNA提取和cDNA合成用Trizol法[19]提取總RNA, 經凝膠電泳和分光光度計檢測總RNA的質量。利用5×All-In-One RT MasterMix試劑盒(鎮江ABM公司提供)將總RNA合成cDNA并置于-20℃保存備用。
引物設計、內參基因的擴增及PCR產物純化從NCBI數據庫獲得多刺裸腹溞三個內參基因β-actin、16S rRNA和12S rRNA的CDS序列, 并利用Primer 3軟件設計了特異性引物(表1)。以不同濃度苯酚處理樣品的cDNA等量混合物為模板,擴增反應條件為94℃預變性3min, 94℃變性30s,60℃退火30s, 72℃延伸1min, 35個循環, 72℃延伸8min。將PCR擴增產物按照SanPrep柱式DNA膠回收試劑盒(上海生工提供)方法進行兩輪回收, 得到三個純化的PCR產物作為標準品, 用分光光度計檢測標準品濃度, 并送公司測序(上海生工)。
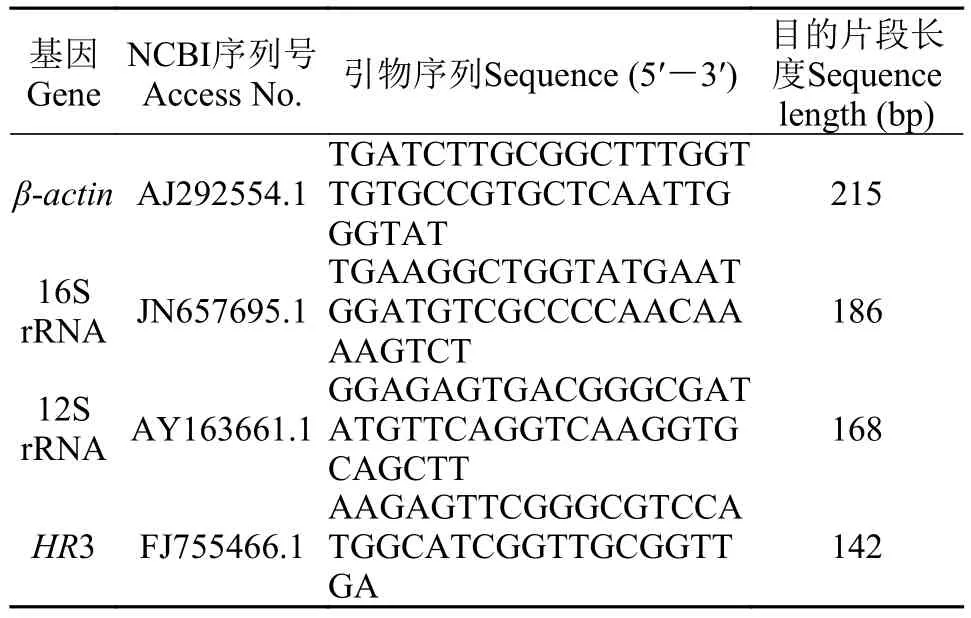
表1 候選內參基因的引物序列Tab. 1 Primer sequences of candidate reference genes
實時定量PCR分析參照EvaGreen 2×qPCR MasterMix試劑盒(鎮江ABM公司提供)說明書,將純化的三個基因標準品分別稀釋101—107倍為標準溶液作為模板, 利用ABI 7500實時定量PCR系統對三個內參基因進行實時定量PCR分析。反應體系為15 μL, 反應條件: 50℃ 2min, 94℃ 10min; 40個循環: 95℃ 15s, 60℃ 1min。根據循環Ct值和拷貝數制作標準曲線。
標準曲線的建立: 通過標準溶液的濃度, 計算出拷貝數。
拷貝數/μL=6.02×1023(copies/mol)×模板濃度(g/μL)/平均分子量(g/mol)
其中: 平均分子量(MW g/mol)=堿基數(bp)×660 (D/bp)
以拷貝數的對數為橫坐標,Ct值為縱坐標, 制作標準曲線。
以不同濃度苯酚脅迫下的多刺裸腹溞cDNA作為模板, 將三個內參基因和目的基因蛻皮激素接受子3(Hormone receptor 3,HR3)按照以上方法實時定量PCR。HR3基因在多刺裸腹溞中的相對表達量(R)的計算公式如下:R=2-??Ct。
數據處理與分析利用瓊脂糖凝膠電泳技術對總RNA質量和內參基因目的片段進行檢測, 所得結果采用SPSS 17.0軟件進行單因素方差分析(One-Way-ANOVA), 采用Waller-Duncan進行非參數檢驗, 呈現顯著性差異(P<0.05)的整體數據, 繼續采用Tukey HSD檢驗兩組數據之間的統計學差異,所得結果用平均值±標準誤差表示(Mean±SD)。GeNorm根據M(平均表達穩定值)的大小進行穩定性比較,M值越小穩定性越好[15]。NormFinder根據運算出內參基因S(穩定性)分析內參基因表達穩定性,S值越小表示穩定性越好[16]。BestKeeper用于比較內參基因表達穩定性和基因表達水平的軟件,Geo mean (幾何平均數)、SD(標準變異系數)越小穩定性越好[17]。
2 結果
2.1 總RNA質量檢測和內參基因目的片段的擴增
圖1顯示, 在不同濃度的苯酚處理后多刺裸腹溞總RNA樣品條帶清晰, 無降解, 28S rRNA與18S rRNA的亮度比值至少為1:1。定量檢測結果顯示各樣品A260/A280值均在2.0左右, 說明多刺裸腹溞總RNA較完整且純度高, 可以進行后續實驗。用不同濃度苯酚處理后的樣品cDNA等量混合, 分別擴增了β-actin、16S rRNA和12S rRNA的目的DNA片段,瓊脂糖凝膠電泳分析顯示三個內參基因條帶與預期大小一致, 且均為單一條帶(圖2), 而且測序結果也正確。這表明各內參基因的目的條帶正確, 引物具有較好的特異性, 可以用于后續實時定量PCR分析。
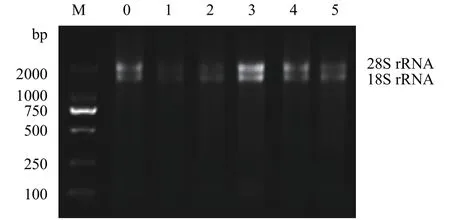
圖1 多刺裸腹溞總RNA瓊脂糖凝膠電泳圖Fig. 1 Agarose gel electrophoresis of total RNA extracted from M. macrocopa
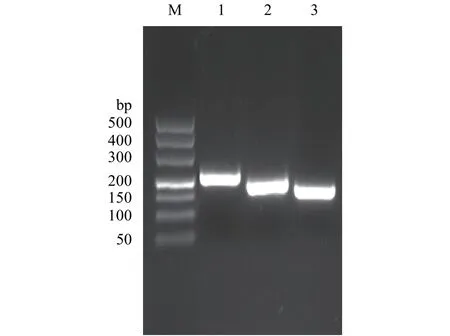
圖2 候選內參基因的表達Fig. 2 PCR products of candidate reference genes
2.2 實時定量PCR分析
圖3為β-actin、16S rRNA和12S rRNA三個內參基因的標準曲線, 相關系數R2分別為0.996,0.998和0.995, 線性關系好, 可靠性高。引物的擴增效率在97.43%—105.54%(表2), 符合實時定量PCR對擴增效率的要求。各個內參基因的熔解曲線有明顯的單一信號峰, 樣品間的重復性高, 在陰性對照中未檢測到熒光信號。表明實時定量PCR反應中模板與引物結合良好, 具有高的特異性。
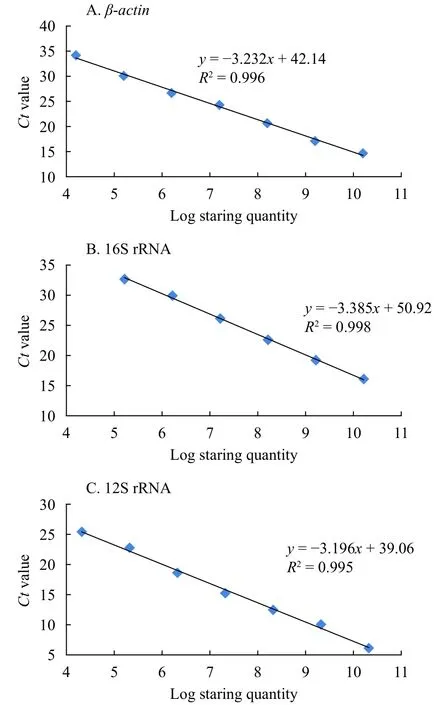
圖3 候選內參基因的標準曲線Fig. 3 Standard curve equation of the candidate reference genes

表2 三個內參基因的相關系數及擴增效率Tab. 2 Correlation coefficient and amplification efficiency of three internal reference genes
2.3 內參基因表達的穩定性分析
內參基因在樣品中的表達水平(Ct值)圖4利用比較Ct值的方法評估各候選內參基因在所有樣本中的表達水平。結果顯示不同苯酚濃度下的β-actin、16S rRNA和12S rRNA的表達無顯著性差異(β-actin,P=0.163; 16S rRNA,P=0.490; 12S rRNA,P=0.165), 表明三個基因均可以作為多刺裸腹溞的內參基因, 并且三個基因的穩定性依次為16S rRNA>12S rRNA>β-actin。
內參基因的GeNorm分析圖5利用GeNorm軟件比較M值確定穩定的內參基因, 結果顯示在苯酚脅迫下, 三個內參基因在多刺裸腹溞中表達穩定性由高到低的順序為16S rRNA=β-actin>12S rRNA。
內參基因的NormFinder分析利用NormFinder軟件對內參基因的穩定性(S值)進行分析(表3), 在苯酚脅迫下, 三個內參基因在多刺裸腹溞中表達穩定性由高到低的順序為16S rRNA>β-actin>12S rRNA。
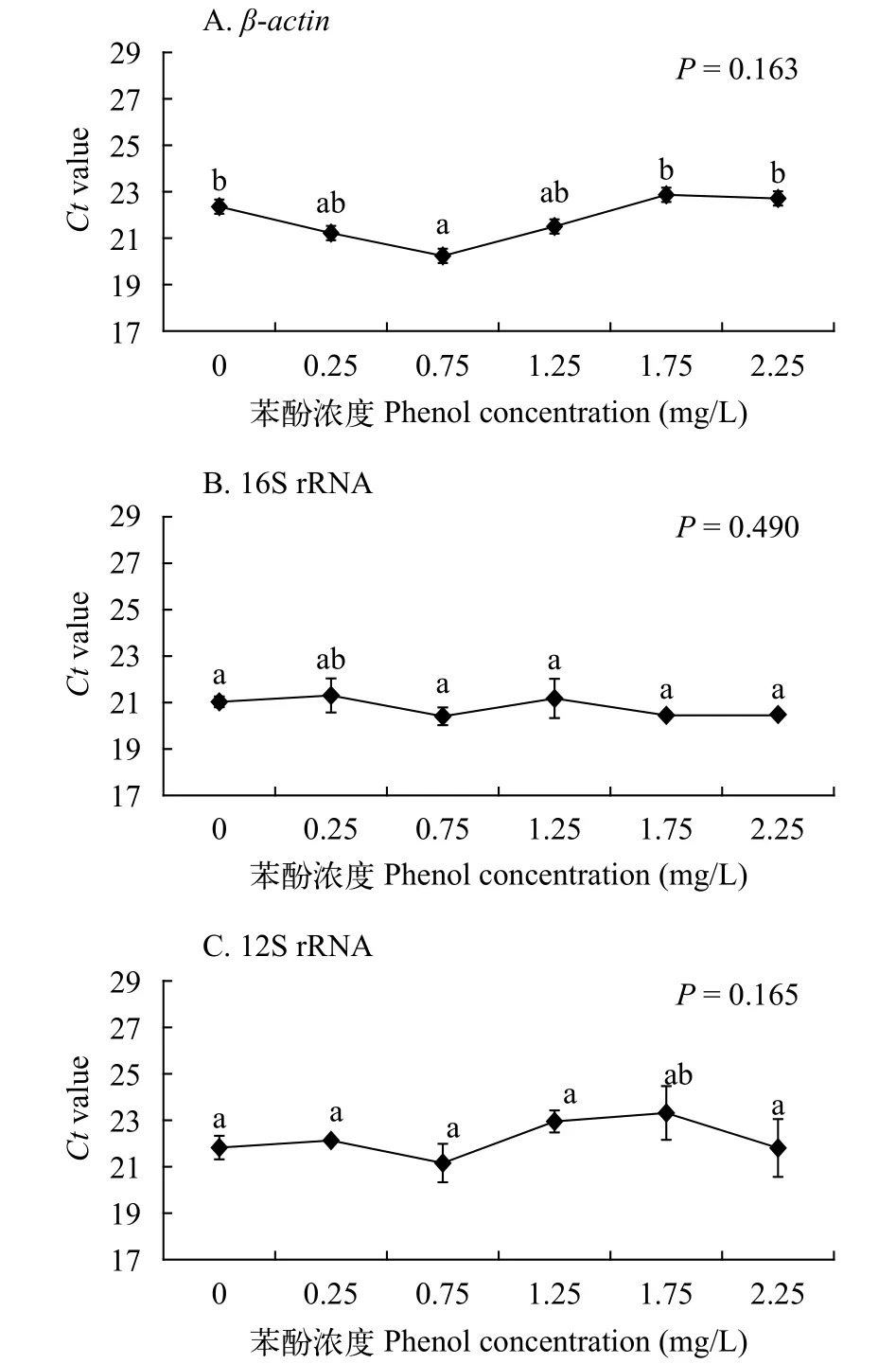
圖4 苯酚脅迫下多刺裸腹溞候選內參基因表達水平(Ct值)Fig. 4 Transcript levels of candidate reference genes of M.macrocopa exposed to phenol
內參基因的Bestkeeper分析Bestkeeper軟件通過參數的大小反映內參基因穩定性差異。該軟件默認的SD值大于1時, 內參基因的穩定性較差。從表4中可以看出, 苯酚脅迫下多刺裸腹溞16S rRNA的SD、Geo Mean、CV、Min和Max在三個內參中值都最小,β-actin的SD次之, 12S rRNA的SD值最大, 所以三個內參基因在多刺裸腹溞中表達穩定性由高到低的順序為16S rRNA>β-actin>12S rRNA, 故16S rRNA為表達最穩定的內參基因。
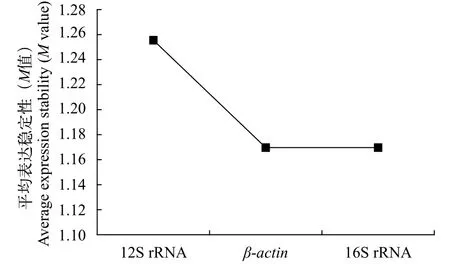
圖5 GeNorm軟件分析候選內參基因穩定性Fig. 5 Stability of candidate reference genes analyzed by GeNorm

表3 NormFinder軟件分析候選內參基因穩定性Tab. 3 Stability of candidate reference genes analyzed by NormFinder

表4 Bestkeeper軟件分析候選內參基因穩定性Tab. 4 Stability of candidate reference genes analyzed by Bestkeeper
苯酚處理后多刺裸腹溞HR3的表達本研究選擇HR3基因評估選定的內參基因對分析目的基因相對表達量的影響。如圖6所示, 隨著苯酚濃度的升高, 多刺裸腹溞的HR3 mRNA水平逐漸下降。在苯酚濃度1.75和2.25 mg/L時,HR3 mRNA的表達量顯著低于對照組(P<0.05)。
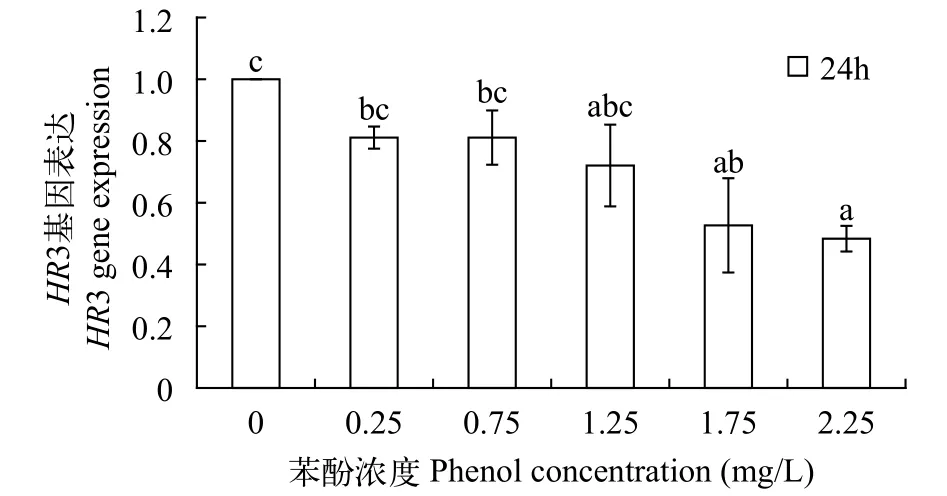
圖6 不同濃度的苯酚脅迫下, 多刺裸腹溞HR3相對于16S rRNA的表達變化Fig. 6 The effect of phenol exposure on the HR3 level of M.macrocopa
3 討論
實時定量PCR技術具有強特異性、高準確性和靈敏度成為轉錄水平檢測目標基因表達的有效方法之一, 因此內參基因的相關研究越來越多[20]。在進行目標基因的相對定量分析中, 穩定的內參基因可以消除因不同樣本引起的RNA提取質量和反轉錄效益上的誤差, 因此, 篩選最適內參基因極為重要, 不穩定的內參基因會直接影響結果的可靠性[21,22]。篩選內參基因需要參考前人研究結果, 然后再篩選穩定表達的常用內參基因, 并做進一步的實驗驗證[23,24]。
本研究選用內參基因的表達水平Ct值、Ge-Norm、NormFinder和Bestkeeper四個常用的分析方法對β-actin、16S rRNA和12S rRNA基因進行穩定性分析。Ct值分析結果顯示苯酚脅迫多刺裸腹溞三個內參基因的穩定性順序為16S rRNA>12S rRNA>β-actin, GeNorm軟件分析的穩定性結果為16S rRNA=β-actin>12S rRNA, NormFinder的結果同Bestkeeper軟件分析結果一致, 穩定性順序為16S rRNA>β-actin>12S rRNA。因此確定16S rRNA作為苯酚脅迫下多刺裸腹溞實時定量PCR最適內參基因。在此基礎上進一步了探討了蛻皮級聯反應中的關鍵因子HR3基因來評估16S rRNA作為內參基因對分析目標基因的相對表達量。研究表明, 節肢動物的生長發育過程中受到污染物脅迫后,HR3表達被抑制, 致使機體不能正常完成蛻皮過程,甚至導致幼蟲死亡[25]。在本研究中, 隨著苯酚濃度的升高,HR3基因表達顯著下調(P<0.05), 與Tao[25]的結果一致。驗證了16S rRNA可以作為苯酚脅迫下多刺裸腹溞實時定量PCR的內參基因。
目前, 在大型溞(Daphnia magna)、蚤狀溞(Daphnia pulex)、隆線溞(Daphnia carinata)、劍水蚤(Tigriopus japonicus)等枝角類中篩選出了在不同實驗條件下表達最為穩定的內參基因[26—29]。研究結果表明, 內參基因β-actin在中華擬同形溞(Daphnia similoides sinensis)中表達較穩定[30], 而在隆線溞中的表達穩定性較差[28]; 18S rRNA在蚤狀溞中能穩定表達[26], 而在大型溞中穩定性較差[29]。在研究三丁基錫對大型溞的毒性作用時, 選擇β-actin和gapdh作為最適內參基因來評估目標基因HR3的表達情況[31]。本研究中16S rRNA為苯酚脅迫下的多刺裸腹溞最適內參基因, 與大型溞、蚤狀溞等的結果不一致, 表明內參基因在不同物種中沒有絕對的通用性。因此, 在相對定量分析目標基因的表達時,內參基因的篩選是十分必要的[32]。
四種方法對三個內參基因的穩定性分析時,Ct值的篩選結果和其他三種方法有部分結果不一致, 這種差異的原因可能是分析的統計學原理不一致造成的[33]。本研究利用實時定量PCR技術, 采用四種常用內參基因穩定性分析法研究了苯酚脅迫下多刺裸腹溞β-actin、16S rRNA和12S rRNA三個基因的表達穩定性, 確定了16S rRNA作為苯酚脅迫下多刺裸腹溞實時定量PCR的最佳內參基因。為后續多刺裸腹溞相關基因的定量表達分析提供了參考依據。
致謝:
感謝實驗室李少欽老師、張左兵老師、劉娜老師和井維鑫老師以及郎朗博士等對實驗的幫助和文章的修改。

