EAMG大鼠動物模型腎上腺免疫相關性研究
王 靜,方麗潔,劉 穎,姜 雄, 況時祥
重癥肌無力(myasthenia gravis,MG)是由乙酰膽堿受體抗體(AchR-Ab)介導的、細胞免疫依賴的、補體參與的、神經-肌肉接頭傳遞功能障礙的、獲得性自身免疫性疾病。該病在世界范圍內的年發病率為8~20/10萬,我國為0.5~2.5/10萬,且呈漸進性升高趨勢,初步估計,我國目前有重癥肌無力患者60萬人。MG病情易于反復,遷延難愈,嚴重者可累及呼吸肌而危及生命。腎上腺皮質激素是治療MG的有效手段。近年來興起的神經免疫內分泌網絡學說認為,神經內分泌系統的下丘腦-垂體-腎上腺(hypothalamus-pituitary-adrenal axis,HPA)軸是腦調控免疫系統的主要傳出通路。HPA軸通過分泌多種神經遞質和細胞因子作用于免疫細胞上的相應受體及細胞因子。推測內分泌系統腎上腺皮質的功能失調或許在MG的發病與復發的機制中發揮了重要作用,而針對腎上腺細胞因子的干預或許能夠在MG的治療上有所突破。我們前期的研究表明,EAMG(experimental autoimmune myasthenia gravis,EAMG)大鼠下丘腦促腎上腺皮質激素釋放激素CRH mRNA(corticotrpin releasing Hormone,CRH)表達明顯異常,且HPA軸的損傷與EAMG發病有密切聯系[1]。為了進一步探究MG發病內分泌相關免疫機制,本研究擬用Lewis大鼠與EAMG大鼠經典模型比較,并通過各組大鼠腎上腺中免疫相關性細胞因子蛋白的表達異常,如干擾素-γ(interferon-γ,IFN-γ)、轉化生長因子-β(transforming growth factor-β,TGF-β)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素-2(interleukin-2,IL-2)、白細胞介素(interleukin-4,IL-4)、白細胞介素-17(interleukin-17,IL-17)等以期闡明其發病機制中的部分環節,為尋找MG治療的作用新靶點提供依據。
1 實驗材料和實驗方法
1.1 實驗動物 SPF級Lewis大鼠36只,雌性,6~8 w齡,體重100~150 g,由北京維通利華實驗動物有限責任公司提供,許可證號:SCXK(京)2012-0001,檢疫后送貴陽中醫學院實驗動物中心,標準大鼠顆粒飼料喂養。
1.2 主要試劑 鼠源性AchR-α亞基97-116肽段序列(R97-116),Sigma公司;完全福氏佐劑(CFA),Sigma公司;不完全福氏佐劑(IFA),Sigma公司;強的松片(規格5 mg/片)(國藥準字H33021027),浙江仙琚制藥股份;大鼠AchR-AbElisa測定試劑盒,上海藍基生物科技有限公司(批號:E02A0203);動物組織總RNA提取試劑盒,天根生化科技有限公司;PrimescriptTM RTreagent Kit、SYBR Premix Ex TaqTMⅡ,引物設計,大連寶生物工程有限公司;Golview Ⅱ核酸染料,北京索萊寶科技有限公司;6×DNA Loading Buffer、DNA Marker,北京康潤誠業生物科技有限公司;單抗3G10和1F3武漢博士德生物工程有限公司;HRP反應底物OPD Amerseco公司;ELISA封閉液(1%BSA),福州邁新生物技術有限公司;兔多克隆抗體(IFN-γ、TGF-β、TNF-α、IL-2、IL-4、IL-17),北京博奧森生物技術有限公司;抗原抗體稀釋液(0.01 mol PBS,pH 7.4) ,福州邁新生物技術有限公司;蘇木素、乙醇伊紅,福州邁新生物技術有限公司;中性樹膠,北京索寶來科技有限公司。
1.3 主要設備儀器 Σ960型全自動酶標儀,美國Metertech公司;T-500型電子天平,美國雙杰兄弟集團有限公司;GS-15R 低溫高速離心機,美國Beckman公司; HJ-2 二聯磁力加熱攪拌器,金壇市億通電子有限公司;玻璃勻漿器,海門市三和建華玻塑儀器廠;DYY-6D型電泳儀,北京市六一儀器廠;Thermo NanoDrop2000紫外分光光度計,美國賽默飛公司;7500Real Time PCR system,美國賽默飛公司;Eio-rad T100PCR儀,美國賽默飛公司;SIM凝膠成像分析系統,美國GOLD-SIM公司;光學顯微鏡,日本OLYMPUS公司。
2 實驗方法
2.1 實驗分組 健康SPF級雌性Lewis大鼠36只,隨機選取24只大鼠進行EAMG造模,另外12只作為對照組,將確定造模成功的大鼠再隨機分為兩組,每組各12只,分別為模型組、強的松組。造模成功2 w后各組分別予以灌胃治療,模型組及對照組(等體積生理鹽水)、強的松組(強的松5.4 mg/kg),大鼠灌胃給藥體積為10 ml/kg,每日一次,連續4 w。
2.2 實驗造模 首先將鼠源性AchR-α亞基97-116肽段序列(R97-116)、完全福氏佐劑(CFA)、磷酸緩沖液(PBS)三者按1∶1.5∶1.5的比例充分混勻制成免疫乳劑;首次免疫:取乳劑200 μl(含R97-116:100 μg)于造模鼠足墊、腹部、背部多點皮下注射,對照組皮下注射等量PBS;首次免疫后30 d及45 d,將R97-116、不完全福氏佐劑(IFA)、PBS三者按1∶3∶3的比例充分混勻制成免疫乳劑后,再取乳劑200 μl(含R97-116:50 μg)強化接種,對照組同樣注射等量PBS。
2.3 各組大鼠的Lennon評分 給藥前和給藥4 w后分別進行行為學觀察,各組大鼠肌力按Lennon分級法將其分為4級:0級:沒有肯定肌無力表現;1級:撕咬無力,四肢力量較差,在光滑地面上前肢打滑,活動減少且易疲勞;2級:明顯無力,休息時脊背呈隆起姿勢,頭尾下垂,大腿外展,前肢趾彎曲,動作笨拙,行走不穩;3級:嚴重無力表現,無嘶咬動作,肌肉震顫,呼吸困難,瀕死或死亡。癥狀居中間者,分別評為0.5、1.5、2.5級。
2.4 EAMG大鼠造模成功的評價 造模結束后,灌胃前,經大鼠內眥靜脈采血以酶聯免疫吸附(enzyme-linked immunosorbent assay,ELISA)法檢測AchR-Ab滴度陽性率。ELISA基本操作步驟如下:用包被緩沖液將捕獲抗體稀釋,每孔100 μl,4 ℃過夜;吸去孔內包被液,PBST洗板,共洗5次,最后兩次用吸水紙拍干;每孔加400 μl 1%BSA,室溫封閉1 h,封閉非特異性結合位點;棄封閉液,每孔加100 μl抗原,置濕盒中,室溫1 h;棄去孔內溶液,同上洗滌拍干;在各反應孔中加入酶標抗體稀釋液100 μl,置濕盒中,室溫1 h;棄去孔內溶液,同上洗滌拍干。于各反應孔中加入顯色液200 μl,避光顯色30 min;各反應孔中加入終止液(1 mol H2SO4)50 μl;結果測定:酶標儀上測讀OD490(A)值。
2.5 RT-Q-PCR檢測腎上腺細胞IFN-γ、TGF-β、TNF-α、IL-2、IL-4、IL-17基因表達量 灌胃4 w后,取出大鼠雙側腎上腺去掉包膜等多余組織放入EP管后,組織總RNA完整性檢測取5 μl RNA樣品+1 μl 6×DNA Loading Buffer進行1.2%瓊脂糖凝膠電泳檢測RNA完整性。電泳結束后在全自動凝膠成像分析系統下觀看,RNA樣品能看到非常明顯的rRNA條帶,28 SrRNA的量約為18 SrRNA的兩倍,說明RNA的完整性較好。每個樣本取1 μl RNA溶液,通過紫外分光光度計吸收測定RNA的濃度并檢測總RNA的純度,確定其高質量(見表1)。在37 ℃、15 min、85 ℃、4 ℃條件下逆轉錄合成cDNA后兩步法進行內參基因與目的基因的實時熒光定量PCR反應:(1)引物序列(見表1)。(2)反應體系20 μl,擴增程序為95 ℃ 30 s、預變性95 ℃ 5 s、60 ℃ 34 s共40個循環,最后為溶解曲線反應階段,反應結束后,采用相對定量比較CT值(△△CT)的方法得到目的基因mRNA表達的相對值。計算公式為:樣品目的基因相對表達量(F)=2-△△CT(△△CT=各樣品的△CT值-對照組平均△CT值),△CT=樣品目的基因的CT值-樣品管家基因的CT值(以β-actin為對照)。(3)反應完畢后對擴增產物進行1.2%瓊脂糖凝膠電泳分析產物。

表1 引物序列
采用SPSS 19.0 統計軟件進行數據處理,數據符合正態分布的用t檢驗,不符合正態分布的使用非參數檢驗,P<0.05為差異有統計學意義
3 實驗結果
3.1 EAMG大鼠行為學表現 EAMG大鼠造模2 w后注射部位逐漸出現炎性反應,表現為足墊紅腫,腹部及背部注射部位局部皮膚泛紅,局部鼠毛干枯、稀疏、脫落,3 w后逐漸出現在光滑地面上行動變慢、前肢打滑,活動減少。4 w后部分EAMG大鼠或因咀嚼無力,或因足部感染,或抬頭無力,而站立取食困難,出現消瘦。灌胃被持捏時背、頸部皮毛松弛,抓籠持續時間縮短,灌胃結束后出現呼吸困難、四肢無力,休息時脊背呈隆起姿勢,頭尾下垂,動作笨拙。可見1只因咀嚼減少門齒過度增生。另外,我們在預實驗時發現,群居大鼠中若出現個別比較虛弱的個體,剩下的相對健壯的大鼠會將其咬死甚至吃掉部分尸體。故灌胃前,我們將肌無力癥狀較重的5只EAMG大鼠單獨喂飼養,以排除因咀嚼吞咽困難而過度虛弱,被其它大鼠咬死而造成非實驗性死亡的可能。灌胃前強的松組及模型組各死亡2只,灌胃結束前模型組死亡2只,共取材30只。
3.2 EAMG大鼠血清AchR-Ab滴度檢測結果 ELISA法檢測大鼠靜脈血血清AchR-Ab滴度陽性率,其中有24只EAMG大鼠結果為陽性,其余大鼠結果均為陰性,陽性率約為66.7%,表明造模成功。
3.3 各組大鼠灌胃前后Lennon評分(見表2)。
3.4 灌胃4 w后各組大鼠血清AchR-Ab含量檢測結果(見表3)。
3.5 RT-Q-PCR檢測腎上腺細胞IFN-γ、TGF-β、TNF-α、IL-2、IL-4、IL-17基因表達量(見表4)。表2可見,灌胃前,EAMG大鼠肌力平均為1.38分,各組EAMG大鼠間評分無統計學差異;灌胃后,EAMG大鼠肌力平均為0.84分。強的松組與模型組比有統計學意義,且顯著高于模型組,說明強的松能夠顯著改善EAMG大鼠肌無力癥狀。表3可見,與對照組大鼠比較,強的松組與模型組EAMG大鼠血清AchR-Ab含量有統計學差異,且顯著高于對照組大鼠,說明造模成功;強的松組與模型組比較AchR-Ab含量有統計學差異,且低于模型組,說明強的松能有效降低血清AchR-Ab含量,進而有效治療MG。表4可見,與對照組比較,模型組大鼠腎上腺中IFN-γ mRNA、TGF-β mRNA、IL-4 mRNA表達減少有統計學意義;而與對照組比較,模型組大鼠腎上腺中TNF-α mRNA、IL-17 mRNA的表達增加有統計學意義,且有顯著差異;與模型組比較,強的松組大鼠腎上腺中IFN-γ mRNA表達減少,且有顯著差異,而強的松組大鼠腎上腺中TGF-β mRNA、IL-4 mRNA、TNF-α mRNA、IL-4 mRNA、IL-17 mRNA的表達增加有統計學意義;在EAMG大鼠腎上腺中沒有IL-2 mRNA的表達。
3.6 PCR產物電泳結果 除IL-2外,各組腎上腺細胞IFN-γ、TGF-β、TNF-α、IL-4、IL-17基因擴增產物電泳均在 Marker 100 bp~250 bp之間,約在200 bp處出現清晰的DNA條帶。相應的位置出現擴增條帶,與擴增產物的堿基數基本相符,故認為其基因在各組大鼠腎上腺組織內均有表達。

表2 各組大鼠灌胃前后Lennon評分比較
與對照組比較△P<0.01;與模型組比較*P<0.05
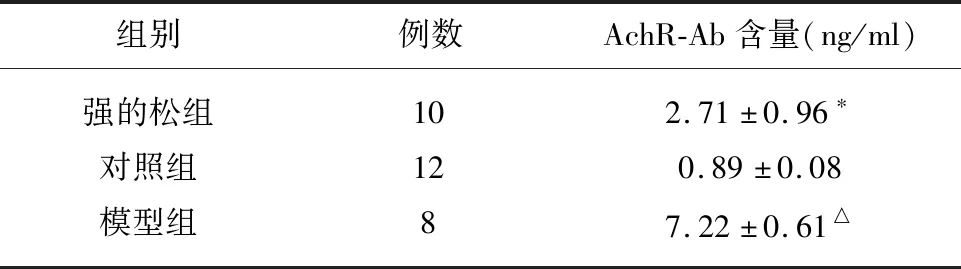
表3 各組大鼠AchR-Ab含量比較
與對照組比較△P<0.01;與模型組比較*P<0.05

表4 腎上腺細胞IFN-γ、TGF-β、TNF-α、IL-2、IL-4、IL-17基因表達量
與對照組比較△P<0.05,△△P<0.01;與模型組比較*P<0.05,**P<0.01
4 討 論
影響EAMG造模成功的因素很多,已有的研究中,EAMG模型常見選用的有Lewis大鼠、Wistar大鼠或Ig轉基因小鼠等,本實驗選取的Lewis大鼠同Wistar大鼠相比具有HPA軸缺陷,我們前期的實驗[1]已證明Lewis大鼠對EAMG的具有易感性。而在張芷熒[2]的研究中,EAMG模型選用的是C57BL/6小鼠,其血清IFN-α、IL-12、IL-17的含量與未造模組無明顯差異,與我們前期的部分實驗結果不一致,我們推測,這可能與C57BL/6小鼠免疫補體活性高、細胞免疫隨增齡而降低且較易誘發免疫耐受性有關。我們認為C57BL/6小鼠免疫特性不如Lewis大鼠更穩定更適合EAMG的內分泌與免疫相關性研究。而AKR小鼠及SJL小鼠未見報道用于EAMG模型研究。Lewis大鼠雖然價格較高但對于研究EAMG是大家公認比較合適的傳統實驗動物。
自身免疫性疾病MG的發病機制涉及體液免疫及細胞免疫的異常、NK/NKT細胞紊亂、樹突狀細胞異常、遺傳及內分泌因素等多種因素。CD4+輔助細胞性T細胞(helper T Cell,Th)在MG的發病中扮演重要角色。Th首先分化為TH0細胞,而后分化為Th1細胞、Th2 細胞、Th3細胞、Th17 細胞4種類型。Th1主要分泌IFN-γ、TNF-α、IL-2;Th2主要分泌TNF-α、IL-4;Th3主要分泌TGF-β;Th17主要分泌IL-17。其中,IL-2、IFN-γ、IL-4、TGF-β、IL-17均能同時作用于T、B淋巴細胞,同時參與細胞免疫與體液免疫。IFN-γ可抑制Th2細胞反應且可與細胞膜上的IFN-γR結合后,通過激活Jak1和Jak2激酶使無活性的信號傳導于活化轉錄因子-1(signal transducer and actlvator of transcription-1,STAT-1)磷酸化為有活性的STAT-1,并使之聚合成二聚體轉運至核內,激活具有抗原提呈功能的主要組織相容性復合物-Ⅱ(MHC-Ⅱ)基因的轉錄及其他轉錄因子的表達[3,4],增強抗原提呈進而促進致病性AChR-Ab產生[5]從而導致MG的發生。
TNF-α可促進胸腺細胞活化及增殖,也可通過誘導抗原遞呈細胞,APC活化,促進產生IL-2和增強活化T細胞表達IL-2R而達到促進T細胞活化及增殖作用[6],促進T細胞活化及增殖作用。姜廣建[7]等的研究結果顯示AchR自身抗原刺激機體免疫系統,使能分泌TNF-α的單核巨噬細胞被激活,從而產生大量的TNF-α,從而使MG患者血清TNF-α水平明顯高于正常。IL-4是Th2細胞分化的特征性細胞因子,能抑制Th1細胞產生細胞因子來抑制細胞免疫,并可以刺激B細胞增殖、活化轉化成漿細胞并表達抗體來增強體液免疫。它是MG免疫誘導早期產生的效應因子,參與了MG免疫啟動過程。已有的研究表明[8],IL-4在發生危象的MG患者外周血中水平極低,血漿置換病情明顯好轉后,IL-4至少增高兩倍以上。也有研究顯示,MG患者的IL-4水平與正常人無差異,胸腺瘤的MG患者IL-4 mRNA表達細胞的數量少于未切除胸腺的患者,發生危象的MG患者IL-4水平更低。因此推測IL-4可能是一種具有保護作用的因子。
TGF-β可由活化的T、B細胞及多種細胞分泌,可抑制B細胞增殖、分化及免疫效應,抑制抗原誘導的T細胞增殖反應,如抑制Th1、Th2細胞的功能,減少相應細胞因子,并能拮抗具有增強免疫活性的細胞因子的功能[9],是對EAMG具有免疫抑制作用的保護性細胞因子。MaCG[10]發現免疫耐受EAMG鼠淋巴器官中經AChR刺激后活化的TGF-β mRNA表達細胞數明顯增加,說明TGF-β在免疫耐受中起免疫抑制功能。重組的TGF-β可抑制MG患者外周血單個核細胞因子中AChR誘導的炎性因子及穿孔素的產生[11]。TGF-β的降低導致受AChR刺激過度活化T、B細胞產生AChR-Ab,從而導致EAMG的發生。IL-17是新型輔助性T細胞Th17細胞的主要細胞因子,可促進T細胞活化,同時刺激上皮、內皮和成纖維細胞,促進產生大量促炎細胞因子[12],從而上調T細胞免疫應答。IL-17還可通過G蛋白Rgs13 和Rgs16調控信號的表達,實現在生發中心導致原始的B細胞積累[13]。
IL-17的增加可導致生發中心免疫應答的增加和B細胞數量的增加。并且,體外通過IL-17刺激,可以誘導AChR特異性B細胞的增加。Soltys等[14]用IgG免疫吸附劑給予重癥肌無力的患者,結果發現重癥肌無力患者嚴重程度有所減輕,檢測治療前后的IL-17水平,發現治療后的IL-17減少。說明在EAMG發病過程中IL-17的增加可同時影響體液免疫和細胞免疫。IL-2是功能復雜并受多種細胞因子調節的具有促進 T、B 細胞增殖、分化和增強NK細胞殺傷毒性作用的細胞因子。一方面,IL-2在效應性T細胞與Treg細胞起負反饋調節作用,效應性T細胞分泌的IL-2能夠維持并激活Foxp3+CD4+CD25+Treg,而Foxp3+CD4+CD25+Treg反過來可以抑制效應性T細胞產生IL-2[15]。魏秀麗等[16]的研究表明,IL-2可誘導Thl細胞增殖及產生INF-γ、激活巨噬細胞、刺激NK細胞、促進B細胞增殖及分泌抗體,起免疫增強作用,IL-2在MG患者血清中呈高表達,且其濃度的高低與AchR-Ab水平、肌無力嚴重程度及胸腺增生的具體情況關系密切。而另一方面,抗IL-2單克隆抗體復合物能夠增強體內調節性T細胞的功能,從而抑制反應性T細胞及B細胞對AchR-Ab的反應,改善肌無力癥狀。
我們推測IL-2 mRNA在EAMG大鼠腎上腺中的未見表達的原因可能有以下幾點:(1)腎上腺中IL-2R亞基組發揮免疫效用是通過與效應細胞膜上的IL-2R結合而發揮作用,高親和力的IL-2R由3種亞基組成:IL-2Rα、IL-2Rβ和 IL-2γ[17]。其中,α亞基不參與信號轉導,且單獨的α亞基或β亞基對IL-2的親和力很低、γ亞基對IL-2的親和力幾乎為零。β和γ亞基結合也只能形成中等親和力的受體,但能結合大量信號分子活化多條信號通路。只有 α、β、γ 三者結合才能產生高親和力的 IL-2R[18]。可能存在于EAMG大鼠腎上腺中的IL-2R僅具備3種亞基中的一部分,因此不能產生高親和力的IL-2R;(2)細胞因子之間的相互作用。可能在EAMG發病前期,TNF-α促進胸腺細胞活化及增殖,也可通過誘導抗原遞呈細胞,APC活化,促進產生IL-2,而后TGF-β的表達降低下調FOXP3的表達,從而通過阻斷多種細胞因子表達所必須的轉錄活化因子NF-κB的活化來抑制IL-2的表達;(3)血清中IL-2R的競爭性結合。sIL-2R是活化的T淋巴細胞膜上IL-2R之一,是T細胞被激活的標志。可能由于MG患者變構的AchR作為自身抗原刺激了機體免疫系統,T細胞被激活后大量表達膜IL-2R,使血清sIL-2R水平升高,與膜IL-2R競爭結合免疫活性細胞周圍的IL-2能力增加,而導致腎上腺中IL-2活性降低;(4)其他內分泌軸相關性。研究發現,MG患者比普通人更容易發生甲狀腺疾病[19~21]。且MG患者中女性發病比例高于男性,結合我們前期的研究表明,MG發病與胸腺的病理改變關系密切[22,23],IL-2在EAMG大鼠外周血中的含量顯著升高[24],我們推測,可能IL-2的表達與神經內分泌網絡中的聯系在下丘腦-垂體-性腺軸或下丘腦-垂體-甲狀腺-胸腺軸中更為顯著,其具體聯系有待進一步研究。IL-2的雙重特性使調控IL-2活性,選擇性地增強Treg細胞功能成為研究的熱點。近年來,基于Treg細胞高親和力IL-2R的本構性表達等特點,出現了多種靶向Treg細胞治療自身免疫性疾病的方法,這些治療方法在臨床試驗和實驗動物模型中均取得了良好的效果,為IL-2治療自身免疫性疾病的新策略提供了新的靶向治療前景[25],其在MG治療中的應用值得期待。
我們的實驗結果表明,腎上腺皮質激素強的松能有效下調IFN-γ mRNA、TNF-α mRNA、IL-17 mRNA在腎上腺的蛋白表達,同時保護腎上腺中IL-4 mRNA,TGF-β mRNA的蛋白表達,這可能是其治療MG的作用機制之一。腎上腺是EAMG的發病過程中的環節之一,我們進而推測MG不僅僅是自身免疫性疾病,發病機制亦涉及內分泌系統的多個層次和環節,針對EAMG內分泌系統的治療值得期待。

