基于AMPK/SIRT1通路探討消溶穩斑方對不穩定斑塊的作用?
邵 靜,蔣 靜
(1.河南中醫藥大學第一附屬醫院,鄭州 450000;2.河南中醫藥大學,鄭州 450000)
動脈粥樣硬化是心腦血管疾病的共同病理基礎,冠狀動脈粥樣硬化易損斑塊破裂、繼發血栓形成是急性冠脈綜合征的主要發病機制[1]。因此,維持動脈粥樣硬化斑塊的穩定性對于心血管疾病的防治有重要意義。動脈粥樣硬化斑塊的破裂是多因素共同作用的結果,其中炎癥反應機制在不穩定斑塊的演變中起重要作用[2]。目前,西醫根據動脈粥樣硬化形成的機制,將治療動脈粥樣硬化的藥物分為降脂藥、抗氧化藥、抗血小板聚集藥及新型PCSK9抑制劑[3],并在臨床得到廣泛應用。雖然對于降脂、穩定斑塊有效,但長期應用存在一定副作用,如肝損傷、肌溶解、局部不良反應等[4]。中醫藥在防治動脈粥樣硬化不穩定斑塊方面的研究已取得新進展,中醫認為動脈粥樣硬化的形成與痰濁和瘀血等病理產物密切相關,主張從痰論治、從瘀論治[5]。研究發現,清熱解毒類、活血化瘀類中藥有一定的降脂、穩定斑塊的作用[6-7],越來越多的中藥被應用于抗動脈粥樣硬化疾病。結合多年臨床經驗,筆者以“益氣活血,化痰通絡”為法自擬消溶穩斑方,通過團隊的前期研究發現,消溶穩斑方在改善不穩定型心絞痛、增加心肌血供等方面有較好的療效[8],故本研究擬在前期研究的基礎上,通過建立小鼠主動脈弓動脈粥樣硬化易損斑塊模型,基于腺苷酸活化蛋白激酶(AMPK)與沉默信息調節因子1(SIRT1)信號通路,檢測消溶穩斑方對動脈粥樣硬化小鼠磷酸化腺苷酸活化蛋白激酶(P-AMPK)、SIRT1蛋白表達及相關炎癥因子水平的影響,探討消溶穩斑方防治不穩定斑塊的作用機制。
1 材料與方法
1.1 動物與材料
1.1.1 動物 6周齡雄性ApoE基因敲除小鼠48只與 C57BL/6 J小鼠16只,購自河南省實驗動物中心。本實驗已通過河南中醫藥大學實驗動物倫理委員會審查。
1.1.2 主要試劑 β-actin單克隆抗體(SANTA,SC-47778)、P-AMPKα(Thr172)抗體(CST,2535T)、AMPKα抗體(CST,5832T)、SIRT1抗體(peprotech,60303-1-Ig)、eECL Western Blot Kit高靈敏度化學發光檢測試劑盒均購自北京康為世紀生物科技有限公司,CW0049;HE染色試劑盒購自武漢伊萊瑞特生物科技股份有限公司;PVDF膜購自MILLIPORE公司;脫脂奶粉(OXOID,lp0031)、Tris堿(AMRESCO,0497-500G)、甘氨酸(AMRESCO,M103-1KG)、十二烷基硫酸鈉(AMRESCO,M107-250G)、丙烯酰胺(AMRESCO,M104-50G)、N,N’-亞甲叉丙烯酰胺(AMRESCO,M8200 N)、過硫酸銨(AMRESCO,0486-100G)、四甲基乙二胺(Sigma,T9281-25ML)、溴酚藍(AMRESCO,0449-100G)。
1.1.3 實驗儀器 DYY-6C型電泳儀,BIO-RAD Mini-TRANS-BLOT CELL,DYCZ-24DN型迷你雙垂直電泳槽,TS-1脫色搖床(太倉市實驗設備廠),生物分子成像儀(日本富士LAS-4000 MINI),低溫高速離心機(日立,CF16RXⅡ)、全波長掃描式多功能讀數儀(Thermo fisher)、倒置相差顯微鏡(日本 OLYMPUS)、冰箱BCD-233 GB(青島海爾股份有限公司)、37 ℃恒溫培養箱(北京福意電器有限公司)、包埋機(科迪儀器設備有限公司,KD-BM)、切片機(德國Leica公司,RM2126)。
1.2 實驗所需藥物
瑞舒伐他汀鈣片(阿斯利康藥業(中國)有限公司,批準文號:國藥準字J20170008);消溶穩斑方(黃芪 15 g,葛根 15 g,半夏 10 g,水蛭 10 g,佛手 15 g,郁金 15 g,地龍 15 g,甘松 10 g)浸膏。浸膏的制備:首先將中藥郁金、地龍、水蛭飲片研磨成粉,佛手、甘松含揮發油成分,分別采用水蒸氣蒸餾法收集揮發油,各自另存備用。將佛手、甘松的藥渣與黃芪、葛根、半夏加水煎煮2次,每次用時1 h,將2次煎得的藥汁混勻,然后過濾,將濾液減壓濃縮至相對密度2.1 g/ml 的稠膏,加入水蛭、郁金、地龍粉末混合均勻即可。
1.3 分組及藥物干預
C57BL/6 J小鼠16只和ApoE基因敲除小鼠48只分別給予標準飼料和高脂飼料,持續喂養8周后,進入藥物干預期分為8組:C57+標準+水組、C57+高脂+水組、ApoE+標準+水組均給予灌服等量蒸餾水,持續4周;ApoE+高脂+他汀組按2.5 mg/(kg·d)的比例灌服瑞舒伐他汀鈣片溶液,持續4周;ApoE+高脂+消溶穩斑方低、中、高劑量組分別按照體質量60 kg成人劑量的5、10、20倍給藥濃度,灌服消溶穩斑方溶液(消溶穩斑方浸膏加入蒸餾水溶解),持續4周。
1.4 取材與HE染色
腹腔注射水合氯醛進行麻醉,麻醉成功后剃毛、消毒,切開腹部皮膚及腹肌分離血管外脂肪組織,沿腹主動脈背部正中線剪開,取血5 ml留置2管,分離血清保存在-80 ℃低溫冰箱備用。采用ELISA法檢測IL-6、CRP、TNF-α的表達;手術剪開胸充分暴露內臟和胸部,止血鉗鈍性分離找到主動脈弓,取0.5 cm主動脈弓放到消毒皿,磷酸鹽緩沖液(PBS)清洗干凈,4%多聚甲醛固定2 d后取出主動脈弓組織脫水、透明、浸蠟包埋、石蠟包塊切片、脫蠟處理、蘇木精染色,透明與固定步驟對主動脈弓組織進行HE染色,光鏡下觀察主動脈弓形態。
1.5 p-AMPK、SIRT1水平測定
采用Western Blot 法測定小鼠主動脈弓組織蛋白中p-AMPK、Sirt1蛋白表達量。將主動脈弓組織取出,吸除培養基,采用 PBS(4 ℃)洗2遍,加入適量組織蛋白裂解液后提取總蛋白,BCA法檢測蛋白濃度,行SDS-PAGE電泳分析,電泳(8 V/cm,進入分離膠后提至15 V/cm)后行蛋白質轉膜,待轉膜結束后將標記的PVDF 膜室溫下放在封閉液中振搖封閉2 h。棄去封閉液,分別采用內參蛋白和目的蛋白一抗進行雜交,于4 ℃中反應過夜。取出PVDF膜TBST 漂洗10 min,重復3次。以1∶1000 稀釋的HRP標記的山羊抗兔IgG作為二抗,室溫振搖反應1 h。取出PVDF膜TBST漂洗,在濾紙上瀝干液體,再將PVDF膜浸入發光液中室溫孵育3 min進行曝光照相。
1.6 統計學方法
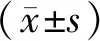
2 結果
2.1 光鏡下觀察各組小鼠主動脈弓粥樣硬化斑塊情況
圖1示:C57+標準+水組:如箭頭所示,主動脈弓三層結構及層次完整清晰,內皮細胞整體結構光滑完整,未見明顯增生,中膜可見排列整齊的梭狀平滑肌細胞,彈力纖維呈現環狀結構,結構完整,由結締組織構成的外膜結構疏松單薄,可見少量平滑肌細胞,管腔未見明顯斑塊;C57+高脂+水組:如箭頭所示,主動脈弓結構形態紊亂,血管內皮連續性損害,內膜增厚,內膜下可見泡沫細胞及脂質沉積,彈力纖維環出現斷裂,管腔內未見明顯粥樣斑塊形成;ApoE+標準+水組:主動脈弓結構形態紊亂,血管內皮出現連續性損害,內膜增厚,內皮細胞損傷,炎性細胞聚集,泡沫細胞及脂質沉積于內膜下,彈力纖維環狀結構破環,管腔內可見粥樣斑塊形成;ApoE+高脂+水組:如箭頭所示,主動脈弓病變明顯,血管內皮結構形態紊亂并連續性受損害,內膜增厚明顯,可見平滑肌細胞增殖和遷移形成纖維帽,多處有粥樣斑塊形成,大量脂質斑塊及泡沫細胞積聚,炎癥細胞局部浸潤,形成易損斑塊,斑塊向管腔內突起;ApoE+高脂+他汀組:如箭頭所示,主動脈弓病變較ApoE+高脂+水組減輕,血管內膜中膜增厚,可見泡沫細胞以及脂質,動脈粥樣斑塊較ApoE+高脂+水組明顯減小;ApoE+高脂+中藥低劑量組:箭頭所示,大部分小鼠主動脈弓血管內皮結構紊亂,內膜明顯增厚,部分撕裂,血管壁相對完整,多處形成動脈粥樣斑塊,斑塊內可見泡沫細胞、脂質沉積;ApoE+高脂+中藥中劑量組:如箭頭所示,主動脈弓病變較ApoE+高脂+水組減輕,內膜增厚明顯,泡沫細胞及脂質沉積于內膜下;ApoE+高脂+中藥高劑量組:如箭頭所示,主動脈弓病變較ApoE+高脂+水組減輕,血管內膜增厚,結構紊亂,內膜下可見泡沫細胞、脂質沉積,動脈粥樣斑塊較ApoE+高脂+水組明顯減小。本研究發現,各組主動脈血管壁呈動脈粥樣硬化內皮損傷改變,其中經藥物干預的消溶穩斑方低、中、高劑量組及他汀組病理改變較ApoE+高脂+水組減輕,而他汀組與消溶穩斑方組病理改變程度相當。

注:1.C57+標準+水組;2.C57+高脂+水組;3.Apoe+標準+水組;4.Apoe+高脂+水組;5.ApoE+高脂+他汀組;6.ApoE+高脂+中藥低劑量組;7.ApoE+高脂+中藥中劑量組;8.ApoE+高脂+中藥高劑量組圖1 各組小鼠主動脈弓粥樣硬化斑塊情況比較(40×)
2.2 各組小鼠主動脈弓p-AMPK、SIRT1蛋白水平
圖2示,凝膠電泳后所得各組蛋白條帶的灰度值,以灰度值的強弱來表示p- AMPK、SIRT1蛋白表達的相對強度。表1示,不同組別p-AMPK、SIRT1蛋白水平與C57+標準+水組比較,C57+高脂+水組p-AMPK、SIRT1水平均降低,差異有統計學意義(P<0.05)。與ApoE+高脂+水組比較,ApoE+高脂+他汀組、ApoE+高脂+中藥低、中、高劑量組p-AMPK、SIRT1水平均升高(P<0.05)。與ApoE+高脂+他汀組比較,ApoE+高脂+中藥低、中、高劑量組p-AMPK、SIRT1水平不同程度降低(P<0.05),差異有統計學意義。

表1 不同組別小鼠主動脈弓p-AMPK、SIRT1水平比較
2.3 各組小鼠血清炎癥因子TNF-α、IL-6、CRP水平
表2示,與C57+標準+水組比較,ApoE+高脂+水組TNF-ɑ、IL-6、CRP水平均升高(P<0.05);與ApoE+高脂+水組比較,ApoE+高脂+他汀組、ApoE+高脂+中藥低、中、高劑量組TNF-ɑ、IL-6、CRP值均降低(P<0.05)。與ApoE+高脂+他汀組比較,ApoE+高脂+中藥低、中劑量組TNF-ɑ、IL-6、CRP值均升高(P<0.05),差異有統計學意義。

注:1.C57+標準+水組;2.C57+高脂+水組;3.Apoe+標準+水組;4.Apoe+高脂+水組;5.ApoE+高脂+他汀組;6.ApoE+高脂+中藥低劑量組;7.ApoE+高脂+中藥中劑量組;8.ApoE+高脂+中藥高劑量組圖2 各組小鼠主動脈弓組織AMPK、p-AMPK、SIRT1蛋白條帶比較

表2 各組小鼠血清CRP、TNF-ɑ、IL-6濃度值比較
3 討論
動脈粥樣硬化屬于中醫學“厥證”“中風”“眩暈”“頭痛”“癡呆”“中風”“胸痹”等范疇[9]。本病病機總以本虛標實為主,本虛則尤以肝脾腎三臟虧虛為主,標實尤多見痰濁、血瘀、濕熱蘊蒸等。中醫主張從痰濁、血瘀論治本病。現代醫學研究發現,中醫痰濁證、血瘀證的證候積分分別與患者的低密度脂蛋白、膽固醇水平、全血黏度存在正相關關系,證實高脂血癥與痰濁、血瘀的關系密切。結合多年臨床診療經驗,筆者認為張仲景所提“陽微陰弦”是對本病病機的最好概括。陽微陰弦所指不僅為寸口脈微尺中脈弦,于本病而言更多是指本虛標實、陽微乃本虛也,即臟腑虧虛為發病之本,陰弦為標實,即寒、痰、瘀互結為標。本病病在血脈而根于臟腑,故以“益氣活血,化瘀通脈”為法自擬消溶穩斑方。
消溶穩斑方由黃芪、葛根、水蛭、地龍、佛手、郁金、半夏、甘松等藥物組成。方中以黃芪、葛根為君藥,有補益氣血、通調血脈、活血通脈之功。張志鑫等[10]通過實驗研究發現,黃芪含有的黃芪甲苷成分,具有調節脂質代謝、抗炎穩斑作用。具體機制與黃芪甲苷成分能夠調控組織相關蛋白表達及炎癥基因轉錄有關。呼海濤等[11]研究發現,中藥成分葛根素具有抗動脈粥樣硬化作用,其作用機制是葛根素調節血管內膜依賴性舒張因子,降低甘油三酯和低密度脂蛋白水平,實現對損傷的血管內皮細胞保護,同時還能抑制機體高脂狀態引發的血管平滑肌細胞過度增生。萬強等[12]研究證實,中藥成分葛根素可通過降低人體內臟脂肪素水平,以實現對血脂水平的調控。此外,葛根素亦可通過上調炎癥因子釋放閾值,發揮抗炎穩斑作用。總之,中藥葛根的化學成分復雜,其抗動脈粥樣硬化作用并不單一,常常是通過多細胞、多靶點、多因素的共同作用,體現了中醫藥治療本病的優勢。方中以水蛭、地龍、郁金為臣,三藥合用具有清熱涼血散瘀之效,與君藥益氣活血通脈之功相輔相成。關于水蛭的最新研究發現[13],水蛭素與凝血酶具有極高的親和性,極低劑量下就能夠快速地將凝血酶中和,阻止纖維蛋白原的轉換,具有強效抗凝作用。同時,水蛭素還可以抑制高凝態、高脂、長期慢性炎癥等引發的血管平滑肌細胞增殖及巨噬細胞趨化,而發揮抗動脈粥樣硬化的作用。方中以佛手、甘松為佐助君行氣,其中甘松臨床常用于胸痹心痛的治療,具有良好的行氣止痛之功。現代藥理研究證實[14],甘松提取物中的多糖、總黃酮等成分參與調控機體的氧化酶活性,具有抗脂質過氧化的作用。方中半夏是恐氣虛而有痰濁之邪留滯為患,取其祛痰下氣之功。全方謹守益氣活血、化瘀通脈之法,兼顧祛痰化濁,使陰陽氣血平和、氣血得補、痰瘀得化、血脈自通。
AMPK/SIRT1是調節機體能量代謝、維持內環境穩定的關鍵調節蛋白,AMPK是參與協調體內多種代謝過程的一種蛋白激酶,也被稱作是細胞能量感受器[15]。AMPK的激活是使其磷酸化,p-AMPK通過促進巨噬細胞脂質外流、增加機體對氧化低密度脂蛋白(OX-LDL)的吸收,減少泡沫細胞形成,保護血管內皮,減少斑塊形成,延緩動脈粥樣硬化進程[16]。SIRT1通過去乙酰化作用抑制因子的轉錄,下調脂肪存儲基因轉錄,增加脂肪代謝速度。研究發現,SIRT1可以改善胰島素抵抗,減少活性氧生成,防御氧化應激和炎癥反應。SIRT1通過去乙酰化使核因子(NF-KB)失活,抑制炎癥基因轉錄[17]。另外,活化的AMPK通過激活去乙酰化酶,增加SIRT1表達。SIRT1可使核因子NF-KB去乙酰化而失活,提高機體炎癥因子釋放閾值,從而抑制炎癥反應。
本研究發現,消溶穩斑方可使小鼠主動脈弓不穩定斑塊內的AMPK蛋白被更多地激活,轉變為磷酸化的AMPK,同時使SIRT1的表達增加,炎癥因子TNF-α、CRP、IL-6水平降低。現代醫學研究證實,AMPK磷酸化水平升高后會上調位于其下游的調控蛋白SIRT1表達,SIRT1蛋白表達增多可抑制轉錄因子NF-κB的去乙酰化反應,從而降低其活性,抑制炎癥基因的轉錄,抑制TNF-α、CRP、IL-6等炎性因子的釋放。經過本實驗可以推斷,消溶穩斑方可能是通過上調AMPK/SIRT1通路中AMPK磷酸化水平及SIRT1的表達,發揮其抑制斑塊炎癥反應,減少泡沫細胞及脂質沉積,保護血管內皮,穩定易損斑塊,延緩動脈粥樣硬化進展的作用。后續的研究擬在中藥多靶點作用的基礎上,進一步探討消溶穩斑方抗動脈粥樣硬化的相關通路或起效機制。

