大黃素干預慢性壓迫性損傷模型髓鞘蛋白表達的研究?
陳 鵬,王 琛,張 冕,渠景連,王文靜,吳智兵,3△
(1.貴州中醫藥大學,貴陽 550025;2.廣州中醫藥大學,廣州 510405;3.廣州中醫藥大學第一附屬醫院,廣州 510405)
神經病理性疼痛(neuropathic pain,NP)在普通人群中患病率約為6.9%~10%[1],其造成的異常性疼痛、痛覺過敏及自發性疼痛嚴重影響患者的日常生活及行為功能,給社會造成巨大的經濟和醫療負擔[2-4]。目前治療NP的抗癲癇、抗焦慮及阿片類藥物臨床效果有限,存在頭暈、嗜睡甚至引發心律失常等嚴重不良反應[5-7]。大黃素為中藥大黃的主要有效成分,屬于天然的蒽醌類衍生物。在前期研究中我們發現,中劑量(50 mg/kg)大黃素能顯著改善神經病理性疼痛CCI模型實驗大鼠自發性疼痛,緩解機械及熱痛覺過敏表現[8]。事實上,外周神經損傷后引發華勒氏變性并啟動自我破壞程序是NP形成的重要原因,同時近年來越來越多研究認為大黃素能夠通過干預多種不同的信號通路,從而在神經系統疾病形成過程中發揮神經保護作用[9]。故本實驗擬探究大黃素干預下CCI大鼠脊髓組織中MBP、MPZ表達情況,明確大黃素是否通過調節髓鞘再生作用達到緩解疼痛的效果。
1 材料與方法
1.1 試劑及儀器
SPF級7周齡雄性大鼠30只,由廣州中醫藥大學動物實驗中心提供,生產許可證號SCXK(粵)2013-0034。動物飼養于廣州中醫藥大學第一附屬醫院SPF級動物實驗室。本實驗已通過廣州中醫藥大學第一附屬醫院動物使用與倫理委員會審查。一抗MBP兔抗、MPZ兔抗以及山羊抗兔二抗均購自美國Proteintech公司,貨號分別為10458-1-AP、10572-1-AP、12472-1-AP、SA00001-2;PCR反應所需試劑SYBR?Premix Ex TaqTM(Tli RNaseH Plus)購自日本TAKARA公司。本實驗所用熱輻射測痛儀器、Von Frey電子測痛儀購自美國IITC-Life Science公司;伯樂ChemiDocTMMP全能型成像系統以及7500PCR儀購自美國Bio-Rad公司。
1.2 動物模型與分組
將30只SD大鼠按照隨機數字表法分為假手術組、CCI組及大黃素組各10只,按照Bennett和Xie創立的手術方法制作CCI模型[10]。術前各組大鼠腹腔注射戊巴比妥鈉(50 mg/kg)麻醉,切開其左下肢中段皮膚,逐層分離肌肉后暴露坐骨神經,用4-0絲線在坐骨神經主干做4道結扎,間距為1~2 mm,力度以神經微微塌陷為宜。假手術組大鼠暴露坐骨神經后不結扎,完成操作后分層縫合肌肉及皮膚,安爾碘消毒。大黃素組于造模后第1天每日灌胃1次,連續15 d,給藥量為50 mg/kg,實驗期間各組大鼠正常進食飲水。
1.3 行為學檢測
參照文獻,于術前及術后第3、7、11及15天用電子測痛儀及熱輻射儀對不同組大鼠進行MWT及TWL值測定[11-13]。MWT及TWL值均重復測量5次,間隔5 min取平均值。
1.4 樣品制備
術后15 d行為學測試結束后,將所有大鼠麻醉后取L4-L6損傷側脊髓置于-80 ℃超低溫冰箱中待檢。
1.5 Western blot法檢測
按照BCA試劑盒說明書對脊髓組織中提取的蛋白濃度進行測定,配制SDS-PAGE膠后開始加樣。取30 ul樣品緩慢加入樣品孔中,用80 V進行濃縮膠電泳45 min,120 V在分離膠中電泳45 min,200 mA轉膜120 min。膜浸在脫脂奶粉中室溫封閉1 h;將膜取出直接放入一抗(1∶1000)中,4 ℃反應過夜;TBST洗膜,10 min×3次;將膜轉入二抗(1∶40000)中,37 ℃反應1 h;PBST洗膜,10 min×3次;用化學發光法顯影。ChemiDocTMMP全能型成像系統拍照。Gel Pro32軟件分析不同條帶灰度值進行統計分析處理。
1.6 RT-PCR檢測
表1示,Trizol法提取總RNA,逆轉錄成cDNA,以cDNA為模板,選擇RT-PCR反應的操作方法測定特異性mRNA的表達水平。使用SYBR?Premix Ex TaqTM(Tli RNaseH Plus)進行PCR定量反應,采用PRIMER5軟件/NCBI在線設計合成引物。各組樣本的目的基因表達水平以相應GAPDH作為參照,最終采用2-ΔΔCT計算目的基因,相對于內參基因GAPDH的相對表達量。

表1 目的基因引物序列
1.7 統計學方法

2 結果
2.1 行為學檢測結果
造模后各組實驗大鼠一般狀況良好,可自由飲水、進食及活動,毛發整潔,術側肢體未見感染及滲液,無自噬行為。結合現有文獻及前期預實驗結果,于術后第3天評判模型成功與否。本課題組前期進行大量探索,模型成功率達85%以上[10]。
2.1.1 MWT值測定 表2示,與術前基線值比較,術后第3天CCI模型組及大黃素組實驗大鼠MWT值下降幅度為27.41%及23.57%,出現機械痛覺過敏,與既往文獻報道基本相符[10];與假手術組比較差異有統計學意義(P<0.01)。于術后第11天開始,大黃素組MWT值較前升高,與CCI模型組比較差異有統計學意義(P<0.01),說明大黃素能夠緩解CCI大鼠機械痛覺過敏。

表2 MWT值測定結果
2.1.2 TWL值測定 表3示,與術前基線值比較,術后第3天模型組及大黃素組大鼠TWL值下降幅度為48.68%及41.03%,出現較為嚴重的熱痛覺過敏;與假手術組比較差異有統計學意義(P<0.01)。于術后第11天開始,大黃素組TWL值較前升高,與CCI模型組比較差異有統計學意義,說明大黃素能緩解CCI大鼠熱痛覺過敏。

表3 TWL值測定結果
2.2 RT-PCR技術檢測脊髓組織中MBP、MPZ mRNA
圖1示,與假手術組比較,模型組中MBP及MPZ表達水平顯著降低,差異有統計學意義(P<0.05);與模型組比較,大黃素組實驗大鼠脊髓組織中MBP及MPZ表達均升高(P<0.05)。
2.3 Western blot法脊髓組織MBP及MPZ蛋白表達
圖2示,與假手術組比較,模型組中MBP及MPZ蛋白表達水平顯著降低,差異有統計學意義(P<0.05);與模型組比較,大黃素組實驗大鼠脊髓組織中MBP及MPZ表達均升高(P<0.05)。

注:與假手術組比較:*P<0.05,**P<0.01;與模型組比較:#P<0.05,##P<0.01圖1 脊髓組織MBP及MPZ mRNA轉錄水平比較
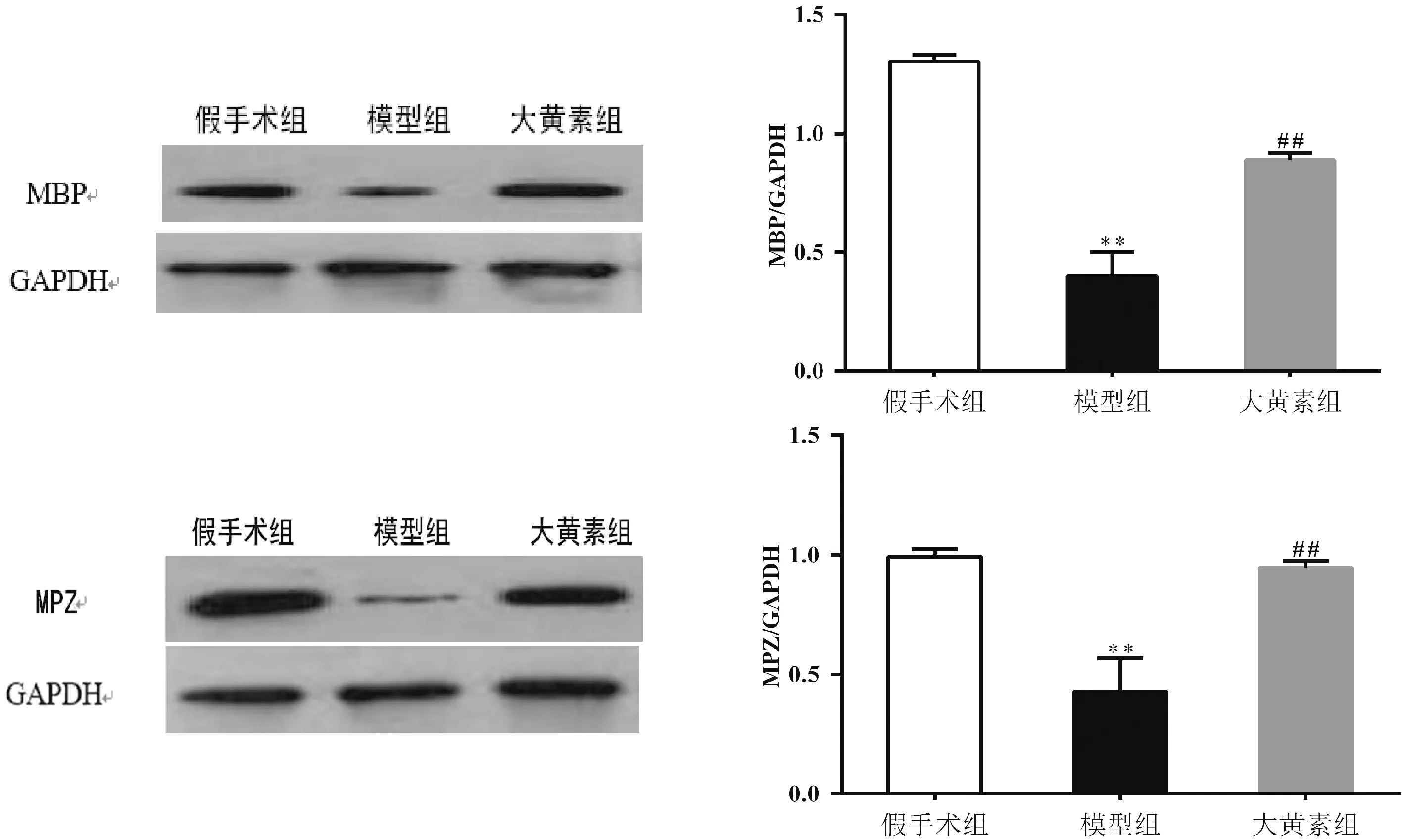
注:與假手術組比較:*P<0.05,**P<0.01;與模型組比較:#P<0.05,##P<0.01圖2 脊髓組織MBP及MPZ 蛋白表達水平比較
3 討論
神經損傷是NP形成的重要原因。早期研究已證實,損傷后相關神經出現華勒氏變性并啟動自我破壞程序,這一機制是神經病理性疼痛形成的重要組成部分[14]。而目前研究表明,神經系統中膠質細胞凋亡形成脫髓鞘改變,髓鞘蛋白崩解使軸索失去保護作用,進而通過干預興奮性電位的形成產生痛感。這種信號傳導障礙與中醫理論中疼痛形成 “不通則痛”病因病機有一定的相似之處,與之相對應的是中藥“活血祛瘀”治則。
大黃素是具有活血化瘀、通暢氣機作用的中藥大黃的主要成分之一。一些研究者發現,大黃素通過調節神經元凋亡及膠質細胞活性發揮抗炎作用。如在糖氧剝奪時大黃素可通過激活素A/Smads信號途徑的活化下調Caspase-3表達來抑制神經元凋亡;而在脂多糖誘導的膠質細胞中,可激活AMPK/Nrf2通路,降低IL-6、TNF-α等炎癥因子表達[15-16]。我們前期研究已發現,大黃素能夠顯著改善神經病理性疼痛CCI大鼠自發性疼痛及痛覺過敏表現,且50 mg/kg為優效劑量[8]。而本研究則進一步發現,大黃素能夠顯著上調CCI模型實驗大鼠脊髓組織MBP及MPZ表達,促進髓鞘修復與再生,從而緩解疼痛。
髓鞘主要由神經膠質細胞構成,是包裹在神經軸索外的一層膜結構。中樞神經系統髓鞘由少突膠質細胞構成,周圍神經系統則由施旺氏細胞構成,起到絕緣作用并有保護軸突作用,還能夠提高神經沖動的傳導速度。神經損傷后,由于內質網途徑、氧化應激反應、谷氨酸興奮毒性及炎癥反應等多條不同信號途徑激活后,會引起神經纖維退化并產生脫髓鞘改變,甚至神經元的凋亡[17-18]。
中樞神經系統含量最多的髓鞘蛋白MBP可由少突膠質細胞合成,能夠維持髓鞘結構的穩定性和緊密性。實驗研究已證實,在多種不同的NP模型脊髓組織中,MBP表達呈下調趨勢[19-20]。本實驗結果顯示,模型組中MBP蛋白及其mRNA表達水平均較假手術組出現顯著降低,而大黃素治療組則出現升高,這一趨勢的形成可能與神經損傷引起少突膠質細胞凋亡有關,而大黃素則可能通過抑制細胞凋亡提高MBP表達。MPZ也常被稱為P0蛋白,主要由施旺氏細胞合成,因此被認為是施旺氏細胞的特殊標記蛋白,通過其本身的細胞黏附分子屬性在維持髓鞘多層結構及緊密性中發揮關鍵作用[21]。P0蛋白在脫髓鞘作用激活后大量表達,并且當神經軸索出現華勒氏變性時出現降低,而在髓鞘再生的時候表達升高。盡管關于P0蛋白的中樞機制研究有限,但有多項研究結果證明,神經損傷后除外周神經、背根神經節中P0蛋白表達量出現下降外,NP大鼠脊髓中MPZ蛋白及其mRNA表達量也較對照組出現下降[22-24]。本次實驗結果中,CCI模型后脊髓組織中MPZ較假手術組顯著降低,而大黃素能夠提高MPZ的表達水平,促進髓鞘再生,緩解神經病理性疼痛。
綜上所述,本實驗使用雄性SD大鼠建立NP中經典的CCI模型。前期研究結果及行為學測試提示,大黃素具有改善CCI大鼠痛覺過敏的作用,而結合本文的研究結果考慮其作用機制可能與升高髓鞘相關蛋白MBP和P0蛋白有關,并產生神經保護作用,從而改善大鼠對疼痛刺激過敏的反應。可見,大黃素可以作為具有研究潛力的防治NP藥物。

