人類TBC1D7蛋白的表達純化及其在mTOR通路中的作用機制研究
蓋中朝, 王 兵
(1.陜西科技大學食品與生物工程學院, 西安 710021; 2.貴州醫科大學生物與醫學工程重點實驗室, 貴陽 550025)
mTOR (mammalian Target of Rapamycin) 信號通路是真核生物細胞中控制分解代謝和合成代謝過程的關鍵通路之一,在細胞生長、增殖和死亡過程中發揮著至關重要的作用[1-3].在mTOR信號通路中,存在兩種由mTOR蛋白組成的核心復合物:mTORC1 (mammalian target of rapamycin complex 1) 和mTORC2 (mammalian target of rapamycin complex 2),前者由mTOR, Raptor, mLST8, Deptor和PRAS40亞基組成,對雷帕霉素較為敏感;后者由mTOR, Rictor, mLST8, mSin1, Deptor和Proctor1/2亞基組成,對雷帕霉素不敏感[4-5].mTORC1主要控制生物大分子的合成代謝和分解代謝、細胞周期調控、細胞生長、細胞自噬等工程;mTORC2主要負責細胞骨架調配、細胞存活和部分細胞代謝過程.mTORC1和mTORC2在空間結構上較為近似,整個復合物以二聚體形式組成一個近似菱形的擬二重軸結構[6-7].
在mTOR信號通路中,TSC(Tuberous Sclerosis Complex)蛋白復合物位于mTORC1上游,且對后者具有負調控作用,TSC復合物由TSC1(Tuberous Sclerosis Complex 1)、TSC2(Tuberous Sclerosis Complex 2)和TBC1D7(TBC1 domain family member 7)三個亞基組成[4, 8].目前已知,TSC復合物與結節性硬化綜合癥有直接聯系,該病多見于皮膚、腦、腎、心臟和肺組織,臨床病理特征表現為面部皮脂腺瘤、癲癇發作和智能減退等[9-11].當前認為,結節性硬化癥的發病原因主要是由于TSC1和TSC2兩個腫瘤抑制基因發生突變所引起,二者所編碼的TSC1、TSC2蛋白和TBC1D7蛋白形成一個穩定的TSC三亞基復合物.人類TBC1D7基因位于6號染色體上,全長TBC1D7蛋白包含293個氨基酸.有研究顯示,TBC1D7基因的突變會導致智障和巨腦癥的發生,一些偏頭痛患者基因組樣品中也存在TBC1D7基因的突變[12-13].
鑒于TBC1D7蛋白在mTOR通路和人類多種疾病中發揮著重要的調控功能,所以對其生物學功能的研究就顯得尤為重要.本課題組前期研究發現,TBC1D7可以穩定結合TSC1蛋白C末端區域,促進后者發生二聚化并維持此二聚結構的穩定性[14].目前已知,TSC1與TSC2蛋白相互作用,通過TSC2蛋白C末端的Rap-GAP結構域來調控溶酶體膜表面Rheb蛋白的GTP/GDP結合狀態,最終負調控mTORC1的活性[15-16].但是,TBC1D7在mTOR通路中所扮演的角色及其對下游mTORC1的調控形式,均需要進一步探索.本文以人類全長TBC1D7蛋白為研究對象,借助一系列分子生物學研究手段,通過一系列嘗試和探索,獲得了純化的TBC1D7蛋白,并通過在人類心肌細胞系(HCM)中高表達和敲降TBC1D7基因的表達,分析了TBC1D7對mTORC1復合物活化的影響.研究結果顯示,當人類心肌細胞細胞HCM高表達Flag-TBC1D7時,細胞內S6K1蛋白Thr389磷酸化程度降低,表明mTORC1活化程度降低,而當HCM細胞內TBC1D7表達被敲降時,檢測發現胞內S6K1蛋白Thr389磷酸化升高,表明mTORC1活化程度提高.這一系列實驗證實了TBC1D7對mTORC1的活性調控發揮了重要作用.
1 材料與方法
1.1 試劑與引物
PCR實驗所使用的高保真DNA聚合酶(貨號:AP221-02)購自天根生物工程有限公司;限制性內切酶NdeI(1161A)、XhoI(1094A)、HindIII(1094A)、BamHI(1094A)、EcoRI(1040A)以及T4 DNA連接酶(2011A)購自日本寶生物公司;質粒抽提試劑盒(GK2002-200)、PCR產物純化以及膠回收試劑盒(GK2043-200)購自上海捷瑞生物工程有限公司;LB培養基(A507002)購自上海生工生物工程有限公司;Trizol試劑(10296010)購自Thermo公司;反轉錄試劑盒(KR116-02)和定量PCR試劑(FP215-02)均購自天根生物工程有限公司;凝血酶(605157)購自美國Sigma公司;GAPDH(ab181602)、S6K1(ab9366)、TBC1D7(ab234684)、pS6K1(Thr389)(ab60948)一抗以及Protein A Beads(ab193255)購自澳大利亞Abcam公司;引物及shRNA均由擎科生物工程有限公司合成,序列信息如表1所示.
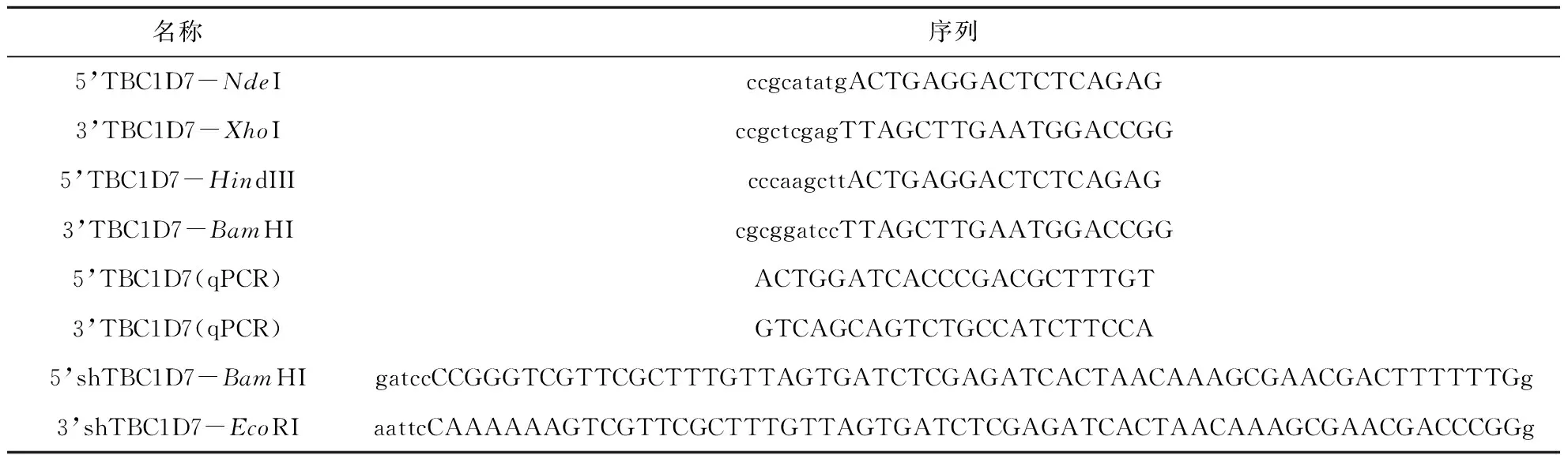
表1 本研究中所使用的引物及shRNA序列
注:小寫字母部分為酶切位點序列
Notes: The lowercase parts are the sequence of digestion sites
1.2 菌株、細胞和質粒
克隆構建和原核表達所使用菌株為大腸桿菌EscherichiacoliTOP10菌株、EscherichiacoliBL21 (DE3);細胞實驗所使用細胞為人心肌細胞系HCM;pET28a、pcDNA-Flag、pGreenPuro表達載體均為本實驗室保藏.
1.3 序列保守性分析及進化樹構建
從Uniprot數據庫中分別下載人類(Homosapiens, Q9P0N9)、原雞(Gallusgallus, A0A1L1RR07)、斑馬魚(Daniorerio, F1QRX7)、非洲爪蟾(Xenopuslaevis, F6UMY3)、家蠶(Bombyxmori, H9JMN1)、果蠅(Drosophilamelanogaster, Q9VCC4)以及粗壯厭氧真菌(Anaeromycesrobustus, A0A1Y1XIW3)的TBC1D7蛋白氨基酸序列,使用Clustal W 程序對其進行序列比對.
1.4 表達質粒的構建
以人類TBC1D7基因cDNA為模板,使用高保真DNA聚合酶對目的片段進行擴增,擴增完畢后通過瓊脂糖凝膠電泳檢測擴增結果,并切膠回收目的條帶,將切回的包含目的條帶的凝膠使用膠回收試劑盒進行溶膠和NDA回收,完畢后使用Nano-Drop設備檢測回收產物濃度.將化學合成的TBC1D7 shRNA在PCR儀中退火,收集產物以待連入載體中.
使用限制性內切酶對回收的擴增產物以及pET28a、pcDNA-Flag、pGreenPuro空載體在37 ℃水浴條件下酶切過夜,酶切產物經瓊脂糖凝膠電泳檢測后再次進行純化回收,隨后使用Nano-Drop設備檢測產物濃度后,按照目的片段和載體3∶1的摩爾比將二者混合,使用T4 DNA連接酶連接二者,連接反應在16 ℃條件下進行4 h.
連接完畢后,取10 μL連接產物,轉化E.coliTOP10感受態細胞.經熱激和冰浴后,將感受態細胞加入1 mL LB培養基中活化,隨后離心附近菌體并將感受態細胞均勻涂布至卡那霉素抗性的LB平板中,37 ℃培養過夜.通過菌落PCR檢測平板上的單克隆,并挑取陽性克隆進行搖管培養,14 h后提取質粒并將質粒送測序公司進行測序驗證.測序正確的質粒樣品可用于下一步研究.
1.5 蛋白的原核表達
將構建完成的pET28a-TBC1D7質粒熱激轉 化E.coliBL21感受態細胞.第二天挑取單菌落接種至50 mL LB培養基中進行活化培養,當菌液濃度達到A600=0.8~1.0時,再將菌液擴大培養至2 L LB培養基中. 當擴大培養的菌液濃度達到A600=0.8時,將培養溫度降至16度并加入終濃度為0.2 mmol·L-1IPTG進行誘導.在16 ℃條件下繼續培養16 h,隨后離心收集所培養的菌體,并使用Ni柱平衡液(25 mmol·L-1Tris-HCl pH 8.0, 300 mmol·L-1NaCl, 20 mmol·L-1咪唑)進行重懸.
1.6 Ni2+-NTA親和層析
使用高壓細胞均質儀,在4 ℃條件下,以100 Mpa的壓力下進行破壁.反復破壁3次后,將菌液在4 ℃,20 000 g條件下離心40 min,以去除不溶物.在離心的同時,使用預冷的Ni柱平衡液平衡Ni2+-NTA重力柱,離心完畢后立即將上清取出,加入Ni柱中,反復結合2遍后使用Ni柱平衡液沖洗5倍柱體積,隨后分別以60 mmol·L-1、200 mmol·L-1、500 mmol·L-1咪唑洗脫液進行梯度洗脫,各濃度洗脫10 mL.根據 Bradford 法測定蛋白質含量,并使用12%濃度SDS-PAGE跑膠檢測蛋白純化情況.
1.7 凝血酶酶切去除組氨酸標簽
取純化的His-TBC1D7蛋白,使用5 kDa孔徑的透析袋在4 ℃條件下對其進行透析,透析緩沖液為PBS.透析12 h后,取出His-TBC1D7蛋白,根據 Bradford 法測定蛋白質含量并按照凝血酶單位數與蛋白毫克數為2∶1的比例加入凝血酶,繼續在4 ℃條件下酶切12 h.酶切完畢后,將酶切產物跑12% SDS-PAGE檢測酶切是否完全,若殘存有部分His-TBC1D7,可以將酶切產物再次掛Ni2+-NTA層析柱,反復掛兩邊并收集流出液,通過此步驟去除存留的His-TBC1D7蛋白.使用Bradford法再次測蛋白產物濃度.
1.8 凝膠排阻層析
將去除標簽后的TBC1D7蛋白使用10 kDa截留孔徑的超濾濃縮管,在4 ℃,4 000 g條件下進行離心濃縮,直至總體積小于2 mL.隨后使用AKTA 蛋白液相層析系統(GE)結合Superdex200凝膠排阻層析柱(GE),進行層析分離.收集洗脫峰,跑SDS-PAGE膠檢測并將蛋白濃縮保存,最終獲得在溶液中狀態均一的TBC1D7蛋白.
1.9 細胞培養及轉染
HCM細胞使用添加了10%胎牛血清的RPMI1640培養基,在37℃,5% CO2培養箱中靜置培養,每2~3 d傳代一次.細胞轉染使用Lipo3000試劑,每6 cm培養皿使用15 μL轉染試劑以及10 μg質粒(總量),轉染完畢5 h后換入新鮮培養基,繼續培養24或48 h,收集細胞進行下一步實驗.
1.10 定量PCR
將細胞使用Trizol試劑提取總RNA,完畢后使用Nano-Drop設備測產物濃度.將總RNA使用反轉錄試劑盒進行反轉錄,參照實際說明書進行,反轉錄產物再次測量濃度后分裝備用.使用反轉錄cDNA進行定量PCR擴增,使用2×SYBR qPCR mix試劑,設置20 μL擴增體系.使用BioRad CFX96 定量PCR儀進行擴增和數據讀取.擴增數據處理使用2-ΔΔCT方法進行處理分析,實驗重復3次.
1.11 免疫沉淀及免疫印跡
使用含0.1% BSA的細胞裂解液稀釋Flag抗體,將50 μL Protein A Beads加入1 mL抗體稀釋液,在4 ℃條件下孵育結合2 h.孵育完畢后將Beads清洗5遍.隨后加入裂解后的組織總蛋白,在4 ℃條件下旋轉孵育過夜,離心后收集Beads.使用細胞裂解液清洗5遍后,將Beads使用1×Loading buffer 煮沸,離心收集上清備用.
將免疫沉淀獲取樣品使用10% SDS-PAGE電泳分離,完畢后將PAGE膠在200 mA橫流條件下濕轉75 min,于低溫條件下進行.轉膜完畢后使用含5%脫脂奶粉的TBS-Tween溶液進行封閉,隨后一抗4 ℃孵育過夜,洗膜3次后再次以HRP二抗室溫孵育60 min,完畢后洗膜3次并使用ECL藥水進行化學發光檢測.
1.12 蛋白質三維結構分析
從PDB數據庫(https://www.rcsb.org)中下載TBC1D7結構數據(PDB id: 4Z6Y),使用PyMOL軟件(版本:1.7)對TBC1D7分子進行靜電勢和保守性分析及顯示[17-18].
2 結果與分析
2.1 氨基酸序列保守性分析
人類TBC1D7蛋白包含293個氨基酸,從功能方面而言,該蛋白具有TBC1結構域(第50~231位氨基酸區域),具有Rab-GAP活性,可以直接激活Rab蛋白的GTPase活性[19].該功能在進化上較為保守,多物種來源的TBC1D7序列相似性較高,其在物種進化過程中保持高度的保守性,尤其是其N端結構域(圖 1).一般而言,在進化上保持高度保守的蛋白在生命活動中大多扮演著重要角色,這也在一定程度上可以解釋為何TBC1D7基因突變與人類多種疾病有關.

圖1 多物種來源TBC1D7蛋白氨基酸序列比對Fig.1 Sequence alignment of TBC1D7 from different species
2.2 人類TBC1D7蛋白分子表面殘基保守性及電勢能分析
在得到TBC1D7蛋白氨基酸序列保守性結果后,進一步分析了人類TBC1D7蛋白三維結構信息,計算了蛋白分子表面電勢能以及表面殘基保守性.
結果顯示,人類TBC1D7蛋白空間結構近似“半月形”,表面均勻分布了正負電荷,疏水區較少.進一步的表面保守性顯示,人類TBC1D7蛋白表面保守殘基較為集中,主要位于“半月形”結構的背部,該結果說明有潛在的相互作用蛋白與TBC1D7在該區域結合(圖2).
2.3 TBC1D7的克隆與表達
目前用于蛋白表達的系統有使用較多的有大腸桿菌表達系統、昆蟲細胞表達系統和哺乳動物細胞表達系統,相比較而言,三者中大腸桿菌表達系
A) 人類TBC1D7蛋白三維結構表面靜電勢,藍色為正電區,紅色為負電區,灰色為疏水中性區域;B) 人類TBC1D7蛋白三維結構表面殘基保守性分析,青色區域為非保守氨基酸區域,灰色為中度保守區,紫紅色區域為高度保守區A) Electrostatic potential of TBC1D7: blue regions represents positive, and red regions represents negative; B) Surface conversation of human TBC1D7: cyan region represents variable residues and purple means conversed residues圖2 人類TBC1D7蛋白分子表面殘基保守性及電勢能分析Fig.2 Electrostatic potential and surface conversation of human TBC1D7
統最為經濟、快捷,可以用于多種原核和真核生物來源基因的高效表達.pET28a質粒是一種較為常用和高效的原核表達載體,在N 端和C 端各有一個6×His標簽,在His標簽之后存在thrombin酶切位點,載體啟動子為T7啟動子, 目的基因被克隆到質粒載體上,受噬菌體強轉錄及翻譯信號控制,并且目的蛋白的表達將被T7終止子所終止蛋白翻譯,蛋白質的表達可由IPTG誘導.
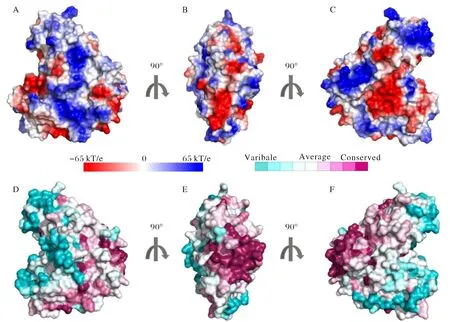
全長TBC1D7基因包括882 bp,通過酶切位點分析后選擇了NdeI和XhoI兩個限制性酶切位點,通過引物合成和后續的PCR過程,將其連在了目的片段的兩端.將目的片段和pET28a載體分別通過酶切和回收,隨后完成連接、轉化和表達鑒定過程(圖3A、3B).
由于采用了低溫誘導的策略來表達目的蛋白,所以得到的蛋白大多為可溶蛋白,通過高壓破碎細胞壁后,蛋白從菌體內部釋放出來.由于TBC1D7蛋白融合表達His標簽,根據組氨酸與Ni2+離子特異性吸附的特點,使用Ni2+-NTA柱來純化目的蛋白.將破壁離心后的菌液反復掛柱數次,隨即使用平衡液沖洗除雜.最終,通過60 mmol·L-1、200 mmol·L-1和500 mmol·L-1咪唑溶液梯度洗脫,收集洗脫樣品.由于His-TBC1D7蛋白的理論分子量約為36 kDa,所以為了方便清楚地鑒定蛋白純化結果,使用12% SDS-PAGE凝膠來分離目的蛋白,發現在200 mmol·L-1咪唑濃度條件下,大部分蛋白可以被洗脫下來,并且純度較高(圖3C).
2.4 TBC1D7蛋白的純化
在親和層析完畢后,得到了在N端融合有His標簽的TBC1D7蛋白.考慮到His標簽可能會對后續蛋白功能研究存在影響,需要去除TBC1D7蛋白N端融合的His標簽.由于pET28a載體在His標簽與目的蛋白之間存在一個凝血酶酶切位點(Leu-Val-Pro-Arg-Gly-Ser)編碼序列,所以該載體表達的蛋白也存在著該酶切位點.
由于通過Ni2+親和層析所得到蛋白融合中存在這較高濃度的咪唑,而高濃度的咪唑比例與酶切的進行,所以通過透析的手段去除了蛋白溶液中所含的高濃度咪唑.隨后通過使用凝血酶將His標簽與TBC1D7蛋白切開,并通過進一步的凝膠排阻層析手段來最終得到純化的TBC1D7蛋白.根據Superdex200凝膠排阻層析柱標準品洗脫相對分子量公式計算,發現TBC1D7蛋白的表觀相對分子量為38 k, 非常接近理論分子量36 k,由此推斷,TBC1D7蛋白在溶液中以單體形式存在.層析完畢后,收集最終的洗脫蛋白并通過Bradford方法測蛋白濃度,發現通過該策略最終每升大腸桿菌菌液可以獲得12 mg純化的TBC1D7蛋白(圖4A、B).
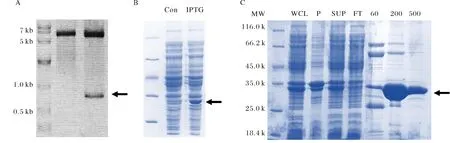
圖3 TBC1D7的克隆與表達A) 雙酶切方法驗證所構建的表達質粒,左側泳道為空載體酶切產物,箭頭所指為目的片段;B)轉化后大腸桿菌表達檢測;C)Ni2+親和層析純化His-TBC1D7融合蛋白;WCL:全細胞裂解液;P:沉淀;SUP:上清;FT:流穿液;60、200、500分別為 60,200,500 mmol/L 咪唑緩沖液洗脫的蛋白組分Fig.3 Clone and expression of TBC1D7A)Double digestion of constructions;B)Expression of transformed E.coli;C)Purification of His tagged TBC1D7 protein through Ni2+ affinity chromatography; WCL:Whole cell lysate;P: Pellet;SUP:Supernatant;FT:Flow through;60、200、500: 60,200,500 mmol·L-1 imidazole buffer elution
A) TBC1D7蛋白經Superdex200凝膠排阻層析柱洗脫峰形圖;B) 12% SDS-PAGE 檢測A圖中的各洗脫組分A) Elution curve of SEC; B) Elution fractions dissolved in 12% SDS-PAGE圖4 凝膠排阻層析純化TBC1D7蛋白Fig.4 Purification of TBC1D7 through Size exclusion chromatography
2.5 TBC1D7的過表達和敲降
首先我們構建了過表達質粒:pcDNA-Flag-TBC1D7和敲降質粒:pGreenPuro-shTBC1D7,并將構建的質粒轉染HCM細胞,分別于0 h(對照)、24 h和48 h收集細胞,提取總RNA并反轉錄.定量PCR實驗對檢測基因高表達和敲降水平,對擴增結果進行t-test分析,結果證實所構建的TBC1D7過表達(圖5A)和敲降(圖5B)質粒均可有效地發揮作用,在轉染后24 h即可顯著上調或下調TBC1D7的表達.
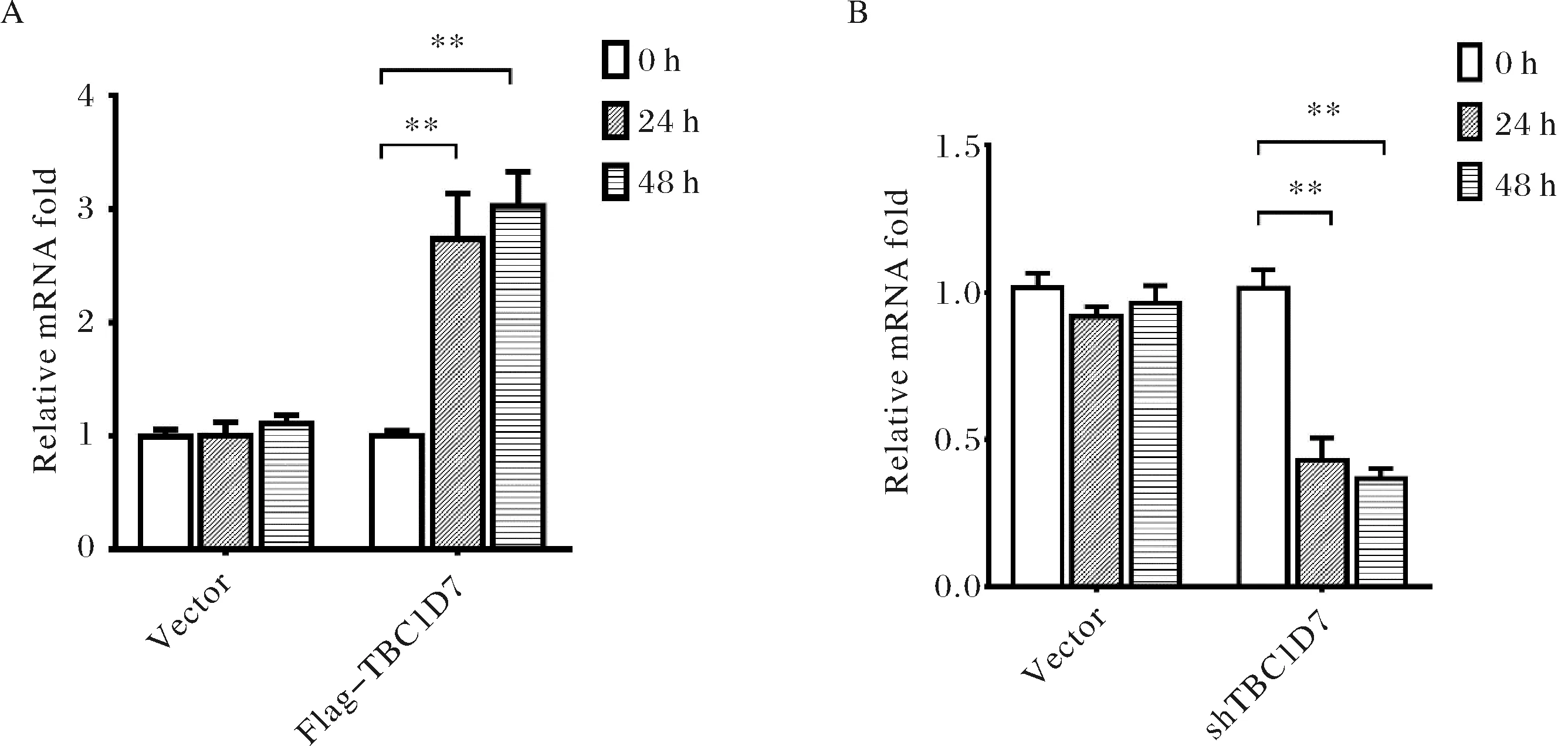
A) TBC1D7的過表達檢測;B) TBC1D7的敲降檢測.圖中**表示p<0.01A) Overexpression of TBC1D7. B) Knock-down of TBC1D7. ** indicates p<0.01.圖5 定量PCR檢測TBC1D7的過表達和敲降Fig.5 Up-and down-regulation of TBC1D7 measured by qPCR

A) WB檢測TBC1D7表達水平的改變對mTORC1下游S6K1磷酸化的影響;圖B)與C),WB條帶的相對灰度比例A) The phosphorylation level of S6K1(Thr389) that affected by up-and down-regulation of TBC1D7; B) and C) Quantitative of the gray scale of western blot bands in A圖6 TBC1D7表達水平的改變對mTORC1活性的影響Fig.6 The activity change of mTORC1 that affected by TBC1D7
2.6 TBC1D7表達水平的改變對mTORC1活性的影響
目前已知TBC1D7是TSC復合物的重要組成部分,然而TBC1D7在人類心肌細胞中對mTOR信號通路的影響尚有待確定[8].本研究中,以人心肌細胞系HCM為研究對象,通過高表達和敲降TBC1D7來改變胞內TBC1D7的表達水平,檢測mTOR信號通路中mTORC1復合物活化水平標志物:S6K1蛋白Thr389殘基的磷酸化情況,以確定TBC1D7的表達對mTORC1活化水平的影響.實驗結果顯示,當在HCM細胞中高表達TBC1D7時,胞內S6K1蛋白Thr389磷酸化程度降低,表明mTORC1活性受到抑制,而當HCM細胞內TBC1D7被敲降時,胞內S6K1蛋白Thr389磷酸化升高,表明mTORC1活化程度提高(圖6).這一系列實驗證實了在人心肌細胞中TBC1D7對mTORC1的活性調控發揮了重要的負調控作用.
2.7 TBC1D7與mTOR信號通路蛋白質作用網絡分析
為進一步深入了解TBC1D7在mTOR信號通路中的作用和功能,從String數據庫下載并分析了人類TBC1D7蛋白的相互作用網絡[20].圖中綠色節點(Nodes),如TSC1,TSC2,AKT1等代表TBC1D7的第一層(Fist shell)相互作用蛋白,在功能上具有非常緊密的聯系(圖7).除此之外,TBC1D7的相互作用網絡中包含諸如mTOR,Rheb, EIF4EBP1, MAPK, GSK3B等mTOR信
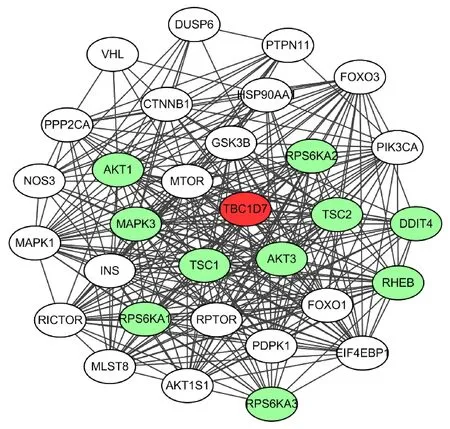
圖7 TBC1D7與mTOR信號通路蛋白相互作用網絡Fig.7 Protein-protein network of TBC1D7 and mTOR signaling pathway
號通路關鍵蛋白.由此可見,TBC1D7蛋白在mTOR信號通路中發揮了重要的調控作用.
3 討論
作為真核細胞內調節細胞代謝的關鍵途徑,當mTOR通路中某個或某些蛋白發能功能受損時,真核生物機體則產生對應的病理性變化.對于人類而言,目前已在包括直腸癌、胃癌、乳腺癌和前列腺癌等惡性腫瘤疾病中發現mTOR蛋白的功能性突變[21-23];TSC1/TSC2的突變致使其對下游mTORC1復合物抑制作用減弱,導致結節性硬化癥的發病[9];此外,mTOR信號通路異常也被認為與阿爾茨海默癥和昆廷頓舞蹈病等神經退行性疾病的發病相關[24-26].正因為其在真核生物體內發揮著極其關鍵的作用,mTOR信號通路從20世紀90年代初被發現至今仍在世界范圍內被諸多實驗室深入研究,但截止當前,依然有許多未知之處等待深入研究.
除了已知的TSC1/2蛋白,真核細胞內還存在著其它效應蛋白可以介導TBC1D7蛋白的功能發揮.有研究人員發現果蠅體內TBC1D7蛋白可以通過胰島素信號來調控機體生長,而這一過程不依賴TSC1/2[27].本研究中,蛋白相互作用網絡顯示AKT1和AKT3均與TBC1D7存在相互作用,有相關研究證實AKT可以磷酸化TBC1D7蛋白第124位絲氨酸(Ser),通過磷酸化來調控后者與14-3-3ζ及β-TrCP2的相互作用,而14-3-3ζ又可通過與mTORC1復合物中Raptor亞基相互作用來抑制復合物的激酶活性[28-29].
作為mTOR信號通路的重要一員,TBC1D7蛋白與TSC1、TSC2形成三元復合物,以復合物形式發揮功能,此TSC復合物的功能異常可導致結節性硬化的發病.結節性硬化通常會導致心臟組織發生病變,心臟橫紋肌瘤(cardiac rhabdomyoma)是結節性硬化癥常見的臨床表現之一,此癥狀常在胎兒時期出現,嚴重影響了胎兒的正常發育[30-31].對TSC復合物的作用機理進行研究可進一步了解結節性硬化的發病,并促進新型診療手段的出現.雖然目前尚未在結節性硬化癥患者中發現有TBC1D7基因突變的情況,但是目前已知TBC1D7基因的突變卻可以導致其他一些神經系統疾病,例如巨頭癥、智障、視神經萎縮等[12,32].此外,有研究者發現,相較于野生型小鼠,糖尿病模型小鼠心臟組織中TBC1D7蛋白表達顯著下調,進一步的相互作用網絡分析顯示TBC1D7作為一個潛在的調節因子參與至糖尿病性心肌病的調控之中[33].因此,對TBC1D7蛋白的生物學功能研究就顯得尤為重要.本研究建立了一種簡單有效的人類TBC1D7蛋白的表達純化策略,并研究了在人類心肌細胞中TBC1D7的表達與其下游mTOR信號通路之間的聯系,發現TBC1D7蛋白可負調控下游mTORC1復合物激酶活性,并與mTOR信號通路蛋白網絡存在緊密聯系.本研究為人類TBC1D7蛋白和mTOR信號通路的進一步研究打下了良好基礎.

