棉花紅腐病菌不同致病力菌株間毒素活性差異
劉夢麗, 李進, 張軍高, 周小云, 杜鵬程, 郭慶元*, 雷斌*
(1.新疆農業大學農學院, 烏魯木齊 830052; 2.新疆農業科學院核技術生物技術研究所, 烏魯木齊 830091)
新疆光熱資源豐富,適合發展棉花生產,現已成為我國最大的棉花生產、供給基地[1]。然而受連作年限長、極端天氣不斷增加等因素影響,棉花病害頻繁發生、損失巨大。立枯病、紅腐病是新疆棉區苗期主要病害,尤其擬輪枝鐮孢霉(Fusariumverticillioides)引起的棉花紅腐病,近年來發生危害漸增,并在適宜發病的條件下,造成缺苗斷壟、產量和品質大幅下降[2-3]。擬輪枝鐮孢霉侵入寄主植物后產生的毒素會抑制植物生長,導致寄主植物組織細胞損壞[4]。目前,已在玉米、小麥等農作物中分離出擬輪枝鐮孢霉并檢測到伏馬菌素[5-7],Seo等[8]從擬輪枝鐮孢霉菌株中分離出2種結構相似的伏馬菌素,并分析了合成伏馬菌素的必需基因。有學者認為鐮孢菌(Fusarium)、立枯絲核菌(Rhizoctoniasolani)等的毒素對寄主植物形態及細胞病理反應有顯著影響[9-11],能影響寄主植物的形態結構、細胞器結構及生理代謝[12-14]。潘月敏[15]研究發現,擬輪枝鐮孢霉毒素對棉花胚根有抑制作用,且經毒素處理后的棉苗與接種病原菌的棉苗發病癥狀一致。以上關于病原菌粗提毒素在致病過程的作用機制研究主要集中在成分鑒定及其對寄主植物的毒害作用方面,而對不同菌株毒素的致病力差異缺乏系統深入研究。
鑒于擬輪枝鐮孢霉毒素液的致毒成分是其侵染過程中的重要因素,并在寄主與病原物的互作中發揮重要作用,本研究利用3株致病力差異較大的棉花紅腐病菌菌株,分別獲得其粗毒素,研究粗毒素對棉種萌發、胚根生長、幼苗致萎和幼苗保護酶活性等的影響,旨在探明擬輪枝鐮孢霉致病機理,明確寄主與病原菌間的互作關系,為利用擬輪枝鐮孢霉毒素快速鑒定寄主抗病能力提供科學依據。
1 材料與方法
1.1 試驗材料
1.1.1菌株 選用編號為FAKS15-111、KYJS15-122、FBYL15-111的3個擬輪枝鐮孢霉菌株作為供試菌株,其中FAKS15-111為弱致病力菌株,KYJS15-122為中致病力菌株,FBYL15-111為強致病力菌株[16]。菌株均由新疆農業大學植物病理實驗室提供。
1.1.2棉花品種 供試棉花品種‘新陸早82號’(GossypiumhirsutumLinn.‘Xinluzao 82’)由新疆農業科學院核技術生物技術研究所化控實驗室提供。
1.1.3培養液 選用馬鈴薯葡萄糖(potato dextrose,PD)培養液作為擬輪枝鐮孢霉的產毒素培養液[15]。
1.2 試驗方法
1.2.1擬輪枝鐮孢霉毒素的提取 參照王立安等[17]方法提取擬輪枝鐮孢霉毒素,略有修改。將病原菌接入PD培養液,調整培養液pH至9,置于溫度為25 ℃、12 h/12 h光暗交替的人工氣候箱中培養10 d,每隔6 h人工震蕩1次;將培養好的菌懸液用2層紗布過濾掉菌絲,濾液經5 000 r·min-1離心,取上清液經121 ℃、20 min高壓滅菌,獲得病原菌粗毒素原液。粗毒素原液置于4 ℃冰箱保存,備用。
1.2.2棉花種子發芽胚根抑制試驗 將3株病原菌粗毒素原液依次梯度稀釋,分別稀釋0、2、10、100和1 000倍,將發芽紙完全浸入不同濃度的粗毒素液中,浸泡24 h;分別在各發芽紙上均勻擺放50粒飽滿棉種,以蒸餾水浸紙作為對照(CK1),每個處理重復3次。將裝有種子的發芽紙放入密封袋中,置于25 ℃培養箱,培育4 d,逐粒檢查棉花種子的萌發情況,測定胚根長度,并計算萌發率(G)和胚根抑制率(Ir)[18]。
G=N1/N×100%
Ir=(LCK-LT)/LCK×100%
式中,N1和N分別代表發芽種子數和供試種子數,LCK和LT分別代表對照胚根平均長度和處理胚根平均長度。
1.2.3粗毒素原液處理后的棉苗培育 因粗毒素原液毒素活力最高,毒力最強,本研究采用粗毒素原液作為水培處理溶液。取無菌土培養至兩葉一心的棉苗,用蒸餾水反復沖洗根系3遍后,分別水培于裝有FAKS15-111、KYJS15-122和FBYL15-111三種病原菌粗毒素原液的三角瓶中,不含毒素液的PD培養液為對照(CK2),共計4個處理,每個處理3個重復。
1.2.4棉苗致萎試驗 分別在水培液處理12、24、36和48 h觀察記載棉苗反應情況。植株反應級別分為無反應、輕度反應、中度反應和重度反應[15]。無反應,植株正常,葉片無萎蔫;輕度反應,葉片輕度黃化或輕度卷曲;中度反應,葉片大部分卷曲、黃化;重度反應,整個葉片卷曲至枯死。
1.2.5棉苗根部電導率檢測 分別在水培液處理12、24 、36 和48 h時,隨機取出3株棉苗測定電導率。參照張憲政[19]測定棉苗根系電導率,并計算相對電導率(relative electric conductivity, REC)。
REC=(CB-CCK)/(CA-CCK)×100%
式中,CA和CB分別代表30 ℃水浴處理電導率和沸水浴電導率,CCK指純凈水的電導率。
1.2.6棉苗根系保護酶活性測定 分別在水培液處理4、12、24、36和48 h時,取出棉苗根系,蒸餾水沖凈表面殘留粗毒素液,利用4種酶活測定試劑盒(南京建成生物工程研究所)分別測定SOD、PAL、POD和PPO活性。
1.3 數據分析與統計
用Microsoft Excel 2010統計數據,SPSS 21.0軟件進行數據分析。
2 結果與分析
2.1 不同菌株及其不同稀釋濃度粗毒素液對棉花種子發芽的影響
不同毒素處理的棉花種子發芽和胚根抑制結果見表1,可見,粗毒素原液處理下,3株致病力不同的病原菌毒素溶液對棉種萌發率及胚根生長抑制率的表現有差異,菌株致病力越強,其毒素溶液處理的棉種萌發率越低,胚根抑制率越高。致病力最強的FBYL15-111菌株毒素處理的種子萌發率最低,為17.67%,胚根生長抑制率最高,達到91.11%。菌株毒素溶液稀釋倍數越高,棉種萌發率越高,胚根生長抑制率越低,當毒素液稀釋度為1∶1 000時,無論病原菌致病力強弱,毒素溶液處理后的棉苗萌發率與對照無顯著差異。經雙因素方差分析(表2)表明,稀釋倍數和菌株對棉苗胚根抑制率均有極顯著影響(P<0.01);而稀釋倍數對棉種萌發率的影響達到極顯著水平(P<0.01),菌株對萌發率具有顯著性影響(P<0.05)。
2.2 粗毒素原液浸根對棉苗的致萎作用
不同菌株粗毒素原液對棉花的致萎結果統計見表3,可知,3株致病力不同的菌株所提粗毒素對棉苗表現出不同程度的致萎作用,其中強致病力菌株(FBYL15-111)所提粗毒素對棉苗的致萎速度快,致萎能力強。處理36 h后,FBYL15-111的毒素溶液使棉苗子葉和真葉重度卷曲,KYJS15-122、FAKS15-111的毒素溶液處理的棉苗葉片萎蔫、黃化;處理48 h后,FBYL15-111、KYJS15-122毒素液中的棉苗枯死、根部發生腐爛,而對照(CK2)棉株生長正常。
2.3 粗毒素原液處理對棉苗根部電導率的影響
不同菌株毒素原液處理的棉苗根部電導率結果(圖1)表明,隨著處理時間的延長,3個菌株粗毒素原液處理的棉苗根系相對電導率逐漸升高。前12 h,各處理的棉苗根系相對電導率差異不大;處理48 h后,3個菌株粗毒素原液處理的棉苗根系相對電導率較對照(CK2)分別高1.48、1.23和0.90倍。由此可知,擬輪枝鐮孢霉毒素處理可使細胞膜透性增加,且菌株致病力越強,細胞膜受傷害的程度越大。

表1 不同菌株及其不同稀釋度毒素液處理的棉花種子萌發率和胚根抑制率Table 1 Germination rate and radicle inhibition rate of cotton seed under different treatments (%)
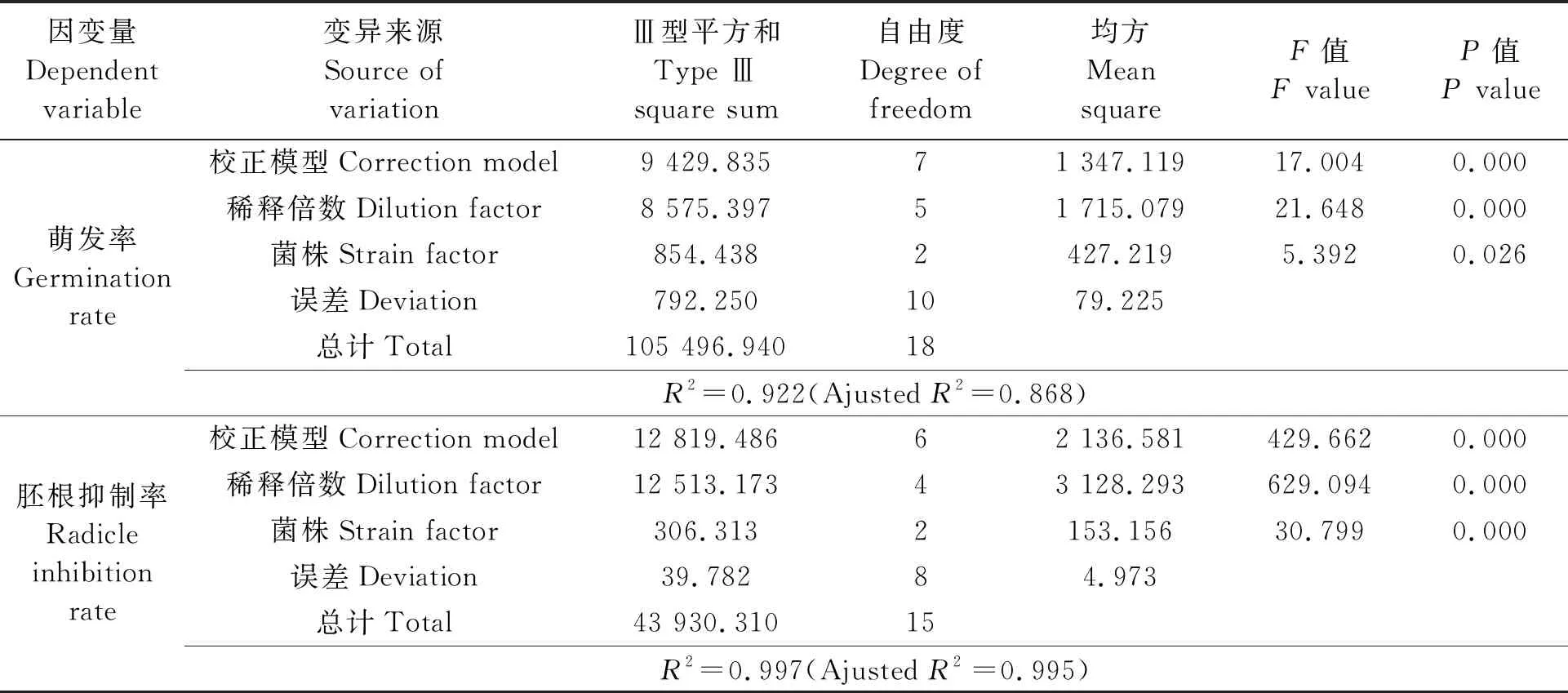
表2 萌發率及胚根抑制率雙因素方差分析Table 2 Analysis of variance of germination rate and radicle inhibition rate

表3 不同菌株毒素對棉苗的致萎作用Table 3 Lethal effect of toxin produced by different strains on cotton seedlings
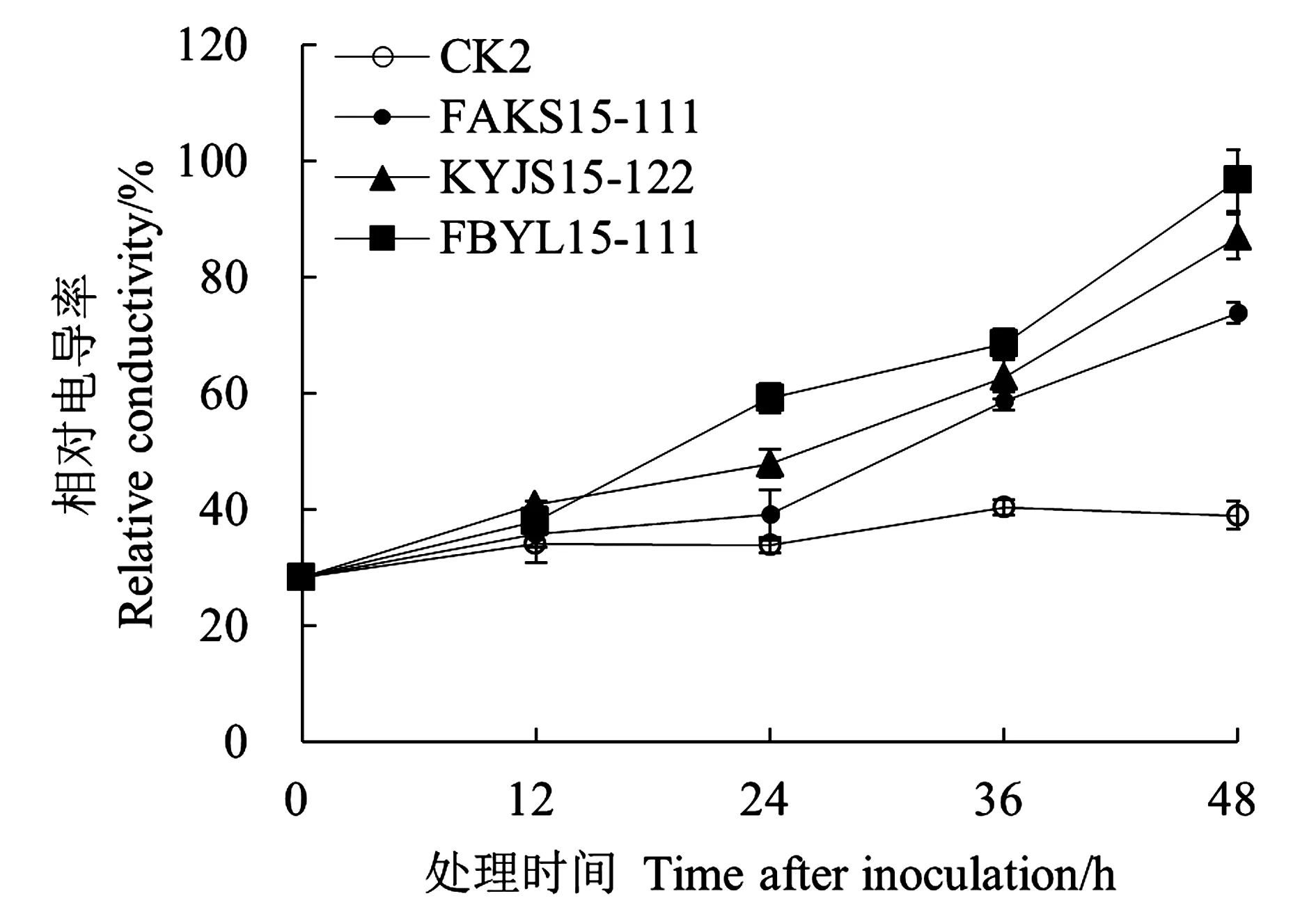
圖1 棉苗根系相對電導率Fig.1 Relative conductivity of cotton seedling roots
2.4 不同處理棉苗根系的PAL、PPO、POD及SOD酶活性
由圖2可知,經病原菌毒素原液處理后,棉苗根系SOD、PAL、POD和PPO酶活性均呈先增高后降低的趨勢,不同處理的PAL活性均在處理12 h時到達峰值,不同處理的PPO、POD和SOD活性均在處理24 h時達到峰值;而對照處理(CK2)的棉苗根系中4種酶活性在各個處理時間段差異不大。毒素處理4 h時,各處理的4種酶活性均顯著高于CK2處理,其中FBYL15-111、KYJS15-122及FAKS15-111處理的SOD酶活性分別比CK2高出143.17%、118.03%及80.03%。毒素處理12 h時,各處理PAL酶活力達到最大值而后逐漸降低,其中FBYL15-111毒素處理的棉苗根系PAL活力最高,達到(30.79±1.72)U·mg-1蛋白;FBYL15-111毒素處理后SOD酶活性顯著增高,比CK2高出209.66%;POD、PPO酶活性變化不大。毒素處理24 h時,各菌株毒素處理的SOD、PPO及POD酶活力均達到最大值,FBYL15-111所提毒素處理的PPO活力變化明顯,達到(85.74±1.49)U·mg-1蛋白;FBYL15-111的SOD活力上升最快,在處理24 h時比CK2高出67.99%。毒素處理36 h時,各處理的SOD、PPO及POD酶活性逐漸下降,致病力弱菌株FAKS15-111的PPO活力與CK2無顯著差異。毒素溶液處理48 h時,菌株FBYL15-111的PAL、PPO及POD酶活性仍然為最大,與FAKS15-111的SOD酶活性無顯著差異,FAKS15-111與KYJS15-122的POD酶活性差異不顯著。
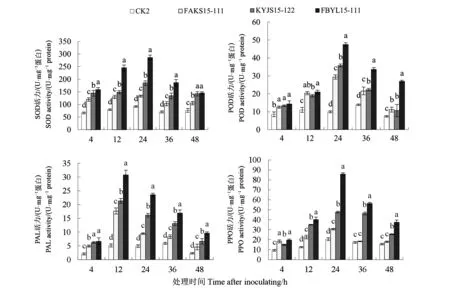
圖2 棉苗根系的PAL、PPO、POD及SOD活性Fig.2 Activities of PAL, PPO, POD and SOD in roots of cotton seedlings
3 討論
毒素作為病原菌侵染過程重要的致病因子之一,不僅造成植物細胞和組織凋萎死亡,還產生過量的生長調節物質,致使植物體內一些與抗病相關的防御性酶的活性發生改變[20-21]。
馮云程等[22]研究表明,菌株產毒量與菌株致病性強弱呈正相關,且毒素濃度越高,作用越明顯;還發現,利用粗毒素對水稻幼苗進行致萎力研究的方法,表現出更高的試驗靈敏性。本研究提取不同致病力擬輪枝鐮孢霉菌株毒素侵染棉苗,經生物活性測定表明,致病力不同的菌株所提粗毒素液及其不同濃度溶液對棉花種子的萌發率、胚根抑制率均有一定影響;且粗毒素液濃度越高,棉種萌發率越低,其胚根抑制率越高。此外,菌株致病力越強,其毒素對棉苗的致萎作用越強。棉苗經擬輪枝鐮孢霉毒素液處理后,其根系細胞由于細胞膜透性增加,電解質外滲,使細胞浸出液相對電導率增加,且強致病力菌株對其相對電導率影響最大,而對照處理的相對電導率變化不大。這一結論與田雪亮等[23]研究的擬輪枝鐮孢霉粗毒素對玉米幼苗根系以及對小麥根系的影響結果一致。
當植物被病原菌侵染時,植物體內的一些與抗病相關的防御酶被激活,防御酶在植物細胞抵御外界逆境因子的脅迫過程中起重要作用[24]。SOD、POD、PPO及PAL都是與植物體抗逆相關的酶,SOD是生物體內重要的抗氧化酶,可對抗與阻斷因氧自由基對細胞造成的損害。POD的主要作用是將過氧化氫水解,是評價植物組織細胞老化的一項重要指標。PPO通過催化木質素及醌類化合物形成,構成保護性屏障從而使植物細胞免受傷害。PAL是鏈接初級代謝和苯丙烷代謝的關鍵酶和限速酶[25-26]。本研究中,棉苗根部細胞PAL酶活性在12 h時就出現最大值,說明在毒素脅迫初期,棉苗就能通過提高細胞中PAL酶活性來抵抗病原菌侵染,這與張笑宇等[27]對馬鈴薯黑痣病病原菌毒素的研究結果一致。然而,研究者在研究毒素脅迫不同作物對防御酶活性影響所得的結論有差異,如松針褐斑病菌毒素對紫莖澤蘭葉片細胞內的酶活性有抑制作用[28],而玉米大斑病病原菌毒素對玉米幼根的SOD、PAL、POD、PPO 4種酶活性的影響,均為先升高后降低的趨勢[29]。本研究中,隨著毒素對棉苗根系處理時間的延長,SOD、PAL、POD、PPO 4種酶活性都呈現出先適度升高后逐漸降低的趨勢,且均在處理12~24 h左右出現最大酶活性。說明棉苗根部細胞在遇到毒素脅迫時首先需要一個適應過程,這段時間防御酶系統逐漸啟動,是棉苗體內防御酶系統最活躍、生理生化反應最強烈的階段。

