鼠胚胎培養在輔助生殖實驗室質量控制中的應用研究
趙利,姚鵬
(黃河三門峽醫院 生殖醫學科,河南 三門峽 472000)
生殖是人類生命延續的自然過程,由于人類生存環境的污染及各種物理化學因素的作用,導致卵子、精子的質量下降,影響了人類的正常生殖活動[1]。為延續生命過程,輔助生育技術便應運而生,其中以體外受精-胚胎移植(in vitro fertilization and embryo transfer, IVF-ET)為主的輔助生殖技術已廣泛應用于不孕癥的治療中,但受孕率卻不盡如人意[2]。研究[3-5]表明,胚胎質量是輔助生殖技術成功與否的關鍵因素,而影響其生存、發育的因素較多,如促超排卵方案的應用、實驗中采卵及采精的過程以及其他還未意識到的因素,因此質量控制是輔助生殖實驗室質量保證的一個重要環節,其中較為重要的內容就是檢測各種器皿及試劑對胚胎是否存在有害的內毒素。小鼠培養是監測實驗室培養環境的重要指標,因此本研究以小鼠體內外受精及胚胎培養實驗進行質控評估,以期為臨床應用提供理論依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物 健康雌性昆明白鼠,4~6 周齡,體重(20.35±2.03)g;雄性昆明白鼠,8 周齡以上,體重(30.25±3.11)g,購自上海斯萊克實驗動物技術有限公司,動物合格證號SCXK(滬)2012-0002。實驗前所有小鼠適應性飼養7 d,室溫20℃~25℃,12 h 晝夜交替。
1.1.2 言要試劑 注射用孕馬血清促性腺激素(pregnant mare serum gonadotropin,PMSG)、絨毛膜促性腺激素(human chorionic gonadotropin, hCG)(杭州動物藥品廠),以10 mL 0.9%生理鹽水將其溶解,于-20℃分裝保存;卵裂液(CSC)、人輸卵管液(human tubal fluid, HTF)、HEPES 緩沖的人輸卵管液(modified human tubal fluid, mHTF)、合成血清蛋白(SSS)(歐文公司產品)、胚胎處理液、洗精受精液、卵裂胚培養液G1、囊胚培養液G2、人血清白蛋白(human serum albumin, HSA)(瑞典Vitrolife 公司)等。
1.1.3 言要儀器 恒溫超凈工作臺、培養皿、二氧化碳(CO2)培養箱(德國)、解剖顯微鏡、倒置顯微鏡(日本)、三氣培養箱(丹麥)、CO2濃度檢測儀(德國)等。
1.2 方法
1.2.1 小鼠超排卵 選取雌鼠于實驗前4 d 的16∶00 時腹腔內注射 PMSG 10 IU/只(0.1 mL),48 h后于腹腔內注射hCG 10 IU/只(0.1 mL)。
1.2.2 體內外受精實驗 實驗將小鼠分為體內受精與體外受精組。體內受精組:在注射hCG 后將雌雄按照1∶2 的比例進行合籠,次日早上觀察雌鼠有無陰栓。對于有陰栓的雌鼠以頸椎脫臼法處死,在無菌條件下取其輸卵管,洗滌3 次后,用針頭套在輸卵管傘上,收集2 期胚胎,于37℃下,在6%的CO2濃度培養箱中培養,觀察并記錄40 h、46 h、64 h 胚胎發育情況。體外受精組:在注射hCG 15~16 h 后,以頸椎脫臼法處死雌鼠,于無菌環境下取出輸卵管,沖洗3 次后,在體視鏡下,用注射針套刺破輸卵管膨大部位,使其卵子團釋放出來,并將其收集至G-IVF 受精液中,于37℃下,在6%的CO2濃度培養箱中等待受精。以同樣的方法處死雄鼠,無菌環境下取出附睪尾,沖洗3次后用鑷子輕輕取出精子,收集精子懸液于含有G-IVF 液的試管中,獲能后,取適量精子懸液加入到含有卵子團的G-IVF 液中,移于37℃下、6%的CO2濃度培養箱中培養。而后在受精4 h 將卵子移入另一個含有G-IVF 液的受精皿中培養。
1.3 統計學方法
用SPSS 20.0 統計軟件進行數據分析,計量資料以均數±標準差(±s)表示,兩組間比較進行t檢驗,計數資料以百分率(%)表示,兩組間比較進行χ2檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 小鼠體外受精結果
本研究進行了3 個批次共21 個周期的小鼠體外受精實驗,共獲卵968 枚,其中原核受精卵765 枚,受精率 79.03%,2-細胞數 704 枚,卵裂率92.03%,2-細胞形成囊胚552 個,囊胚形成率為78.41%,見表1。
2.2 小鼠體內受精結果
本研究進行了13 個周期的體內受精實驗,共獲卵472 個,其中原核受精胚367 個,受精率為77.75%,2-細胞數351 枚,卵裂率95.64%,2-細胞形成囊胚286 個,囊胚形成率為81.48%,見表2。

表1 小鼠體外受精結果
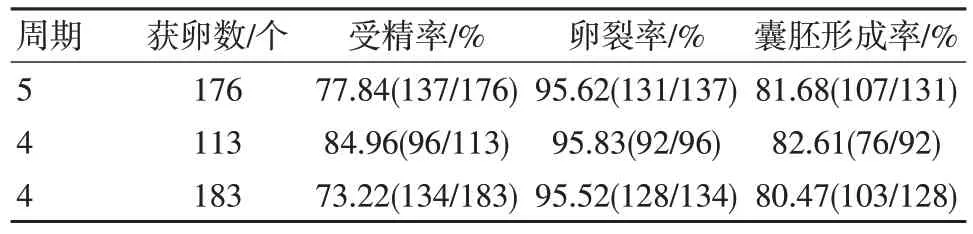
表2 小鼠體內受精結果
2.3 小鼠胚胎體內外受精結果比較
體內外受精組的受精率分別為(77.64±5.38)% 、(79.01±1.24)% , 卵 裂 率 分 別 為(95.48±1.06)%、(92.04±1.01)%,囊胚形成率分別為(81.42±1.13)%、(78.15±0.98)%,兩組間差異無統計學意義(P>0.05)。
3 討論
隨著人類輔助生殖技術的不斷發展,IVF-ET技術已成為當前治療不孕癥的主要手段,但在輔助生殖的過程中有很多環節會影響胚胎質量,導致患者的平均妊娠率較低。其中實驗室的培養環境是較為重要的一個環節,因此需要在該過程中有嚴格的實驗室質量控制系統及嚴格的實驗室操作程序,以盡可能地降低各個環節對胚胎潛在的危害,保證胚胎質量[6-7]。1985 年 ACKERMAN 等首次嘗試用2-細胞鼠胚作為實驗室質控的方法,由于鼠胚與人胚有著近乎相同的發育歷程,因此鼠胚是監測人早期胚胎體外發育環境的最好模式,可用來監測人類輔助生殖技術的幾乎所有程序[8-9]。通過對IVF 實驗室進行質量控制,并提高相關實驗人員的操作水平,從而保證IVF 技術操作的準確性及可靠性。
研究[10]顯示,鼠胚胎的體外受精較體內受精對胚胎發育的影響因素更加敏感,因而更有利于監測出對胚胎發育不利的因素。由于實驗室是體外孕育胚胎的唯一場所,而受精卵與早期胚胎對微環境的要求較高,對培養環境的變化十分敏感,因此在實驗需在無菌、無毒及無污染的環境中進行[11-13]。本研究通過對體內外受精兩組方法的對比,對實驗室的培養系統進行了全面的質量評估,結果顯示,兩組在受精率、卵裂率、囊胚形成率間差異無統計學意義,且各項指標均符合人類輔助生殖實驗室質量控制標準。筆者在實驗過程存在一些問題:溫度設置欠佳時,會導致胚胎發生不可逆的損傷,需要借助加溫裝置,使溫度維持在37℃,以提高受精率與懷孕率;光照時間延長會影響早期胚胎發育;若技術人員操作不夠熟練,導致操作時間過長,也會影響胚胎的后續發育;此外選擇周齡較長的雌鼠,會使排卵效果降低,導致配子的質量下降。
綜上,鼠胚實驗過程中的較多因素會影響受精率、囊胚形成率等,因此需盡可能地控制影響胚胎發育的可控因素,同時還需提高實驗人員的操作技能等。因而在輔助生殖實驗中,利用鼠胚實驗可建立一套健全、完整的質量控制體系以確保培養環境及系統的可靠性,能為臨床診治提供依據。

