硫酸亞鐵銨制備材料的選擇及反應時間的優化
張曄 曾云斌 李可新


摘要:硫酸亞鐵銨的制備和質量檢驗,是大學實驗中一個重要的無機綜合實驗.其中,制備硫酸亞鐵這一步極為重要,對所得產品的產量和純度有著直接的影響.因此,本文分別用鐵屑和鐵粉做原料,在反應時間不同的情況下,分析了產物的產量和質量.探索結果表明:鐵屑是制備硫酸亞鐵銨的最佳材料,最佳反應時間為50min.在此反應時間下制備的產物顏色為淺綠色,產率為87.52%,純度為98.08%.
關鍵詞:鐵屑;鐵粉;時間;硫酸亞鐵;硫酸亞鐵銨;純度
中圖分類號:O6-3? 文獻標識碼:A? 文章編號:1673-260X(2020)02-0048-03
1 前言
硫酸亞鐵銨(NH4)2Fe(SO4)2·6H2O,在空氣中比一般亞鐵鹽穩定,不容易被氧化,常用于定量化學分析[1]和廢水處理的混凝劑,染料的媒染劑,農業殺蟲劑等.
在硫酸亞鐵銨的制備實驗中涉及很多化學實驗基本操作.在本科化學實驗中是一個必不可少的無機綜合實驗.通常根據觀察氣泡來判斷鐵與酸反應進行的程度,依據產品的產率和純度來判斷制備是否成功.而制備中的準確稱量,直接影響硫酸銨的加入量,進一步影響產品的純度.為此本文分別選取了鐵屑和鐵粉作為制備硫酸亞鐵銨的原材料,控制鐵與硫酸反應的時間.最后利用蒸餾后滴定法和沉淀重量法測定產品中NH4+和SO42-的含量.通過對制備產物的產率、純度、含量測定等,綜合比較分析找出了反應的最佳時間和原材料.
加入過量BaCl2使樣品中SO42-沉淀完全,加入適量鹽酸以除去多余的碳酸鋇沉淀,避免對實驗產生干擾,至無氣泡為止.將沉淀過濾,洗滌,烘干,稱量.測定樣品中SO42-含量.
3 實驗藥品及儀器
實驗用到的試劑均為分析純.除了一些簡單常用的儀器外,還有北京普析通用儀器有限責任公司制造的722N可見分光光度計和TU-1810型紫外-可見分光光度計.
4 實驗內容
4.1 硫酸亞鐵的制備
向六個盛有洗凈鐵屑的燒杯中加入15mL3 mol/L硫酸溶液,蓋上表面皿,放在恒溫水浴鍋上加熱,溫度控制在70-80℃[5].反應時間分別控制在20min、30min、40min、50min、60min和至無氣泡為止.同樣方法,做鐵粉與硫酸的反應.反應過程中適當添加蒸餾水,以補充蒸發掉的水分,始終保持15mL溶液.趁熱用短頸漏斗過濾[6].濾液濾入50mL蒸發皿中.
殘渣用蒸餾水洗滌,用濾紙吸干后稱量,計算溶液中FeSO4的物質的量.
4.2 (NH4)2Fe(SO4)2·6H2O的制備
根據FeSO4的量,按照反應方程式原理,準確計算所需固體(NH4)2SO4的量.
按計算值準確稱取(NH4)SO4的固體,加入上述所制得的FeSO4溶液中,加熱使硫酸銨全部溶解,并用3mol/L H2SO4溶液調節pH為1-2,繼續蒸發濃縮至液面出現一層晶膜為止.靜置,使之緩慢冷卻,結晶.將布氏漏斗放在60 -70℃的烘箱中烘10-20min再減壓抽濾.用少量無水乙醇洗去晶體表面所附著的水分,轉移至表面皿上,晾干后稱量.[7-9]
4.3 產品檢驗
4.3.1 (NH4)2Fe(SO4)2·6H2O含量的測定
準確稱取1.0000g產品于250mL錐形瓶中,加50mL除氧的蒸餾水、15mL 3 mol/L H2SO4、2mL濃H3PO4,使試樣溶解.加熱至70-80℃,用KMnO4標準溶液滴定至終點.
根據KMnO4標準溶液的用量,按照反應方程式計算產品中(NH4)2Fe(SO4)2·6H2O的質量分數.
4.3.2 Fe3+的含量分析
(1)[Fe(SCN)6]3-最大吸收峰的確定
準確移取1.0000mL 0.01 mol/L Fe3+標準溶液于50mL容量瓶中,加4滴2mol/L HCl和2mL1mol/L KSCN溶液加水至50mL刻度,混勻,以空白液為參比液,在可見光區內(400-600nm),用TU-1810型紫外-可見分光光度計測其吸光度.
如圖1所示,[Fe(SCN)6]3標準溶液最大吸收峰波長為480nm.
(2)Fe3+標準曲線的繪制[10]
準確移取一定體積的0.01mol/L Fe3+標準溶液,分別加入50mL容量瓶中,各加4滴2mol/LHCl和2mL1mol/L KSCN溶液,加水至刻度混勻.配制成一系列Fe3+標準溶液,以空白液為參比液,測其在最大吸收峰的吸光度.繪制標準曲線如圖2.
曲線線性回歸方程為:y=1.002x+0.0016.R2=0.9976,線性關系良好.
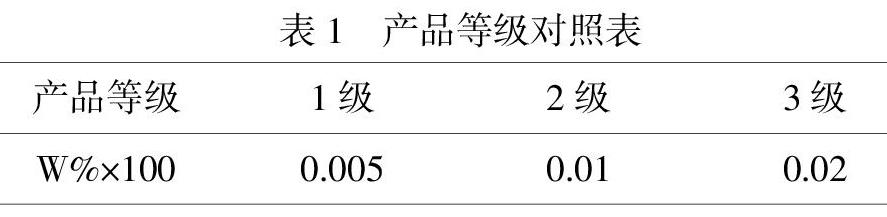
(3)準確稱取2.0000g產品,置于小燒杯中,加少量除氧的蒸餾水使之溶解,再加入3mL 2 mol/L HCl溶液和1mL mol/L KSCN溶液,轉移至50mL容量瓶中,最后用除氧的蒸餾水稀釋到50.0mL,搖勻.用722N型分光光度計,在最大吸收峰波長480nm下測其吸光度,根據標準工作曲線公式計算Fe3+的體積,進而算出Fe3+質量分數W%,再用質量分數W%×100后與表對照以確定產品等級.
4.3.3 NH4+含量的分析
稱取產物1.0000g于干燥的50mL蒸餾燒瓶中,然后取11mL 4mol/L NaOH于其中,用玻璃導管將產生的氨氣導入盛有10mL 3mol/L HCl的250mL錐形瓶中,用酒精燈加熱蒸餾燒瓶底部,直至無氣泡產生為止.終止反應后,以酚酞為指示劑,用4.0000mol/L NaOH滴點多余的酸.
4.3.4 SO42-含量的測定
準確稱取產物0.5000g于150mL燒杯中,用5mL蒸餾水充分將其溶解,向其中加入5mL 0.6 mol/L的BaCl2,使其充分沉淀后,再向其中加入過量鹽酸,至無氣泡為止,以除去多余的碳酸鋇沉淀.將沉淀過濾,用蒸餾水洗滌沉淀.最后,烘干,稱量.
改用鐵粉為原料,重復4.1,4.2,4.3.2(3),4.3.3,4.3.4的操作.鐵粉不用洗滌.
為了避免偶然性,我們每個實驗都做了重復.成分的檢測,以分析純做了對照.
5 實驗結果分析
5.1 硫酸亞鐵銨產率
以鐵粉做原料的,反應到45分鐘,幾乎沒有氣泡.以鐵屑作原料的,反應到60分鐘幾乎沒有氣泡.從表2看出,鐵粉和鐵屑做原料的最高產率分別為92.76%和88.58%.
5.2 (NH4)2Fe(SO4)2·6H2O含量的測定
通過表3數據可看出,鐵屑做原料所得產品純度都比較高.反應50min時純度最高,達到98.08%.
5.3 Fe3+的含量分析及產品等級
通過測定Fe3+的含量,又經過換算對比得到產品等級.所制得的產品中多為二級產品.只有一組鐵屑反應50min制得的產品三價鐵含量最低,為一級產品.
5.4 NH4+含量的分析
從表4數據看出,所得產物中的NH4+含量都高于分析純試劑中的.但用鐵屑做原料,相對來說,更接近分析純試劑中的NH4+含量.各個時間段的NH4+含量相差不大,以50min中所得產物中的NH4+含量最接近分析純試劑中的NH4+含量.這是因為對反應剩余物質稱量有誤差,導致加入過多(NH4)2Fe(SO4)2的緣故.鐵粉粒徑很小,易于在濾紙上沾附,容易出現稱量偏差.
5.5 SO42-含量的分析
根據表5分析,鐵屑作原料,反應20min、30min、40min的產物中,SO42-含量都接近分析純試劑中的SO42-含量,50min的最接近分析純的SO42-含量.但反應60min的產物中,SO42-高于分析純試劑中的SO42-含量.用鐵粉做原料的,SO42-均遠遠高于分析純試劑中的SO42-含量,和NH4+分析的結果一致.
在以鐵屑制備硫酸亞鐵銨的實驗中,將鐵屑反應時間控制在50min時反應已無大量氣泡,產品為淺綠色晶體.若反應時間超過50min,繼續加長反應時間直至無氣泡,雖然可以提高產量,但會導致加入過量的硫酸銨,使產品純度降低.
以鐵粉做原料的實驗中,將鐵粉反應時間控制為40min時,反應已無大量氣泡.且硫酸亞鐵銨產量僅次于反應時間為45min時的產量.通過NH4+含量的分析和SO42-含量的分析發現,以鐵粉制備硫酸亞鐵銨,無論制備硫酸亞鐵反應時間控制在多少,都存在加入過量硫酸銨的問題.最終使硫酸亞鐵銨純度下降.
6 總結
實驗結果分析表明,分別以鐵屑和鐵粉制備硫酸亞鐵銨的實驗中,在制備硫酸亞鐵時,鐵屑的最佳反應時間為50min,在此反應時間下制備的產物顏色為淺綠色、最高產率為87.52%、最優等級為1級、最高純度為98.08%.產物中所含雜質硫酸銨較少.而鐵粉的最佳反應時間為40min,在此反應時間下制備的產物顏色為淺綠色(略帶點白色)、最高產率為91.85%、最優等級為2級、最高純度為90.65%.但產物中所含的硫酸銨較多.綜合二者比較,鐵粉雖反應要快一些,產率要高一些.但伴隨著的是純度下降,等級降低,硫酸銨加入過量,產品色澤差.所以,綜合考慮,本實驗的最佳條件為以鐵屑制備硫酸亞鐵銨,鐵屑最佳反應時間為50min.
參考文獻:
〔1〕Pathak A, Dastidar M G, Sreekrishnan T R. Bioleaching of heavy metals from sewage sludge by indigenous iron-oxidizing microorganismsusing ammonium ferrous sulfate and ferrous sulfate as energy sources: acomparative study[J]. Journal of Hazardous Materials,2009,171(1):273-278.
〔2〕趙新華.無機化學實驗[M].4版.北京:高等教育出版社,2014.
〔3〕北京大學化學系分析化學教學組.基礎分析化學實驗[M].2版.北京:北京大學出版社,1998.
〔4〕耿金靈.硫酸亞鐵銨的純度和組成的測定[J].實驗技術與管理,2009,26(5):33-36.
〔5〕王永明.硫酸亞鐵銨制備實驗條件探討[J].實驗室科學,2014,17(3):11-15.
〔6〕姜述芹.硫酸亞鐵銨制備實驗的改進探索[J].實驗室研究與探索,2005,24(7):19-20.
〔7〕翟麗萍.硫酸亞鐵銨制備工業的研究[J].精細與專用化學品,2011,19(3):16-19.
〔8〕季然.硫酸亞鐵銨制備實驗條件的優化研究[J].廣東化工,2017,44(6):78-79.
〔9〕曾淼.川黨參中鐵元素含量的測定[J].時代農機,2017,44(1):155-157.
〔10〕燕翔.制備硫酸亞鐵銨單晶的實驗研究[J].首都師范大學學報,2015,36(4):49-51.

