不同糖源對酵母生長及糖利用的影響
雷雅男,謝東東,謝巖黎
河南工業大學 糧油食品學院,河南省糧油食品安全檢測與控制重點實驗室,河南 鄭州 450001
小麥粉面團中可發酵的糖有3個來源:游離的單糖(葡萄糖、果糖)、二糖(蔗糖、麥芽糖)、三糖;受損淀粉;果聚糖(由果糖單元組成)[1-4]。面團中這些可發酵糖的含量影響面團的發酵進程,包括發酵過程的產氣量、面團的發育等,且發酵期間面團的高度、氣體產量與糖的類型有顯著的相關性[5]。研究表明,蔗糖可以增加面團的延展性,賦予面團更柔軟、更黏稠的質地[6]。面團中麥芽糖含量高可以延長發酵時間,葡萄糖/麥芽糖的比值大則有較高的發酵速率[7]。面團發酵180 min后,酵母濃度最高的面團中很少有葡萄糖、果糖和麥芽糖,幾乎完全發酵[8]。破損淀粉分解后也能被酵母所利用,一般認為大分子的淀粉不能被酵母分解利用,但是在特定條件或者極端環境下酵母能否利用淀粉,還需要進一步探究。
面團的發酵是酵母對糖的利用,糖為酵母的生長代謝提供能量和構建細胞組成的碳骨架,直接或間接調節所有主要的代謝途徑[9-11]。酵母的生長分為3個階段:初始階段可發酵糖為碳源,細胞迅速生長和分裂,該階段稱為指數生長;當培養基中碳源為限制因素時,細胞生長速率下降,從發酵代謝轉變為呼吸代謝,生長階段轉變至二次生長;當營養物質耗盡,細胞進入靜止期,生長停滯,生物量保持恒定[12-13]。
酵母對面團中幾種糖的發酵規律,大多數研究是從面團發酵過程中糖濃度的變化、氣體的產生以及面團的發育出發建立一系列的相關性[5]。面團是一個復雜的發酵體,對于酵母和單一糖源之間的關系目前沒有具體的探究,因此作者采用培養基模擬面團中酵母利用不同糖源發酵的模式,觀察酵母對單一糖源的利用及自身的生長規律,對酵母的生長期進行研究。通過研究酵母對不同糖源的利用,調節面團的發酵進程從而達到預定的發酵效果,為生產實踐提供參考。
1 材料與方法
1.1 材料與試劑
高活性干酵母:安琪酵母股份有限公司;蛋白胨、酵母膏:分析純,北京奧博星生物技術有限公司;KH2PO4:分析純,天津市科密歐化學試劑有限公司;K2HPO4、MgSO4·7H2O、氯化鈉、可溶性淀粉、葡萄糖、麥芽糖等試劑均為分析純。
1.2 儀器與設備
THZ-92B氣浴恒溫振蕩器:上海躍進醫療器械有限公司;UV-6100S紫外可見分光光度計:上海美普達儀器有限公司; pHS-3C pH計:上海儀電科學儀器股份有限公司;DHG-9073BS電熱恒溫鼓風干燥箱:廣州滬瑞明儀器有限公司;DL-5-B 離心機:上海安亭科學儀器廠;LDZX-50KBS立式壓力蒸汽滅菌鍋:上海申安醫療器械廠。
1.3 方法
1.3.1 培養基的制備[7-8]
種子培養基:稱取KH2PO40.1 g、K2HPO41.0 g、MgSO4·7H2O 0.1 g、NaCl 0.1 g于錐形瓶中,加水100 mL,溶解后滅菌20 min,取出放涼備用[5]。
葡萄糖培養基:稱取KH2PO40.1 g、K2HPO41.0 g、MgSO4·7H2O 0.1 g、NaCl 0.1 g、葡萄糖2 g于錐形瓶A中,加30 mL水溶解;稱取蛋白胨2 g、酵母膏1 g于錐形瓶B中,加30 mL水溶解;滅菌后混合,加蒸餾水至100 mL備用[15-16]。
麥芽糖、淀粉培養基與葡萄糖培養基制備方法相同,無糖培養基作為對照組。
1.3.2 種子液的培養
稱取5 g活性干酵母于種子培養基中,封口后在30 ℃、180 r/min條件下培養30 min。
1.3.3 酵母生長曲線的繪制
按2%(體積比)的接種量取種子液于4種培養基中,30 ℃、180 r/min振動培養22 h。每隔2 h取樣1次,在波長 600 nm下測定OD值,繪制酵母細胞0~22 h的生長曲線[17-18]。
另外按2%(體積比)的接種量取種子液于葡萄糖和麥芽糖培養基中,培養3 h,每隔15 min取樣1次,在波長 600 nm下測定OD值,繪制酵母細胞0~180 min的生長曲線。
1.3.4 酵母生長速率曲線的繪制
按照生長速率公式:μ=(lnX2-lnX1)/(t2-t1)計算酵母各個時間點的生長速率,并繪制生長速率曲線[19]。其中X1、X2分別為酵母細胞培養液在時間t1、t2的OD600值。
1.3.5 酵母在不同生長階段細胞形態的變化
根據酵母的生長曲線,分別取延滯期、對數生長期前期、對數生長期后期、穩定期前期、穩定期后期對應的5個時間點的酵母進行觀察,具體參照李勤[17]的方法。
細胞形狀[20]分為圓形、橢圓形、近紡錘形3種形狀;在40倍光學顯微鏡下對視野內細胞的大小進行評估,分為Ⅰ、Ⅱ、Ⅲ、Ⅳ4個等級,依次變大;細胞聚集情況分為完全分散、部分聚集、大量聚集、完全聚集4種形態;出芽情況分為無出芽、個別出芽、少量出芽、大量出芽4種狀態。
1.3.6 葡萄糖濃度的測定
葡萄糖培養基取樣的時間點分別為0、1、2.5、5、7、18 h,麥芽糖培養基的取樣時間點分別為0、1、3、7、9、20 h。收集培養液于離心管中,5 000 r/min離心10 min,收集所得上清液,稀釋10倍后采用葡萄糖試劑盒測定葡萄糖濃度。
1.3.7 麥芽糖含量的測定
采用李珊[21]的方法測定麥芽糖含量。取2 mL麥芽糖溶液和2 mL DNS于比色管中混勻,沸水浴10 min后迅速冷卻,加蒸餾水定容至25 mL,在540 nm下測定吸光值,縱坐標為吸光度,橫坐標為麥芽糖含量,制作麥芽糖的標準曲線,y=0.654 3x-0.094 6 (R2=0.999 6)。按照標準曲線測定方法計算麥芽糖含量。
1.3.8 淀粉含量變化趨勢的測定
取2 g/L淀粉標準溶液 0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL 于100 mL 棕色容量瓶中,然后加入1.0 mL 0.01 mol/L I2-KI 標準溶液,加水稀釋至刻度,搖勻,第一個容量瓶作空白,在600 nm 處測定此系列溶液的吸光度[22]。以吸光度為縱坐標,淀粉含量為橫坐標,得到標準曲線y=0.299 4x+0.012 5(R2=0.994 9)。收集培養液于離心管中,5 000 r/min離心10 min,收集所得上清液,適當稀釋后測定淀粉含量。
1.3.9 不同糖源的酵母培養基pH值的測定
每隔1 h收集1次酵母細胞培養液,測定0~22 h不同糖源培養基的pH值。
1.4 數據處理
數據以平均值±標準偏差來表示,采用SPSS 16.0 進行單因素方差分析,采用 Origin 8.5作圖。
2 結果與討論
2.1 糖源對酵母生長的影響
2.1.1 糖源對酵母22 h內生長的影響
酵母在葡萄糖、麥芽糖、淀粉、無糖培養基中的生長結果如圖1和圖2所示。
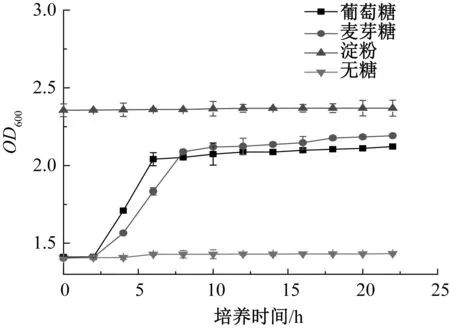
圖1 酵母在4種培養基中的生長曲線Fig.1 Growth curve of yeast in four media
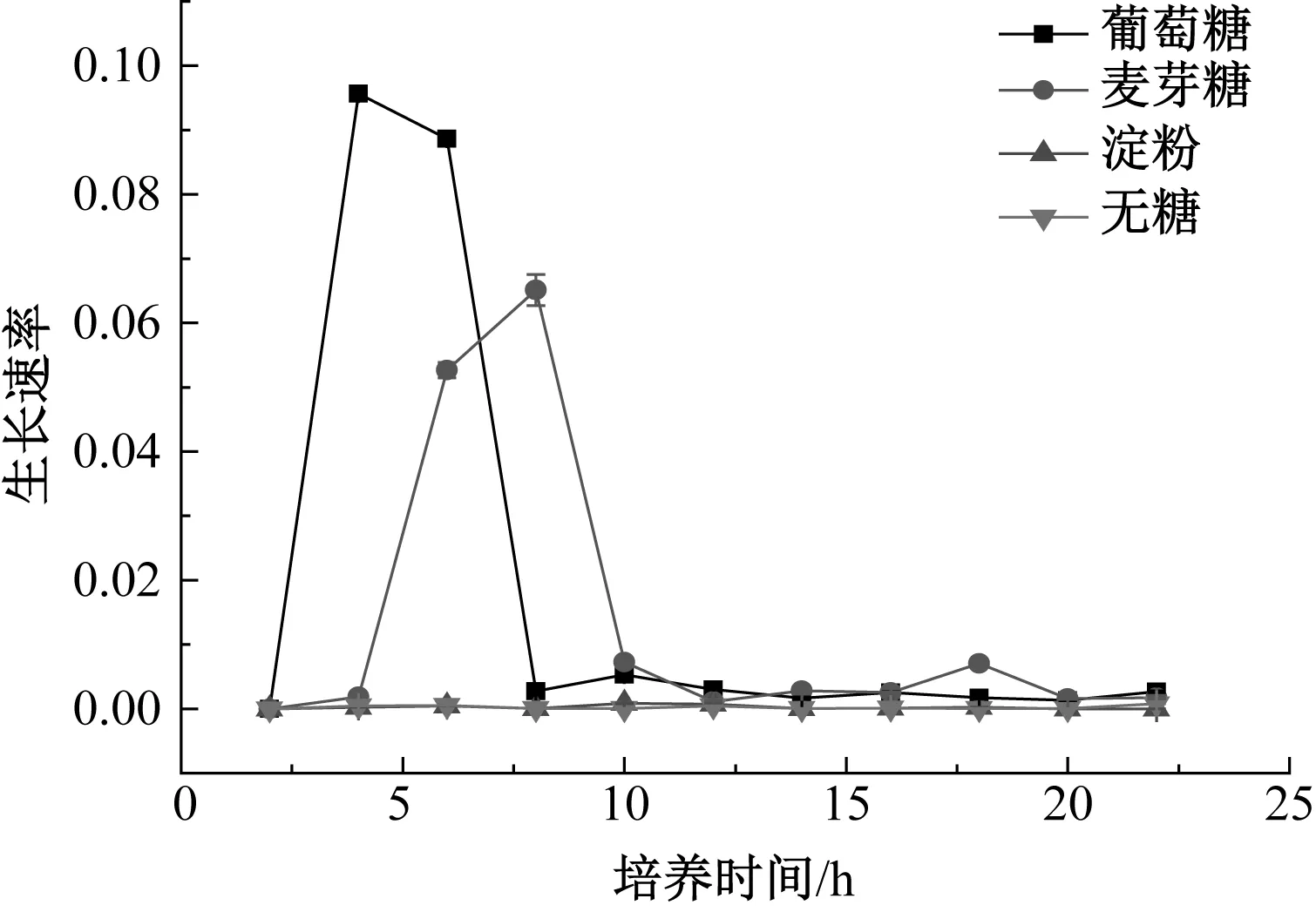
圖2 酵母在4種培養基中的生長速率Fig.2 Growth rate of yeast in four media
由圖1可知,酵母在葡萄糖和麥芽糖培養基中0~22 h有明顯的延滯期、對數生長期、穩定生長期,而在淀粉和無糖培養基中0~22 h沒有明顯的生長階段。這表明0~22 h酵母能利用葡萄糖和麥芽糖維持自身生長,不能直接利用淀粉。而酵母在淀粉培養基的吸光值偏大,可能是因為淀粉分子顆粒大,溶解度低,培養基較為渾濁。
由圖2可知,對數生長期時,酵母在葡萄糖培養基4 h時生長速率最大,在麥芽糖培養基6 h時生長速率最大。酵母能直接利用葡萄糖進行生長增殖,而麥芽糖分解成葡萄糖后才能被利用。穩定期時,酵母的生長速率幾乎為零。在淀粉和無糖環境中,酵母沒有明顯的生長階段,說明酵母沒有可利用的糖源,不能生長。酵母不能直接利用淀粉,淀粉需要在酶的作用下分解為麥芽糖才能被利用[7]。
2.1.2 糖源對酵母3 h內生長的影響
酵母在葡萄糖和麥芽糖培養基中3 h的生長結果如圖3和圖4所示。
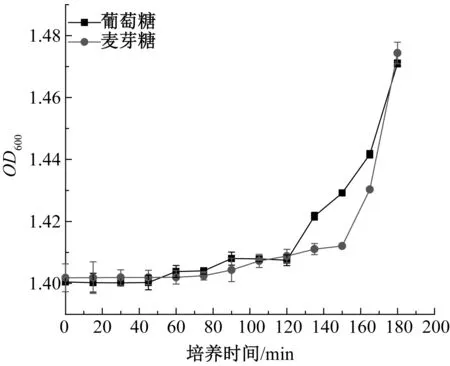
圖3 酵母在2種培養基中3 h內的生長曲線Fig.3 The first 3 h growth curve of yeast in two media

圖4 酵母在2種培養基中3 h內的生長速率Fig.4 The first 3 h growth rate of yeast in two media
從圖3和圖4可以看出,酵母在兩種培養基中的生長曲線大致相同,在葡萄糖培養基中120 min后進入對數期,而在麥芽糖培養基中150 min后進入對數期。酵母在麥芽糖培養基中的延滯期長,這是因為葡萄糖能直接被酵母轉運至細胞內進行利用[2],而麥芽糖需要被分解后才能被利用。對數期酵母在麥芽糖培養基中生長速率加快,這是因為酵母分泌麥芽糖酶將麥芽糖分解成葡萄糖,培養基中可利用的糖總量增加。
結合圖1生長曲線可以得出:在葡萄糖培養基中,0~2 h為延滯期,2~6 h為對數生長期,6~22 h為穩定期;在麥芽糖培養基中,0~2.5 h為延滯期,2.5~8 h為對數生長期,8~22 h為穩定期;在淀粉和無糖培養基中,0~22 h無明顯生長階段。
2.2 不同糖源對酵母各生長階段細胞形態的影響
2.2.1 不同糖源中酵母細胞觀察時間點的選取
根據生長曲線,選取觀察酵母細胞形態的時間點如表1所示。

表1 4種培養基中的酵母菌觀察時間點Table 1 Observation time of yeast in four media h
2.2.2 不同糖源對酵母細胞形態的影響
由表2可知,延滯期時,葡萄糖培養基中的細胞個體大,出芽早,這說明酵母能更早識別利用葡萄糖為細胞生長增殖做準備。對數期后期時,葡萄糖和麥芽糖培養基中的酵母細胞均大量出芽,麥芽糖培養基中的酵母細胞聚集程度高,這是由于對數生長期的酵母酶系活躍,代謝旺盛[23]。穩定期后期時,在葡萄糖和麥芽糖培養基中酵母細胞形態多呈近圓形,與淀粉培養基和無糖培養基相比,細胞大、數量多。穩定期時,葡萄糖培養基與麥芽糖培養基中的酵母細胞都較為分散,幾乎沒有生長。這可能是隨著培養基中的糖源消耗,營養物比例失調[23],代謝產生的乙醇等產物限制了酵母的生長,使其數量處于動態平衡之中。

表2 不同觀察時期酵母的形態Table 2 Yeast morphology at different observation time
在淀粉和無糖培養基中,5個觀察時間點中只有第3小時觀察到酵母有少量出芽增殖的情況,可能是培養基中所添加的酵母膏或細胞內積累的少量營養物質為其提供少量碳源維持其生長增殖[9, 24]。在這兩種培養基中細胞生長緩慢、數量少、個體小。在淀粉培養基中的酵母細胞聚集程度高,這可能是在蒸汽滅菌階段,淀粉分子糊化,淀粉體積膨脹、顆粒解體,限制了酵母細胞的活動。
2.3 不同糖源對酵母糖利用的影響
2.3.1 不同糖源對培養基中糖含量的影響
酵母在不同生長時期,培養基中糖含量變化如圖6—圖9所示。

圖6 葡萄糖培養基中葡萄糖濃度變化Fig.6 Change of glucose concentration in glucose medium
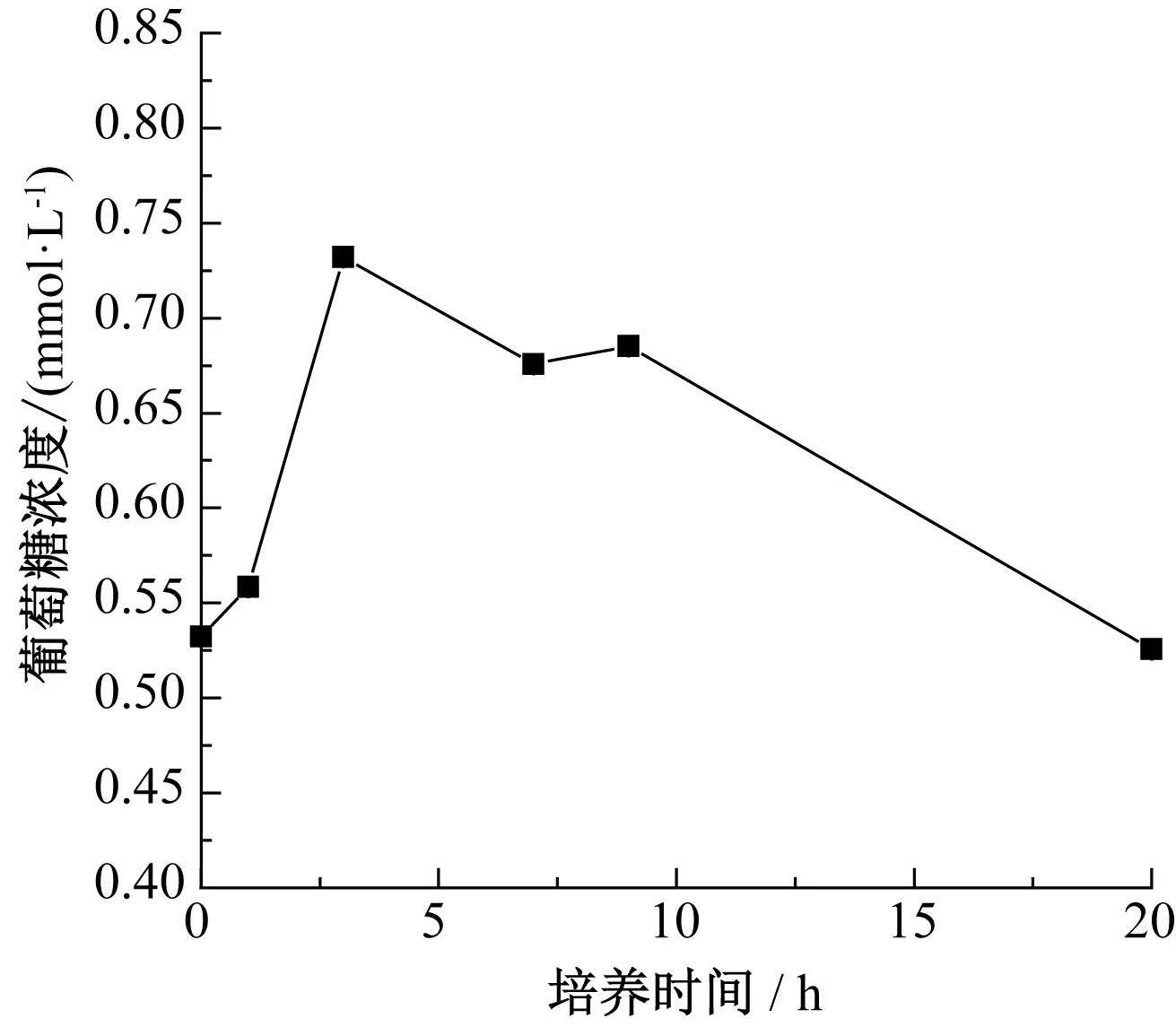
圖7 麥芽糖培養基中葡萄糖濃度變化Fig.7 Change of glucose concentration in maltose medium

圖8 麥芽糖培養基中麥芽糖含量變化Fig.8 Change of maltose content in maltose medium
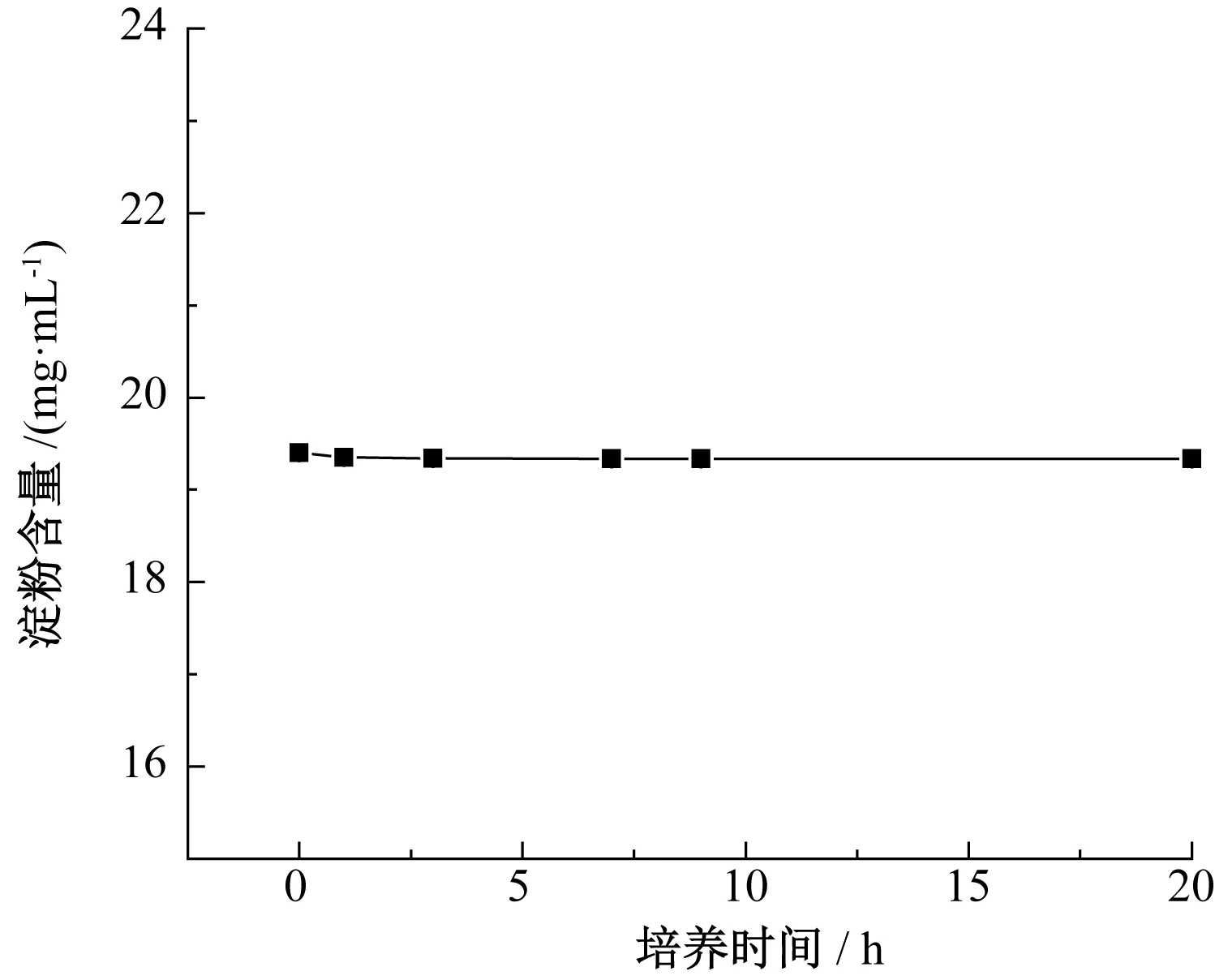
圖9 淀粉培養基中淀粉含量變化Fig. 9 Change of starch content in starch medium
由圖6可知,在葡萄糖培養基中0~7 h葡萄糖濃度下降,7 h之后趨于穩定。這表明酵母在發酵過程中消耗葡萄糖,導致其濃度下降。在對數生長期時,酵母大量增殖,消耗葡萄糖的速度也在加快。穩定期后,培養基中的葡萄糖濃度很少,此時酵母數量變化很小,生長速率幾乎為零。一方面,培養基中的葡萄糖消耗將盡;另一方面,代謝產生的乙醇等產物和pH值的下降限制了酵母的生長。
由圖7和圖8可知,在麥芽糖培養基中麥芽糖含量逐漸下降,而葡萄糖的濃度呈現先逐漸上升后下降的趨勢,這說明酵母將麥芽糖分解成葡萄糖,能間接利用麥芽糖[25]。在2~8 h,麥芽糖培養基中麥芽糖被分解成葡萄糖,出現“供”大于“求”,從而葡萄糖濃度增加。隨著酵母的生長,葡萄糖濃度呈現下降趨勢[26],這是因為酵母消耗葡萄糖的速度大于麥芽糖分解的速度。穩定期后,葡萄糖濃度很低,酵母數量達到飽和,生長速率幾乎為零。
由圖9可知,在淀粉培養基中淀粉含量無明顯變化,酵母數量無明顯變化,表明酵母細胞在0~22 h內,幾乎沒有分解利用淀粉。
2.3.2 不同糖源對培養基pH值的影響
4種培養基的pH值變化如圖10所示。在葡萄糖和麥芽糖培養基中,pH值呈先下降后穩定的趨勢,這是因為酵母代謝旺盛,代謝產物琥珀酸能影響培養基的pH值[8]。在葡萄糖培養基中,穩定期后葡萄糖含量下降[27],酵母數量也趨于穩定,pH值后期趨于穩定,這可能是酒精的累積、大分子物質的分解和弱堿性物質(堿性氨基酸、核苷酸、高級醇等)的大量增加所引起的[25]。在淀粉培養基中,培養基的pH值和淀粉的含量變化不明顯,表明在0~22 h酵母細胞沒有利用淀粉[28]。
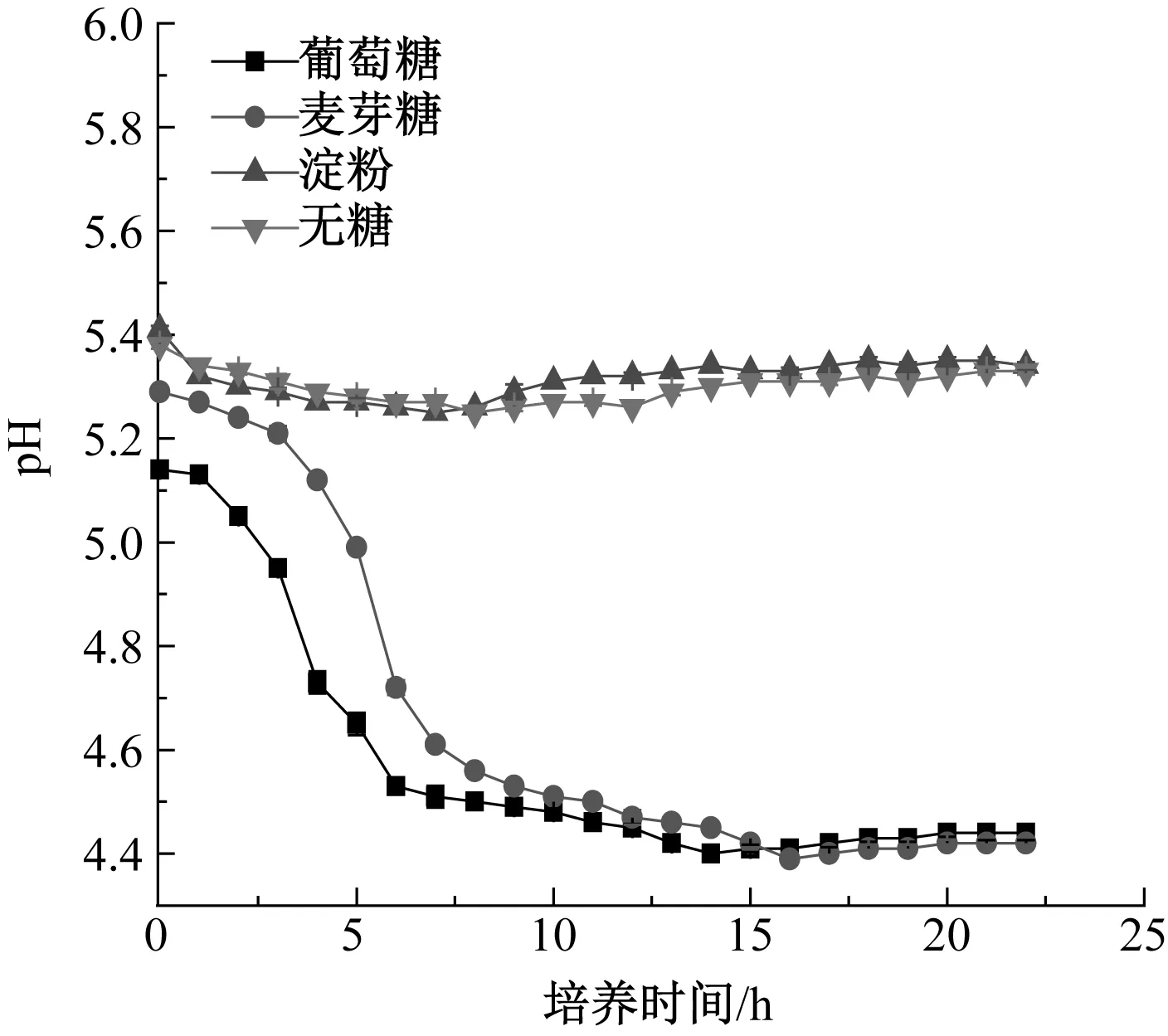
圖10 4種糖源培養基pH值的變化Fig.10 Changes of pH in four media
3 結論
酵母在含有葡萄糖和麥芽糖的培養基中能大量生長增殖,均有明顯的延滯期、對數期和穩定期。酵母在麥芽糖培養基中比在葡萄糖培養基中的對數生長期長,對麥芽糖的利用速度低于葡萄糖。酵母在淀粉培養基和無糖培養基中無明顯的生長階段,細胞數量在22 h內僅有少量增殖,但酵母細胞能否在長期的饑餓狀態下適應性地間接分解利用淀粉,還需要做進一步的研究。

