CAV-1感染MDCK中各IFN及受體分子表達譜的差異*
孟 興 佟相慧 陳洪巖 韓凌霞
(中國農業科學院哈爾濱獸醫研究所實驗動物與比較醫學團隊/獸醫生物技術國家重點實驗室,黑龍江省實驗動物與比較醫學重點實驗室,哈爾濱 150069)
干擾素(IFN)是機體免疫調節和抗病毒感染的一類重要細胞因子,通過受體介導活化效應細胞發揮功能。IFN是依據受體分子劃分的。干擾素I型干擾素的受體廣泛分布于單核細胞、巨噬細胞、B細胞、T細胞、血小板、內皮細胞、腫瘤細胞等,II型干擾素的受體與I型干擾素受體有一定的同源性,分布也較廣泛。III型干擾素的受體主要分布于各種內皮細胞[1-2]。
Ⅲ型干擾素包含多個IFN-λ家族。目前已鑒定出人有IFN-λ1、IFN-λ2、IFN-λ3和IFN-λ4等4種[3],豬有IFN-λ1和IFN-λ3[4]。豬IFN-λ1和IFN-λ3可以抑制豬流行性腹瀉病毒在豬腸內皮細胞復制[5],小鼠IFN-λ可以調控小鼠諾如病毒在腸黏膜表面的感染[6]。目前文獻報道中只有犬IFN-λ1,公布了IFN-λ3的推測序列[7],而IFN-λ3在犬體外的基礎表達量如何,尚未見報道。
犬腎小管上皮細胞(Madin-Darby canine kidney,MDCK)是最常用的犬細胞系,來源于考克斯班尼犬腎臟,該腎臟細胞原代培養時其形態類似于成纖維細胞,經過胰蛋白酶/EDTA消化液的連續6次消化培養而純化成上皮樣細胞,具有遠端腎小管與集合管細胞的分化特性,被廣泛用于代謝研究和藥物篩選研究,尤其是犬病病毒和流感病毒體外培養的支持系統。僅2019年在中國知網上以“MDCK細胞”為關鍵詞搜索到的正式發表論文就有18篇,研究內容涉及抗生素對MDCK細胞的凋亡[8]、犬病毒感染[9]以及禽流感病毒的研究[10-11]。
聚肌胞苷酸(PolyI∶C)是雙鏈RNA的類似物,常用于干擾素的誘導劑。犬I型腺病毒(CAV-1)引起的犬傳染性肝炎是全球養犬業和毛皮經濟動物養殖業危害最嚴重的疾病之一,主要通過疫苗免疫[12]。本研究利用定量PCR技術分別檢測了正常MDCK、Poly I∶C刺激和CAV-1感染后,以初步了解MDCK內各種IFN及其受體分子的轉錄表達水平。
1 材料與方法
1.1 材料
犬腎細胞系(MDCK)由本實驗室保存。犬腺病毒1型(CAV-1)由軍事醫學科學院軍事獸醫研究所扈榮良教授惠贈。PolyI∶C購自Sigma公司;TransStart Tip Green qPCR Super Mix購自北京全式金生物技術有限公司。
1.2 方法
1.2.1不同亞型犬IFN及其受體分子的相對定量PCR方法的建立:用含5%新生牛血清的DMEM培養液培養MDCK細胞,于37 ℃ 5% CO2培養箱內培養成單層。按照產品說明書,用Simply P總RNA提取試劑盒提取細胞總RNA,用TaKaRa反轉錄(SYBR用)反轉錄試劑盒反轉錄為cDNA。根據NCBI上公布的犬IFN各亞型及其受體分子的核苷酸序列(見表1),利用Primer 5.0軟件,設計染料法相對定量PCR(qPCR)方法特異性引物,由哈爾濱博仕生物技術有限公司合成。IFN-α[13]和IFN-λ1[14]的特異性引物來自參考文獻。qPCR反應體系為:2×Trans Start Tip Green qPCR Super Mix 10 μL、引物(10 μmol/L)各1 μL、cDNA 1 μL、ddH2O 7 μL。反應程序為:94 ℃ 30 s、94 ℃ 5 s、72 ℃ 30 s,40個循環。均以GADPH為內參。PCR產物經試劑盒回收,以擴增引物為測序引物,雙向測序。測得的有效序列與NCBI發布的參考序列進行同源性比對。

表1 犬IFN及其受體分子的相對定量PCR方法的引物信息Table 1 Primer information for quantitative PCR assays for canine IFNs and their receptor molecules
1.2.2MDCK細胞中各干擾素及其受體轉錄水平的檢測:正常培養MDCK細胞,長成單層后,棄掉培養液,反復凍融細胞瓶,收獲細胞。同1.2.1方法提取總RNA,隨機引物反轉錄成cDNA。以GAPDH為內參基因,以目的基因的Ct值減去內參基因的Ct值作為該被檢基因的ΔCt值,通過ΔCt值比較正常MDCK細胞中各IFN及其受體分子的相對含量。
1.2.3Poly I∶C處理的MDCK細胞中各干擾素及其受體轉錄水平的檢測:利用100 ng/mL Poly I∶C處理MDCK單層細胞,用2%血清濃度的DMEM培養液于37℃ 5% CO2培養箱內培養,24 h后收獲細胞。提取以正常MDCK細胞中的作對照,利用定量PCR,檢測MDCK中IFN-β、IFNAR1、IFN-λ1、IFN-λ1R、IFN-λ3和IFN-λ3R轉錄水平的相對含量。
1.2.4CAV-1感染MDCK細胞中各干擾素及其受體相對轉錄水平的檢測:將MDCK細胞鋪到6孔板中,待密度達到70%~80%,棄去培養板中的培養基,PBS洗兩遍。加入MOI=1的CAV-1病毒,37 ℃感作1.5 h后,更換血清終濃度為2%的DMEM維持液,37 ℃細胞培養箱培養。24 h后采用凍融方式收獲細胞。設正常MDCK細胞作對照。提取病毒總RNA,反轉錄為cDNA,進行定量PCR,分析IFN-β、IFN-λ1、IFN-λ3、IFNAR1、IFN-λ1R和IFN-λ3R的相對轉錄水平。
1.3 統計方法
對所測樣品的數值進行計算,用2-ΔΔCt表示,其中ΔCt=目的基因Ct值-內參基因Ct值,ΔΔCt=處理組ΔCt-對照組ΔCt。比較處理組與對照組的目的基因的水平差異。采用SPSS 16.0軟件對所得數據進行分析。各組數據均以平均值±標準差表示,用t檢驗分析數據,P<0.05為統計學顯著性差異,P<0.01為極顯著。
2 結果
2.1 犬各干擾素及其受體分子定量PCR方法的建立
以MDCK細胞cDNA為模板,按照優化條件,對各IFN分子及其受體分子進行定量PCR反應。熔解曲線可見均為單峰,無雜峰,表明特異性較好(圖1),各被檢基因可以同時上機反應。Blast序列比對結果表明,IFN-λ3的擴增產物序列與NCBI發布的IFN-λ3推測序列XM-02542186.1的同源性為100%。
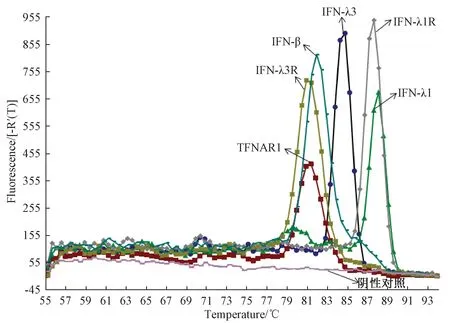
圖1 犬IFN分子及其受體分子的定量PCR檢測峰圖Fig.1 Results of quantitative PCR of various canine IFNs and their receptor molecules
2.2 MDCK細胞中各干擾素及其受體的水平的檢測
針對內參基因GAPDH的相對定量計算結果表明,培養24 h的MDCK細胞中,IFN-β、IFN-λ1、IFN-λ3、IFNAR1、IFN-λ1R和IFN-λ3R基因的轉錄產物都能明顯檢測到,且IFN-λ3R的ΔCt極顯著低于其他被檢分子(P<0.001),即其轉錄含量均極顯著高于其他被檢分子,見圖2。
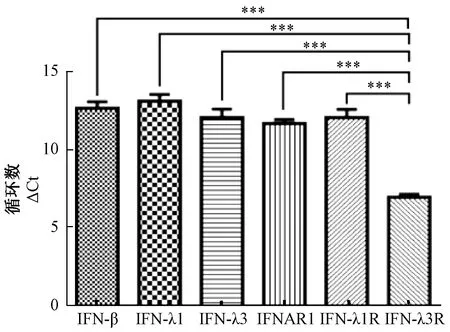
圖2 MDCK細胞中IFN及其受體分子的相對轉錄水平(用循環數表示)注:***P<0.001Fig.2 Relative transcriptional levels of various IFNs in MDCK (displayed as cycle numbers)Note:***P<0.001
2.3 Poly I∶C處理的MDCK細胞中各干擾素及其受體轉錄水平的檢測
用Poly I∶C處理MDCK細胞24 h后,定量PCR檢測結果表明,IFN-λ1R的轉錄水平最高,極顯著高于IFN-λ1和IFNAR1(P<0.01),高于IFN-β、IFNAR1、IFN-λ3和IFN-λ3R,但未達到統計學差異,見圖3。

圖3 Poly I∶C處理MDCK細胞中各IFN及其受體分子轉錄水平的相對含量注:**P<0.01Fig.3 Comparative expression of mRNA transcription levelsamongIFNs in Poly I∶C-treated MDCK CellsNote:**P<0.01
2.4 CAV-1感染MDCK細胞中各干擾素及其受體相對轉錄水平的檢測
MDCK細胞感染CAV-1 24 h后,與正常細胞比較,IFN-α的含量顯著上升,是正常細胞的6倍以上,顯著高于IFN-λ1(P<0.05),極顯著高于IFN-λ1R、IFNAR1、IFN-λ3、IFN-λ3R和IFN-β的轉錄水平(P<0.01),見圖4。
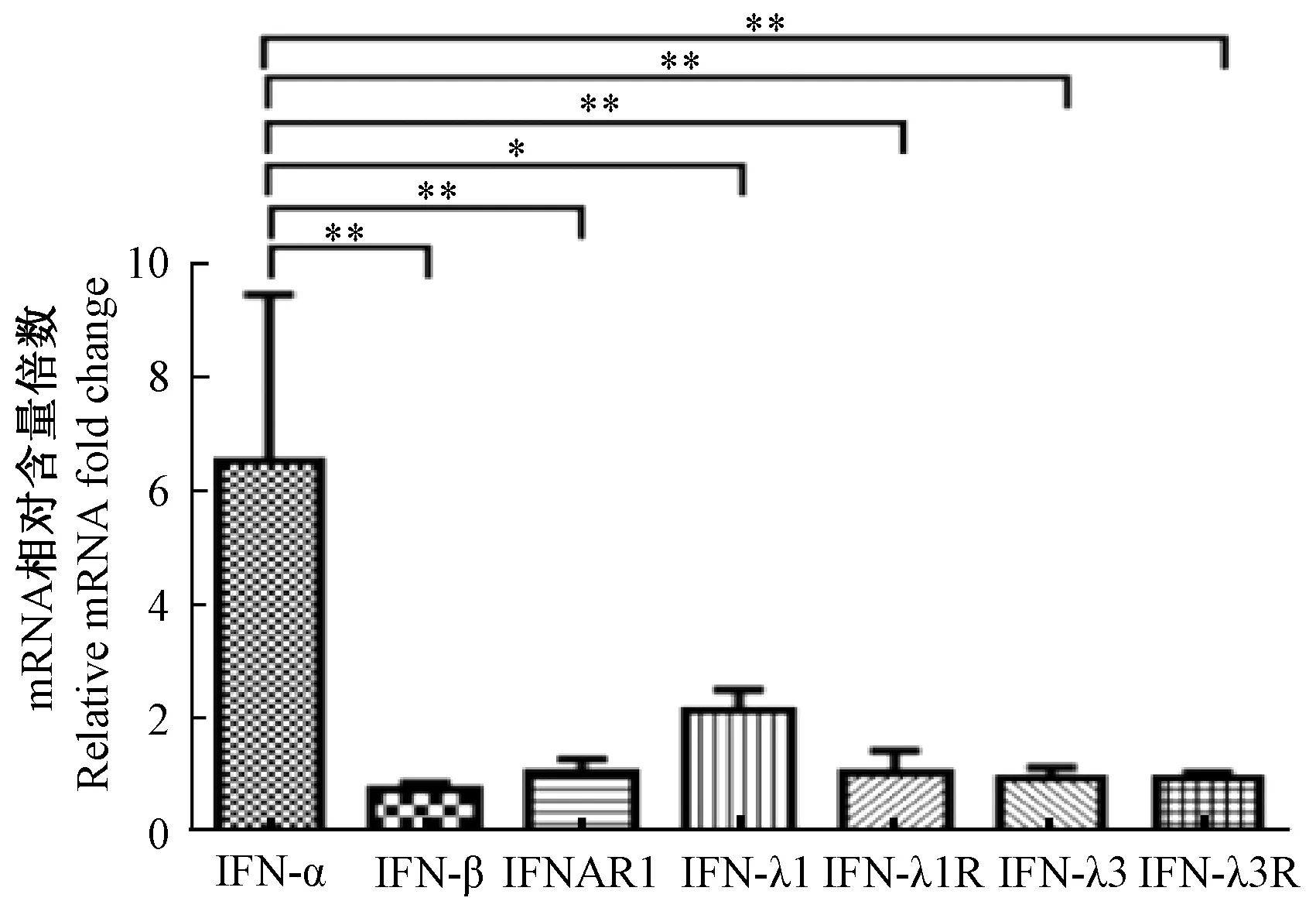
圖4 CAV-1感染MDCK細胞后各干擾素及其受體mRNA含量的相對比較注:*P<0.05,**P<0.01Fig.4 Comparison of IFN and its receptor mRNA contents in MDCK cells infected with CAV-1Note:*P<0.05, **P<0.01
3 討論
IFN-λ的受體蛋白IFNLR是IL-28Rα鏈和IL-10Rβ鏈組成的異二聚體,IFN-α/β的受體是IFNAR1和IFNAR2組成的異二聚體IFNAR[15-16]。IFNⅠ型與III型干擾素都有抗病毒的功能,但是IFN-λ比IFN-α/β對內皮細胞的作用更強,對黏膜感染更有特異性[17]。例如,IFN-λ通過結合腸內皮細胞表面的受體,能間接調控小鼠諾如病毒引起的持續感染、糞排毒以及組織中的病毒含量[6],而INF II型以免疫調節為主。
之前已有報道在正常MDCK內檢測到了IFN-λ1R和IFN-λ3轉錄產物,但未比較轉錄水平[14]。本研究結果表明,正常MDCK細胞內,IFN-β、IFN-λ1和IFN-λ3的轉錄水平相近。III型IFN中的λ1受體基因(IFN-λ1R)與I型IFN的受體基因(IFNAR1)轉錄水平相近,但均遠低于λ3的受體分子(λ3R),達到極顯著性差異。
經過Poly I∶C刺激24 h后,MDCK內轉錄出的IFN-β和IFN-λ1接近,雖低于IFN-λ3,但沒有統計學意義。3種被檢受體分子中,IFN-λ1R的含量比正常細胞多了3倍有余,與I型IFN的受體分子基因達到極顯著性,與同是III型的λ3受體無統計學差異。Ichihashi等用Poly I∶C處理MDCK 24 h后,IFN-λ3的轉錄水平升高達到了顯著性[14]。
體內研究結果表明,腺病毒能夠介導IFN-γ基因的表達[18]。已有報道表明病毒感染后,Ⅰ型IFN與III型干擾素雖然都有抗病毒功能,二者的受體分子的氨基酸同源性只有30%,但胞內信號轉導機制類似[19]。MDCK感染I型腺病毒24 h后,除IFN-α的表達量明顯上調外,其他干擾素及其受體分子之間均無顯著性差異,表現出與Poly I∶C的刺激結果明顯不同的表達譜。提示在利用Poly I∶C作為刺激劑對照時,應考慮到其代表性。
本研究探討了犬MDCK細胞中I型和III型干擾素受體分子的表達譜,并與Poly I∶C處理和腺病毒感染進行了比較,為利用MDCK開展研究提供了一定思路。

