Cd對濕地匍燈蘚葉綠體損傷與活性氧的影響
李朝陽,肖鈞文,左深君,曹子藤,李垣鑫,田向榮
(1.湖南吉首大學生物資源與環境科學學院,湖南 吉首 416000;2.植物資源保護與利用湖南省高校重點實驗室,湖南 吉首416000)
鎘是“五毒”重金屬元素(Cd、Hg、Pb、Cr、As)之首,屬于環境優先污染物,在水中的溶解度很大,遷移性也很強。受工礦業生產排污和農耕施肥等人類活動影響,Cd已經成為我國農田土壤污染最廣的重金屬元素[1],被列為當前農業面源污染防治的重要對象之一。Cd易被植物吸收,過量的Cd在植物體內積累會影響植物正常的生長發育,主要表現在對質膜的損傷以及植物細胞內穩態的影響[2-3]。植物一方面可通過不同器官和亞細胞結構對Cd進行區隔化來減輕其對自身的毒害[4],如細胞壁對Cd的固定作用以及胞內的液泡區室化機制等[5-6];另一方面則是通過抗氧化體系的調節作用來減輕活性氧暴發對植物的傷害[7]。
苔蘚植物有許多能適應逆境的生理特征,如只由單層或者幾層細胞構成、比表面積大、細胞膜上有很多陽離子交換位點、能從葉片表面直接吸收營養物和其他金屬離子等[8],因此常被用來監測環境中的污染物及污染程度[9]。研究表明細胞壁是苔蘚植物累積重金屬的主要場所[10],抗氧化體系在蘚類植物抵抗Cd毒過程中發揮了重要的作用[11-12],然而Cd在蘚體的亞細胞分布與抗氧化體系間的內在聯系卻較少有人關注。濕地匍燈蘚(Plagiomniumacutum)是一種寬幅生態植物,我們前期研究發現它對Cd和Pb都有較強的吸收能力,并在2 h內就能對重金屬脅迫作出反應,與青蘚和尖葉擬船葉蘚比較,低Cd(1 mg·L-1)脅迫下該蘚類細胞表現出較強的耐性,在遭受Cd、Pb復合脅迫時,濕地匍燈蘚采取了優先選擇吸收Pb的避重就輕吸收策略,因此濕地匍燈蘚是研究重金屬脅迫的良好材料[13-15]。基于此,本文繼續以濕地匍燈蘚為試驗材料,研究其在不同濃度的Cd脅迫下葉綠體的變化、Cd在亞細胞中的分布及活性氧代謝特征,從微觀水平探討濕地匍燈蘚對Cd脅迫的響應機制,以期更深入地探索蘚類植物防御重金屬傷害和耐重金屬脅迫的機理,為重金屬污染治理和修復提供參考依據。
1 材料與方法
1.1 試驗材料
濕地匍燈蘚采于湖南吉首大學校園綠化區(28°17'27″N,109°43'12″E)。材料采回后立即用超純水清洗干凈,將表面水分用濾紙吸干后,進行Cd脅迫處理。
1.2 試驗設計
本試驗根據課題組對花垣礦區Cd的本底值調查結果(0.3~9 mg·kg-1)和文獻[16]設置Cd濃度分別為0、1、5、10 mg·L-1共4個梯度,采用CdCl2·2.5H2O(分析純)進行處理,每個處理3個重復。試驗采用浸沒培養方法進行,具體過程為:將鮮質量為2.0 g的蘚體放入150 mL上述Cd濃度處理液中,常溫下培養7 d后,將材料取出,先用純水將其洗凈,再用超純水沖洗2~3遍后,分別測定各項指標。
1.3 葉綠體觀察
剪取枝頂相同部位的葉片,壓制成水封片后采用光學顯微鏡(Leica DM2000)于高倍鏡下觀察葉細胞形態變化(目鏡10×,物鏡100×),選擇葉片同一個部位進行觀察。
1.4 亞細胞組分分離
亞細胞組分分離參照Weigel[17]及Rathore等[18]的方法并進行改進。材料加入預冷后的勻漿液少許,冰浴研磨勻漿,勻漿液全部轉入10 mL的離心管中,并用勻漿液補足體積至10 mL后離心(2200 r·min-1,30 s),下部沉淀以及底層碎片即為細胞壁組分F1(包括胞間隙),將上清液在5500 r·min-1的條件下離心45 min,沉在底層的碎片為細胞器組分F2,其上層清液即胞質組分F3(包括液泡和細胞質)。
1.5 測定方法
超氧陰離子自由基(O-2·)產生速率參考Elstner等[19]方法測定;H2O2含量采用 Patterson等[20]方法測定;蛋白質含量測定采用考馬斯亮藍法[17];谷胱甘肽還原酶(GR)和抗壞血酸過氧化物酶(APX)活性測定參考黃愛纓等[21]方法進行;參考文獻[22]對抗壞血酸含量進行測定,脫氫型抗壞血酸(DHA)可由二硫蘇糖醇還原成還原型抗壞血酸(ASA),測得總抗壞血酸(ASC),然后從中減去ASA得到DHA的含量;各亞細胞組分的Cd含量參考文獻[23]方法進行。
1.6 數據分析與作圖
采用SPSS17.0對數據進行處理和差異顯著性分析,用WPS作圖。
2 結果與分析
2.1 Cd脅迫對濕地匍燈蘚細胞的損傷
由圖1可看出,對照組細胞大小均勻,細胞壁邊界清晰,葉綠體鮮綠色,均勻分布于細胞內,胞內無空隙(圖1a)。當遭受到1 mg·L-1Cd脅迫時,濕地匍燈蘚細胞出現中毒癥狀,細胞大小不一,形狀變得不規則,細胞壁木質化明顯,細胞內形成較大的空泡,葉綠體縮小成球狀并被擠到細胞的邊緣(圖1b)。當Cd濃度增加到5 mg·L-1時,細胞出現劇烈腫脹,細胞間隙變大,葉綠體被嚴重擠壓變形,部分細胞的葉綠體出現解體(圖1c)。當Cd濃度增加到10 mg·L-1時,細胞完全變形,細胞壁木質化程度更加嚴重,葉綠體進一步縮小成顆粒并聚集成團,細胞空泡化嚴重(圖1d),表明植物體已經受到了較嚴重的傷害。

圖1 Cd對濕地匍燈蘚細胞的損傷(×1000)Figure 1 The damage of cells in Plagiomniumacutum under Cd stress
2.2 Cd在濕地匍燈蘚亞細胞組分中的分布
為了揭示濕地匍燈蘚細胞損傷的原因,分析了Cd在蘚體內的分布情況。由表1可知,隨Cd脅迫濃度的增加,濕地匍燈蘚各亞細胞組分中的Cd含量也顯著增加,與環境Cd含量存在顯著的濃度效應關系。大部分Cd都集中分布在濕地匍燈蘚的細胞壁(F1)中,占Cd吸收總量的58.4%~76.5%;細胞器(F2)中含量次之,分布比例為19.2%~27.3%,細胞質(F3)中占比最少,僅為4.3%~16.5%。隨著Cd脅迫濃度增加,F2和F3中的Cd含量逐漸增加,F1中的Cd分配比例減少,由76.5%降低至58.4%,F2和F3中的Cd分配比例則顯著上升,F2中的分配比例由19.2%增加到27.3%,F3中的分配比例則從4.3%急劇升高到16.5%,盡管10 mg·L-1Cd處理時略有回落,仍高達14.3%,表明濕地匍燈蘚細胞壁是Cd的主要吸收場所,但隨著Cd濃度加大,細胞壁阻留Cd的能力達到飽和,Cd進入細胞內,并主要停留于細胞器內。
2.3 Cd脅迫對濕地匍燈蘚O-2·和H2O2含量的影響
為了進一步闡明細胞受損傷的原因,對Cd脅迫下蘚體內活性氧自由基(O-2·和H2O2)的累積情況進行了分析,結果如圖2所示。總體而言,蘚體內的O-2·累積量隨Cd濃度的增加呈現先降后升的趨勢,當Cd濃度低于5 mg·L-1時,蘚體內的O-2·累積量出現隨Cd濃度增加而降低的現象,并在5 mg·L-1時達到最低值,比對照組減少了15.8%,然而當Cd濃度增加到10mg·L-1時,蘚體內的O-2·累積量出現了激增,比對照組增加了7.9%。
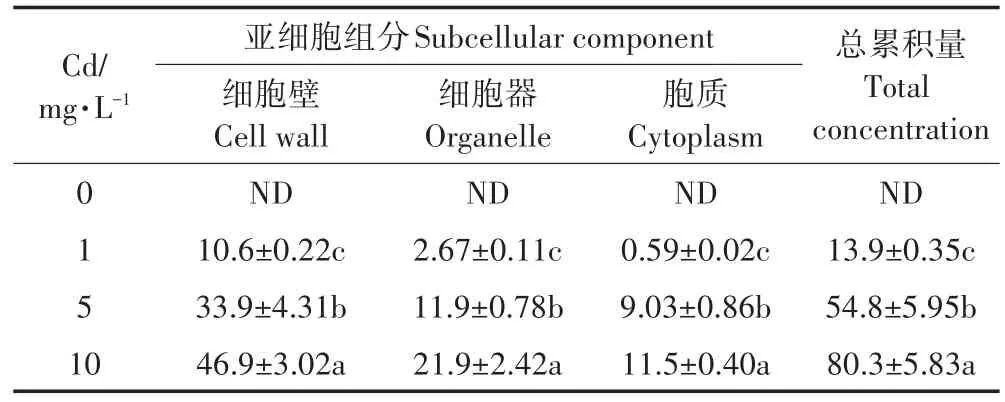
表1 不同濃度Cd處理濕地匍燈蘚亞細胞組分Cd含量(μg·L-1)Table 1 Contents of Cd in subcellular fractions of Plagiomnium acutum under Cd treatments(mean±SE,n=3)(μg·L-1)
由圖2可以看出,H2O2含量隨Cd脅迫濃度增加而持續增大,盡管在1 mg·L-1時H2O2累積量低于對照,但當Cd濃度由5 mg·L-1增加到10 mg·L-1時,蘚體H2O2含量分別比對照增加了3.4%和13.7%。
2.4 Cd脅迫對濕地匍燈蘚APX和GR酶活性的影響
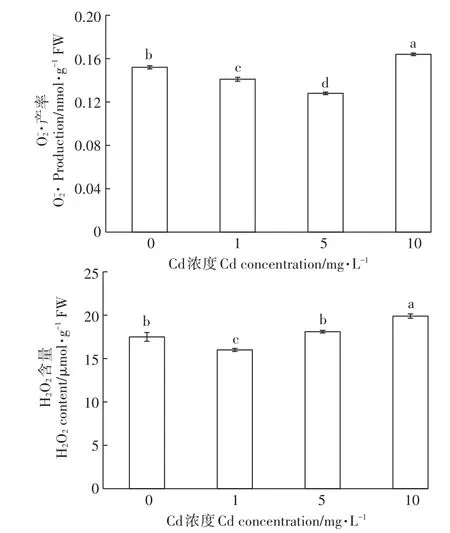
圖2 Cd脅迫對濕地匍燈蘚O-2·和H2O2含量的影響Figure 2 Effects of Cd stress on O-2·and H2O2 contents in Plagiomniumacutum
APX和GR均為蘚體內重要的氧化還原酶類,APX能以AsA作為電子供體使H2O2轉化為H2O,而GR則是通過參與AsA-GSH循環在清除機體產生的活性氧中發揮作用。圖3結果表明,Cd脅迫使蘚體內兩種酶活性均顯著增強,不同的是,APX活性隨Cd脅迫濃度增加而逐漸下降,而GR活性則表現為逐漸增強。當Cd濃度從 1 mg·L-1增加到 10 mg·L-1時,APX活性分別比對照增加了947%、810%和712%,GR活性分別比對照增加了430%、765%和1124%。APX活性隨Cd脅迫濃度增加逐漸降低表明其保護作用是有限的,當環境Cd超過一定濃度后其保護作用逐漸減弱。GR酶活性隨Cd濃度增加而逐漸增加表明其在濕地匍燈蘚抵抗Cd毒過程中起著至關重要的作用。
2.5 Cd脅迫對濕地匍燈蘚抗壞血酸含量的影響
為了進一步考察濕地匍燈蘚對活性氧清除機制,對其抗壞血酸含量變化進行了分析,結果見圖4。由圖4可以看出,濕地匍燈蘚體內ASC和ASA含量均隨Cd脅迫濃度增加顯著升高,呈現出顯著的劑量效應關系。與對照相比,隨Cd脅迫濃度增加,ASC和ASA含量分別增加了37.5%和42.7%、46.9%和72.7%、71.3%和89.2%,其中ASA增長的幅度顯著高于ASC,同時ASA/DHA比值持續增加,最高達到了1.3,表明Cd脅迫促進了濕地匍燈蘚ASA的生成,ASA在蘚體解除Cd毒害中可能發揮了重要作用。
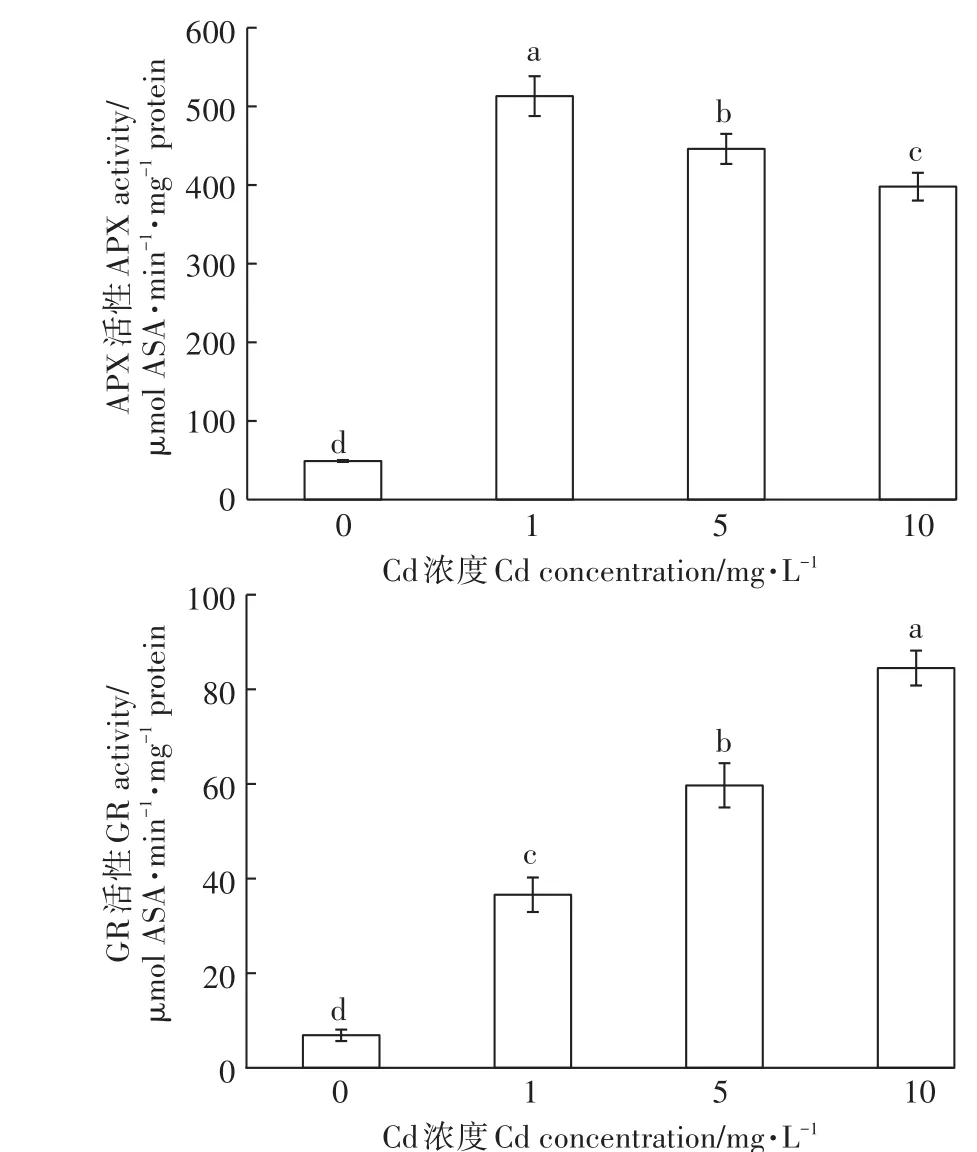
圖3 Cd脅迫對濕地匍燈蘚APX和GR活性的影響Figure 3 Effects of Cd stress on APX and GRactivities in Plagiomniumacutum
2.6 Cd脅迫下各指標間的相關性分析
為了研究濕地匍燈蘚體內活性氧產生、抗氧化體系與Cd亞細胞分布間的聯系,對所測定的指標進行了Pearson相關性分析,結果如表2所示。在55對相關性分析中,顯著性相關4對(P<0.05),均為正相關;極顯著性相關30對(P<0.01),其中正相關27對,負相關3對。表明所分析的各指標間相互聯系較為緊密。O-·的產生與所有指標的相關性都不顯著,但H2O2含2量卻與各亞細胞組分Cd含量及GR活性極顯著正相關(P<0.01),與 ASC和 ASA 含量顯著正相關(P<0.05)。APX活性與GR活性、ASC和ASA含量極顯著正相關(P<0.01),與DHA含量顯著正相關(P<0.05),與各亞細胞組分Cd含量極顯著負相關(P<0.01)。GR活性除了與APX活性和H2O2含量極顯著正相關外(P<0.01),還與ASC、ASA和DHA含量以及各亞細胞組分Cd含量均極顯著正相關(P<0.01)。
3 討論
葉綠體對環境變化反應很靈敏,宇克莉等[24]采用透射電鏡觀察Cd脅迫下的玉米細胞時發現,10-5mol·L-1Cd2+處理10 d后葉綠體數量顯著減少,且葉綠體膨脹呈圓球形,基粒類囊體排列紊亂;魏海英等[10]采用100 mg·L-1Cd處理大羽蘚7 d后觀察到葉綠體雙層膜破裂,類囊體片層膨脹減少,僅使線粒體外膜有破損和嵴突膨脹。本研究同樣發現隨Cd脅迫濃度增加,葉綠體受傷害程度也顯著增加,具體表現為葉綠體急劇的皺縮,與上述結果相一致。
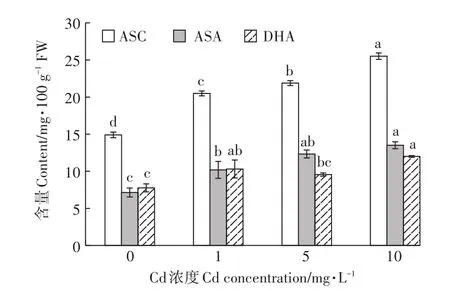
圖4 Cd脅迫對濕地匍燈蘚抗壞血酸含量的影響Figure 4 Effects of Cd stress on ascorbic acid pool in Plagiomniumacutum
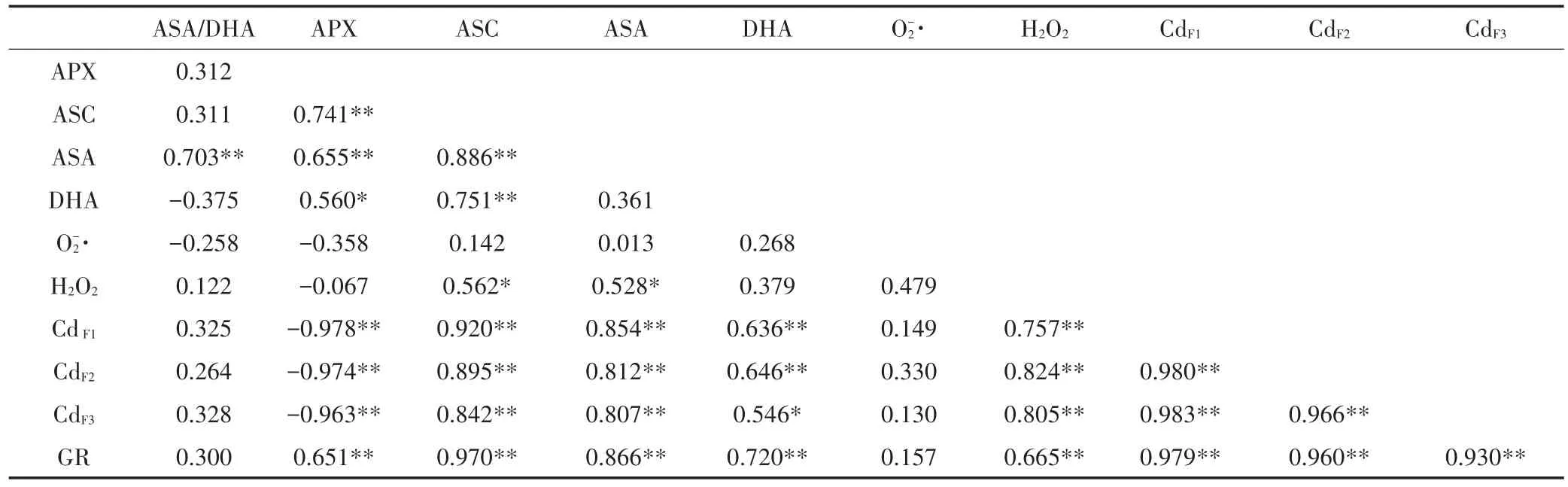
表2 Cd脅迫下各指標間的相關性分析Table 2 The correlation analysis between all indicators under Cd stress
細胞壁是重金屬離子跨膜進入細胞質的第一道屏障,是植物響應重金屬脅迫的功能信號分子和代謝的場所[5,25]。耐Cd植物的一個顯著特征就是細胞壁對Cd的過量累積,同時植物還可通過調整Cd在細胞各組分中的分布來適應Cd脅迫[26]。如與Cd敏感型植物相比,耐性植物的Cd多數被細胞壁所固定[27]。本研究發現,Cd在濕地匍燈蘚體內的分布趨勢為細胞壁>細胞器>細胞質(表2),Cd主要累積在蘚體的細胞壁上,但隨著環境Cd濃度增加,細胞器內Cd占比增加,從19.2%升高至27.3%,與楊衛東等[28]的結果相一致。有研究認為葉綠體是最易累積Cd的細胞器,如藻類植物的葉綠體內Cd含量高達總量的40%[29]。本研究中,葉綠體損傷隨各亞細胞組分中的Cd含量增加而增加,說明蘚類植物的葉綠體也很可能是累積Cd的主要場所之一,是Cd毒性的直接作用位點。
Cd是非氧化還原態金屬,低濃度下進入到細胞后可以被體內非酶物質如ASA或GSH螯合,葉綠體是細胞活性氧產生的主要部位之一[30],然而只有在葉綠體嚴重受損后,才會激活膜中的NADPH氧化酶,促進O-2·和H2O2的形成[31-32]。本研究發現,蘚體內的O-2·含量隨Cd濃度增加呈現先降后升趨勢,H2O2含量則隨Cd濃度增加而顯著增加(圖2),該結果與龐杰等[33]的結果相一致。相關性分析表明,O-2·的產生與所有指標的相關性都不顯著,但H2O2含量卻與各亞細胞組分Cd含量及GR活性極顯著正相關(P<0.01)。孫光聞等[34]認為這種現象的出現是過多的O-2·不能被及時清除而質子化成為毒性更強的OH自由基所致。本文推測可能是低濃度下Cd刺激細胞器內抗氧化酶系統的啟動,將體內原有的活性氧清除,導致其低于對照,本研究中顯著高于對照的APX和GR活性也可以在一定程度上支持這個假設,表明低濃度Cd脅迫下濕地匍燈蘚的活性氧代謝與種子植物相比有其特殊性,可能對低濃度Cd有較強的耐受能力。
Smeets等[35]認為抗壞血酸-谷胱甘肽循環是Cd脅迫下刺激H2O2轉化的主要途徑。APX和GR是該循環中重要的氧化還原酶類,APX主要存在于質體,尤其是葉綠體中[36],該酶催化了該循環的第一步反應,同時將H2O2轉化成H2O。本研究中,APX活性與兩種活性氧含量不相關,卻與ASC和ASA極顯著正相關(P<0.01),與DHA顯著正相關(P<0.05),說明葉綠體受損傷后Cd進入葉綠體內,使受損部分的APX變性失活。GR為該循環的限速酶,主要位于線粒體內[37],以NADPH為電子供體促使GSSG還原成GSH。本研究中GR活性與O-2·含量不相關,卻與H2O2含量以及各亞細胞組分Cd含量均極顯著正相關(P<0.01),也與ASC、ASA和DHA含量極顯著正相關(P<0.01),并與APX酶活性極顯著正相關(P<0.01),說明亞細胞組分中Cd含量和H2O2含量增加以及葉綠體受損是GR活性增加的主要原因,兩種酶具有協同效應。
ASA是體內清除活性氧的重要物質之一,H2O2可以誘導ASA含量增加[33],ASC、ASA和DHA均與3種亞細胞組分中的Cd含量極顯著正相關(P<0.01),其中ASC和ASA還與H2O2含量顯著正相關(P<0.05),這與龐杰等[33]結果相一致。該結果也從側面進一步證明了Cd脅迫產生的H2O2主要依賴抗壞血酸-谷胱甘肽循環體系(Halliwell-Asada途徑)完成,這與吳旭紅等[38]的研究結果相一致。暗示Halliwell-Asada途徑可能是濕地匍燈蘚體內主要的活性氧清除機制。
4 結論
(1)濕地匍燈蘚的細胞壁是累積重金屬Cd的主要場所,進入細胞內的Cd則主要累積在細胞器里,尤其可能累積在葉綠體,致使以葉綠體為主要反應場所的APX變性失活,引起體內活性氧代謝紊亂。
(2)低濃度Cd脅迫下濕地匍燈蘚的活性氧代謝不同于種子植物,Halliwell-Asada途徑可能是濕地匍燈蘚體內主要的活性氧清除機制,APX和GR在此過程中具有協同效應。
(3)濕地匍燈蘚對低濃度Cd有較強的耐受能力。

