發酵肉制品中細菌群落結構及其表皮葡萄球菌生物胺相關基因分析
劉 蕾,楊海鶯,沈雪梅,倪 偉,鄭曉衛,陳 博,陳歷水
(1.中糧營養健康研究院有限公司,北京 102209;2.老年營養食品研究北京市工程實驗室,北京 102209;3.營養健康與食品安全北京市重點實驗室,北京 102209)
生物胺是一類含氮的低分子質量堿性有機化合物的總稱,普遍存在于中國傳統發酵食品中,過量攝入會引起不良反應。在發酵食品中,具有氨基酸脫酸酶活性的微生物對生物胺的形成至關重要[1-2]。常見的產生物胺的微生物有腸桿菌屬(Enterobacter)、腸球菌屬(Enterococcus)、乳酸桿菌屬(Lactobacillus)、明串珠菌屬(Leuconostoc)、鏈球菌屬(Streptococcus)、酒球菌屬(Oenococcus)、梭菌屬(Clostridium)和假單胞菌屬(Pseudomonas)等,其中乳酸菌是產生物胺的主要菌種[3-4]。而發酵肉制品中生物胺的產生主要與微球菌屬(Micrococcus)和葡萄球菌屬(Staphylococcus)有關,其中肉葡萄球菌(Staphylococcus carnosus)和魚發酵葡萄球菌(Staphylococcus piscifermentans)具有高氨基酸脫羧酶活性,能夠產生尸胺、2-苯乙胺、腐胺和組胺[5-7]。MARTUSCELLI M等[6]從香腸中分離得到51株木糖葡萄球菌(Staphylococcus xylosus),發現其中的21株有體外氨基酸脫羧酶活性,只有7株菌株的酪胺、亞精胺和精胺產量>10 mg/kg,未檢測到組胺的產生[6]。
目前,發酵食品中生物胺含量主要通過高效液相色譜(highperformanceliquidchromatography,HPLC)法進行檢測,檢測方法的前處理較為繁瑣,耗時長。近年來有學者利用分子生物學的方法檢測微生物中產生物胺的相關酶的基因判斷其是否產生某種特定的生物胺。此方法具有快速、可靠、不依賴于培養等優點,并可在生物胺形成之前,檢測出產生物胺的基因,因此可分析出潛在的產生物胺危害[8-11]。不同種類的發酵肉制品中生物胺種類和含量有一定差別[12-13]。其中,酪胺、尸胺和組胺報道較多。酪胺是由酪氨酸脫羧酶(tyrosine decarboxylase,TDC)催化酪氨酸脫羧形成的;尸胺是由賴氨酸在賴氨酸脫羧酶(lysine decarboxylase,IDC)的催化下脫羧形成的;組胺是毒性最大的生物胺,由組氨酸脫羧酶(histidine decarboxylase,HDC)催化組氨酸脫羧形成的。
本研究以云南臘腸為研究對象,首先,采用高通量測序技術研究發酵肉制品中細菌群落結構的多樣性。然后利用傳統培養分離法及雙層顯色培養基對發酵肉制品中產生物胺的細菌進行分離篩選,并基于16S rRNA序列進行鑒定。最后,利用聚合酶鏈式反應(polymerase chain reaction,PCR)擴增與測序的方法對細菌中產組胺、酪胺和尸胺的相關基因進行特異性篩選,以期建立發酵肉制品中生物胺的快速篩選機制,為基因檢測技術在發酵食品安全性檢測中的應用奠定基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
云南臘腸:云南市場購買。
1.1.2 培養基
MRS液體培養基:蛋白胨10.0 g,牛肉膏10.0 g,葡萄糖20.0 g,酵母浸粉5.0 g,檸檬酸氫二銨2.0 g,無水乙酸鈉5.0 g,磷酸氫二鉀2.0 g,吐溫80 1.0 mL,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.2 g,蒸餾水1 000 mL,調節pH值至6.80。121 ℃高壓滅菌15 min。
MRS固體培養基:在MRS液體培養基的基礎上添加20.0 g瓊脂。121 ℃高壓滅菌15 min。
雙層顯色下層培養基[14]:蛋白胨5.0 g,酵母浸粉5.0 g,牛肉膏5.0 g,NaCl 2.5 g,葡萄糖0.5 g,吐溫80 1.0 mL,MgSO40.4 g,MnSO40.03 g,K2HPO42.0 g,檸檬酸三銨2.0 g,CaCO30.1 g,FeSO40.04 g,維生素B1(vitamin B1,VB1)0.01 g,磷酸吡哆醛0.05 g,瓊脂20.0 g,色氨酸、精氨酸、賴氨酸、酪氨酸、苯丙氨酸、組氨酸各5.0 g,蒸餾水1 000 mL,pH值5.2。雙層顯色上層培養基:溴甲酚紫0.06 g,瓊脂20.0 g,蒸餾水1 000 mL,pH值5.2。121 ℃高壓滅菌15 min,以不加氨基酸的雙層顯色培養基為對照。
1.1.3 引物
PCR引物見表1[10,15-17],由北京美吉桑格生物醫藥科技有限公司合成。
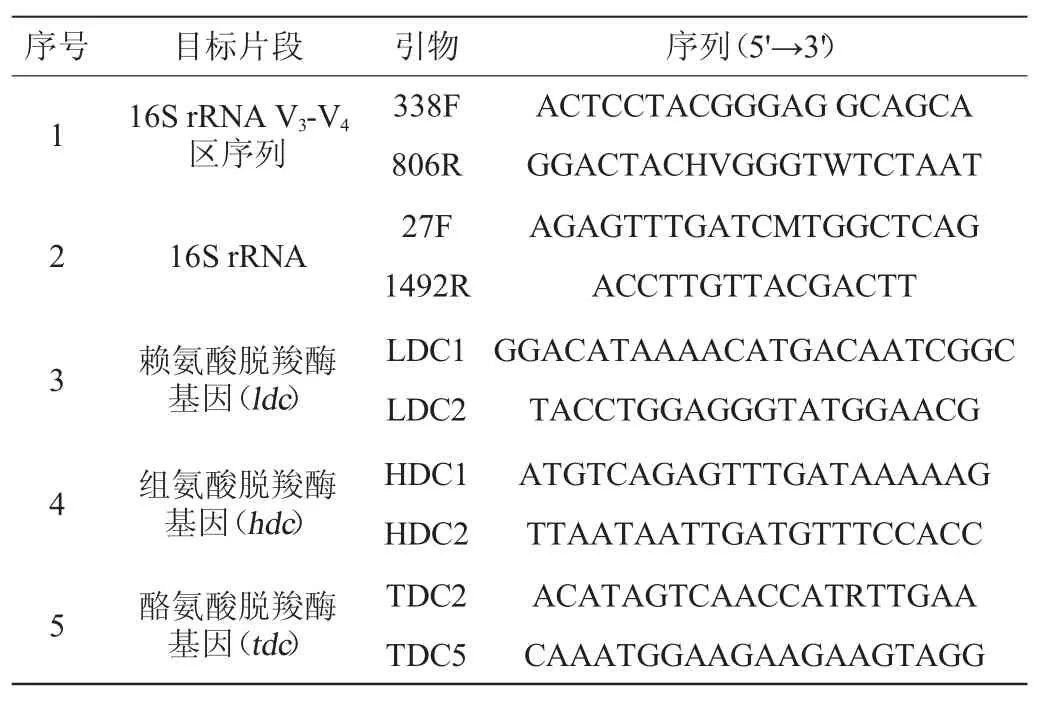
表1 本研究所用引物序列Table 1 Primer sequences used in the study
1.1.4 化學試劑
脫氧核糖核酸(deoxyribonucleic acid,DNA)提取試劑盒、KOD高保真酶、引物、DNA Marker:上海生工生物工程有限公司;Axy Prep DNA凝膠回收試劑盒:德國AXYGEN公司;Quant-iTPicoGreen熒光定量試劑盒:美國Life Technologies公司;TruSeq DNA建庫試劑盒、MiSeq上機試劑盒:美國Illumina公司。FastPfu Polymerase(5.0 U)、EXTaq酶(5.0 U)、脫氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、5×FastPfu buffer、10×EXTaqBuffer:日本TaKaRa公司。
1.2 儀器與設備
ZDX35BI滅菌鍋:上海申安醫療器械廠;DNP-9082電熱恒溫培養箱:上海精宏實驗設備有限公司;H1650-W醫用離心機:湖南湘儀離心機儀器有限公司;SW-CJ-2D超凈工作臺:蘇州凈化設備有限公司;MG96+型PCR儀:杭州郎基科學儀器有限公司;JY04S-3C凝膠成像儀、JY300C電泳系統:北京君意電泳設備有限公司;HH-2恒溫水浴鍋:上海比郎儀器有限公司;625-00203730XL測序儀:美國ABI公司;810R臺式高速冷凍離心機:德國Eppendorf公司;SpectraMax M5酶標儀:美國MolecularDevice公司;Miseq基因組測序儀:美國Illumina 公司;QuantiFluorTM-ST藍色熒光定量系統:美國Promega公司。
1.3 實驗方法
1.3.1 發酵肉制品中細菌群落結構分析
(1)PCR擴增細菌16S rRNA V3-V4區序列
采用DNA提取試劑盒提取臘腸的總DNA,以其為模板,采用上游引物338F和下游引物806RPCR擴增細菌16SrRNA的V3-V4區序列。PCR擴增體系:5×FastPfu buffer 4.0 μL,2.5 mmol/L dNTPs Mix 2.0 μL,上下游引物(5 μmol/L)各0.8 μL,FastPfu Polymerase 0.4 μL,BSA 0.2 μL,模板DNA 10.0 ng,加雙蒸水(ddH2O)補至終體積為20 μL。PCR擴增條件:95 ℃預變性3 min;95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸45 s,共27個循環;72 ℃再延伸10 min。使用Axy Prep DNA凝膠回收試劑盒切膠回收PCR擴增產物,采用2%瓊脂糖凝膠進行電泳檢測。
(2)文庫構建和高通量測序
根據電泳結果,對PCR擴增產物進行定量分析,采用TruSeq DNA建庫試劑盒構建文庫。采用Miseq平臺雙端PE 300測序策略,使用上機試劑盒將文庫加入Miseq測序儀進行測序。
(3)生物信息學分析和數據分析
對原始數據進行過濾拼接處理后,得到優化序列。在97%的相似水平下,利用vsesion 7.1 Usearch(http://drive5.com/uparse/)軟件平臺,劃分可操作分類單元(operational taxonomicunit,OTU),并挑取OTU的代表序列。采用RDPclassifier貝葉斯算法,設置置信度閾值為0.7,基于Silva數據庫(http://www.arb-silva.de)對OTU代表序列進行分類學分析,并在屬水平上統計樣品的細菌群落組成。
1.3.2 發酵肉制品中產生物胺細菌的篩選與鑒定
(1)細菌的分離純化
取臘腸1.0 g于9.0 mL無菌生理鹽水中,充分振蕩,用無菌生理鹽水梯度稀釋(10-1、10-2、10-3、10-4、10-5、10-6、10-7),并涂布于MRS固體培養基上,37 ℃條件下培養48 h。根據菌落形態、大小、顏色等挑取單菌落,-20 ℃保藏。
(2)產生物胺細菌的篩選
將分離純化的菌株接種到雙層顯色下層培養基上,37℃條件下培養48 h,無菌條件下,在下層培養基上倒一層上層培養基(50 ℃),顯色,并在5 min內記錄實驗結果。以不接種菌株的培養基作為空白對照,顯紫色的為陽性(產生物胺菌),不變色即黃色為陰性(不產生物胺菌)[18-19]。
(3)產生物胺細菌的鑒定
將產生物胺菌株接種到MRS液體培養基中,37 ℃條件下培養12 h,取1 mL菌液,10 000 r/min離心1 min,棄上清,取菌體沉淀,參照DNA提取試劑盒的步驟提取基因組DNA,1%瓊脂糖凝膠電泳檢測,于-20 ℃條件下保存。以提取的DNA為模板,采用引物27F及1492R進行PCR擴增。PCR擴增體系:10×ExTaqbuffer 5.0 μL,2.5 mmol/L dNTPs Mix 4.0 μL,上下游引物各2.0 μL,ExTaq酶0.5 μL,模板DNA 2.0 μL,ddH2O補至終體積為50μL。PCR擴增條件:94℃預變性3min;94℃變性30s,54℃退火30s,72℃延伸1.5min,共24個循環;72 ℃再延伸10 min。PCR擴增產物經1%瓊脂糖凝膠電泳檢測合格后,送去北京美吉桑格生物醫藥科技有限公司測序,測序結果與美國國立生物技術信息中心(national center for biotechnology information,NCBI)的Genbank數據庫進行BLAST比對搜索。
1.3.3 產生物胺細菌功能基因的擴增及測序
選擇產生物胺能力較強的菌株(選擇雙層顯色培養基中紫色較深的菌株),進行功能基因檢測。PCR擴增:以提取的細菌基因組DNA為模板,采用表1中的引物PCR擴增ldc、hdc和tdc基因片段。PCR擴增體系:10×ExTaqBuffer 5.0 μL,2.5 mmol/L dNTPs Mix 4.0 μL,上下游引物各2.0 μL,ExTaq酶0.5 μL,模板DNA 2.0 μL,ddH2O補至終體積為50 μL。PCR擴增條件:95 ℃預變性5 min;95 ℃變性45 s,hdc基因48 ℃退火45 s、ldc基因50 ℃退火45 s、tdc基因50 ℃退火30 s,72 ℃延伸2 min,共35個循環;72 ℃再延伸5 min。PCR擴增產物經1%瓊脂糖凝膠電泳檢測。
系統進化分析:將PCR擴增產物送去北京美吉桑格生物醫藥科技有限公司測序,測序結果與NCBI的Genbank數據庫進行BLAST比對搜索,選取與序列具有同源性該菌屬內有代表性的多種模式菌株基因序列,利用MEGA7.0軟件中的鄰接(neighbor joining,NJ)法構建系統進化樹,其中Bootsdrap 1 000次檢驗進化樹置信度。
2 結果與分析
2.1 發酵肉制品中微生物群落結構分析
通過高通量測序技術分別對發酵肉制品樣本中細菌的16S rRNA V3-V4區序列進行測序,測序結果經過濾拼接處理后得到細菌序列72 835條,樣品質控Q20>96%,Q30>89%(Q20和Q30是堿基質量值,其中Q20為堿基識別出錯率為1/100,堿基識別精度為0.99;Q30為堿基識別出錯率為1/1 000,堿基識別精度為0.999),發酵肉制品樣品稀釋曲線見圖1。
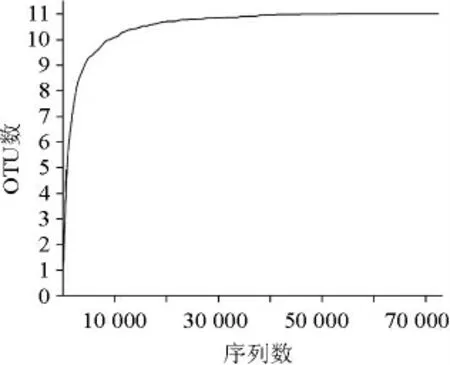
圖1 發酵肉制品中細菌多樣性測序稀釋曲線Fig.1 Rarefaction curve for the bacteria diversity sequencing of fermented meat sample
由圖1可知,隨著測序數量的增加,OUT數先急劇增加后趨于平緩,說明測序質量和測序深度均滿足實驗需求,可用于后續結果分析。在97%的相似水平下對OTU進行分類學分析,結果見圖2。
由圖2可知,發酵肉制品樣本中細菌98.59%為厚壁菌門(Firmicutes)的葡萄球菌屬(Staphylococcus)。傳統發酵肉制品的加工過程均有微生物參與,但由于不同發酵肉制品的不同原料、地區來源、加工工藝、貯藏條件等使最終產品中微生物組成有較大差別。我國傳統發酵肉制品中較常見的微生物有腸細菌(Enterobacteria)、乳酸菌、葡萄球菌(Staphylococcus)和嗜冷桿菌(Psychrobacter)的某些種,國外的發酵香腸中分離出的微生物主要有腸細菌、乳酸菌、葡萄球菌、肉桿菌(Carnobacterium)以及酵母菌的某些種[20-21]。
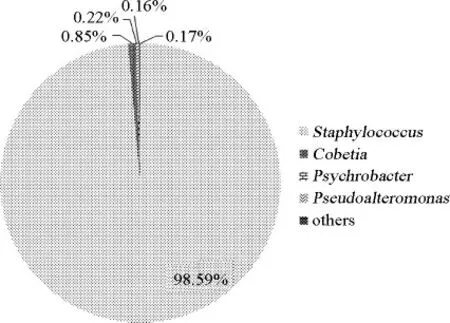
圖2 基于屬水平發酵肉制品中細菌群落結構Fig.2 Bacterial community structure in fermented meat based on genus level
2.2 發酵肉制品中產生物胺細菌的篩選與鑒定
通過傳統培養分離方法從發酵肉制品中共分離得到52株細菌,通過雙層顯色培養基從中篩選到43株產生物胺的陽性菌株。通過PCR擴增獲得43株菌株的16S rRNA序列,在NCBI的Genbank數據庫中進行比對,結果見表2。

表2 發酵肉制品中產生物胺細菌16S rRNA序列比對結果Table 2 Alignment results of 16S rRNA sequences of biogenic amines-producing bacteria in fermented meat

續表
由表2可知,發酵肉制品中產生物胺的細菌主要為表皮葡萄球菌(Staphylococcus epidermidis)。有報道稱,葡萄球菌在發酵肉制品中主要產生蛋白酶和脂肪酶,對發酵肉制品的風味形成和色澤穩定起重要作用[22]。另外,有報道稱,表皮葡萄球菌可產生生物胺氧化酶,對已產生的生物胺進行降解,從而降低生物胺的積累[20]。在本研究中,表皮葡萄球菌可能對發酵肉制品的品質有促進作用,同時也是產生物胺的主要微生物。
2.3 發酵肉制品中產生物胺細菌功能基因檢測
2.3.1 賴氨酸脫羧酶編碼基因ldc的確定與分析
在產生物胺微生物的分離過程中,利用的是雙層顯色培養基法。在顯色過程中,不同產生物胺的微生物顯示紫色的能力有顯著差別,選擇產紫色較深的微生物即生物胺產生能力較強的微生物(菌株5、8、10、12、21、31和45),進行功能基因檢測。采用革蘭氏陽性菌的賴氨酸脫羧酶引物LDC1和LDC2 PCR擴增以上7株菌株的ldc基因,結果見圖3。
由圖3可知,7株細菌PCR擴增后均出現陽性條帶。PCR擴增產物經測序及序列比對顯示,7株細菌的ldc基因序列與表皮葡萄球菌賴氨酸脫羧酶基因序列的一致性>97%。選取同源性較高的該菌屬內有代表性的多種模式菌株的ldc基因序列構建系統進化樹,結果見圖4。
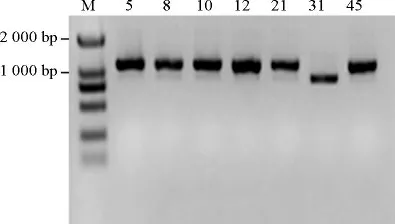
圖3 發酵肉制品中產生物胺細菌賴氨酸脫羧酶基因的PCR擴增產物Fig.3 PCR products of lysine decarboxylase gene of biogenic amines-producing bacteria in fermented meat
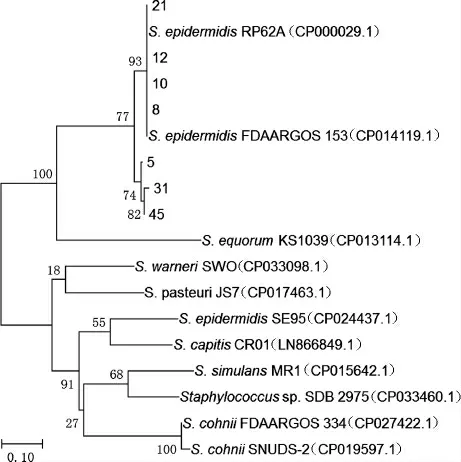
圖4 基于賴氨酸脫羧酶基因產生物胺細菌的系統進化樹Fig.4 Phylogenetic tree of biogenic amines-producing bacteria based on lysine decarboxylase gene
由圖4可知,同一菌種來源的賴氨酸脫羧酶相似性較高,因此,本研究中采用的引物及PCR擴增條件可用于表皮葡萄球菌中賴氨酸脫羧酶基因的檢測。
2.3.2 組氨酸脫羧酶編碼基因hdc的確定與分析
采用革蘭氏陽性菌的組氨酸脫羧酶引物HDC1和HDC2 PCR擴增菌株5、8、10、12、21、31和45的hdc基因,結果見圖5。
由圖5可知,7株細菌PCR擴增后均出現陽性條帶,PCR擴增產物經測序及序列比對顯示,7株細菌的hdc基因序列與表皮葡萄球菌的組氨酸脫羧酶基因序列的一致性>98%。選取同源性較高的該菌屬內有代表性的多種模式菌株的hdc基因序列構建系統進化樹,結果見圖6。
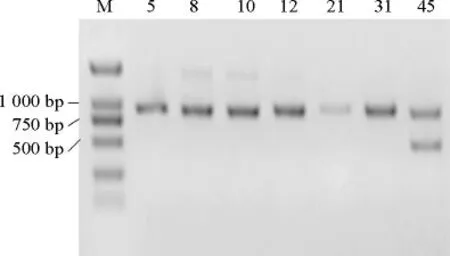
圖5 發酵肉制品中產生物胺細菌組氨酸脫羧酶基因的PCR擴增產物Fig.5 PCR products of histidine decarboxylase gene of biogenic amines-producing bacteria in fermented meat
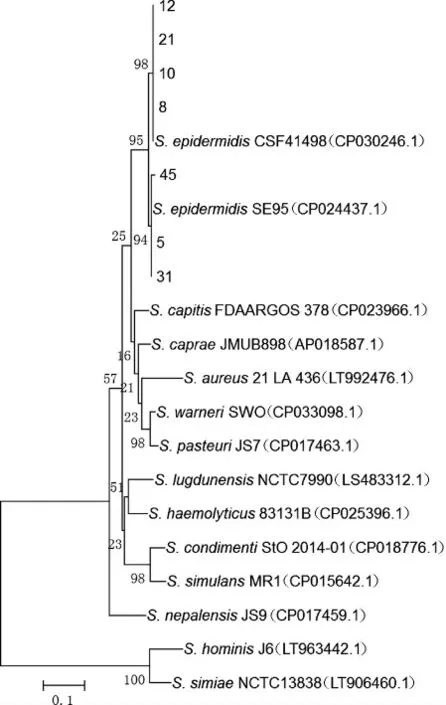
圖6 基于組氨酸脫羧酶基因產生物胺細菌的系統進化樹Fig.6 Phylogenetic tree of biogenic amines-producing bacteria based on histidine decarboxylase gene
由圖6可知,不同菌種來源的組氨酸脫羧酶的相似性較高。因此,本研究中采用的引物及PCR擴增條件不僅可用于表皮葡萄球菌中組氨酸脫羧酶基因的檢測,還可擴展到其他菌種來源的組氨酸脫羧酶基因檢測。
2.3.3 酪氨酸脫羧酶編碼基因tdc的確定與分析
利用酪氨酸脫羧酶引物TDC1和TDC2 PCR擴增菌株5、8、10、12、21、31和45的酪氨酸脫羧酶基因,結果見圖7。

圖7 發酵肉制品中產生物胺細菌酪氨酸脫羧酶基因的PCR擴增產物Fig.7 PCR products of tyrosine decarboxylase gene of biogenic amines-producing bacteria in fermented meat
由圖7可知,只有菌株12和21 PCR擴增后出現了陽性條帶。陽性條帶經測序及序列比對顯示,上述菌株基因序列與表皮葡萄球菌酪氨酸脫羧酶基因序列的一致性>98%。由于本研究中采用的引物擴增效果較差,因此,后期需進行PCR擴增引物的篩選以及擴增條件的改變,以找到適合表皮葡萄球菌酪氨酸脫羧酶基因檢測的引物及條件。
3 結論
通過高通量測序技術對發酵肉制品中細菌的16S rRNA V3-V4區序列進行測序。結果表明,發酵肉制品中細菌主要為厚壁菌門(Firmicutes)的葡萄球菌屬(Staphylococcus)。通過傳統培養分離法從發酵肉制品中共分離得到52株細菌,利用雙層顯色培養基從中篩選出43株產生物胺細菌,且主要為表皮葡萄球菌(Staphylococcus epidermidis),與細菌多樣性結果一致。對7株高產生物胺的表皮葡萄球菌的賴氨酸脫羧酶、組氨酸脫羧酶和酪氨酸脫羧酶編碼基因進行PCR擴增,結果表明,7株表皮葡萄球菌均含有基因hdc和ldc,為兩種生物胺的快速檢測提供理論基礎。

