溫膽湯干預同型半胱氨酸致內皮細胞損傷的機制研究
高血壓是心腦血管疾病發生的重要病變基礎,主要包括原發性高血壓與繼發性高血壓。中國原發性高血壓病人約1.6億人[1],在高血壓人群中心腦血管疾病發病率高達95%以上,是導致死亡的主要單一因素。據WHO調查結果表明,全球每年因原發性高血壓及其并發癥而致死的病人約1 700萬人[2],嚴重威脅人類生命健康。H型高血壓屬原發性高血壓伴有高同型半胱氨酸(Hcy)血癥,是導致腦卒中的關鍵因素[3],在我國成年高血壓病人中其發病率約占75%[4]。大量研究表明,高血壓與高Hcy血癥對人體靶器官具有協同危害能力[5],其中高Hcy可嚴重破壞血管內皮細胞,加劇血管異構,誘發心血管功能紊亂,最終導致心血管事件發生[6-8]。在西醫治療方面主要采用抑制Hcy生成或促進其代謝,但該方式對部分病人作用欠佳,相關的心血管事件亦未得到有效控制[9]。而中醫學采用“整體觀念、辨證論治”原則,可有效對機體進行全面調理。溫膽湯最早載于唐·孫思邈《千金方》,具有理氣化痰、清膽和胃等功效[10],是H 型高血壓臨床治療中常用的處方湯藥[11]。因此,本實驗擬建立體外Hcy致人臍靜脈內皮細胞(HVVEC)損傷模型,并給予溫膽湯含藥血清進行干預,探討溫膽湯改善內皮功能的作用及機制,為溫膽湯治療H型高血壓提供實驗依據。
1 材料與方法
1.1 實驗材料
1.1.1 動物與細胞株 SPF級雄性健康SD大鼠(200±20)g,由上海斯萊克實驗動物有限公司(SCXK滬:2016-0002)提供;HUVEC細胞(ECV-304),由中國科學院上海細胞庫提供。
1.1.2 藥品與試劑 溫膽湯組方:半夏6 g,茯苓4.5 g,竹茹6 g,枳實6 g,陳皮9 g,炙甘草3 g。按相應流程進行煎煮[12],合并水煎液進行蒸發濃縮,最終調至生藥濃度為低劑量(1g/mL)和高劑量(2g/mL),于4 ℃保存。維生素E(批號101228),購自浙江醫藥股份有限新昌制藥廠;Hcy(批號C-7352)。購自美國Sigma公司;胎牛血清,購自美國Gemini公司;胰蛋白酶、MTT、二甲亞砜,購自美國Sigma Aldrich公司; BCA蛋白定量試劑盒,購自南京碧云天生物技術研究所;ECL化學發光液,購自美國GE公司;p-P38MAPK、P38MAPK、p-ERK1/2、ERK1/2、p-NF-κB、核轉錄因子-κB(NF-κB)、內皮型一氧化氮合酶(eNOS)及p-eNOS抗體,購自美國CST公司;β-Tubulin、二抗,購自南京巴傲得生物科技有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)、活性氧(ROS)、一氧化氮(NO)檢測試劑盒,購自南京建成生物工程研究所;超敏C反應蛋白(hs-CRP);腫瘤壞死因子-α(TNF-α)、白細胞介素-6(IL-6) ELISA檢測試劑盒,購自上海西塘生物科技有限公司;其他試劑均由北京索萊寶科技有限公司提供。
1.1.3 主要儀器 SW-CJ-2FD超凈工作臺,蘇州凈化設備廠;CH20-BIM倒置顯微鏡,日本 Olympus公司;Synergy HT酶標儀,美國BioTeK公司;蛋白電泳、半干轉膜系統,美國Bio-rad公司;Direct-Q超純水儀,美國MILLIPORE公司;5417R高速冷凍離心機,德國Eppendorf公司;IKA T18 basic勻漿器,德國ULTRATURRAX公司;二氧化碳(CO2)細胞恒溫培養箱,日本SANYO公司;全自動圖像分析系統,美國GE公司。
1.2 含藥血清制備 取40只SPF級雄性健康大鼠,自由攝食、飲水,24 h晝夜循環,適應性喂養2~3 d。按體質量隨機分為空白對照組、模型組、溫膽湯低劑量組(20 g/kg)、溫膽湯高劑量組(40 g/kg)及維生素E組(250 mg/kg),每組8只,各給藥組灌胃相應藥物,空白對照組、模型組給予等量蒸餾水,連續7 d,腹主動脈采血,經離心、滅活、過濾得含藥血清,并于-80 ℃保存。
1.3 細胞培養 將HUVEC從液氮取出,經復蘇后用DMEM培養基(10%FBS+1%P/S)進行重懸,隨后置于37 ℃、5% CO2的恒溫恒濕孵育箱中培養。隔天換液1次,待細胞融合至80%~90%時進行傳代操作。
1.4 檢測指標與方法
1.4.1 細胞增殖率檢測 取對數生長期HUVEC細胞,加入DMEM重懸稀釋至5×104個/mL接種于96孔培養板,每孔100 μL,培養24 h待細胞貼壁后更換無血清培養基80 μL繼續培養24 h,給藥組每孔加入溫膽湯含藥血清(20 g/kg、40 g/kg)、維生素E含藥血清(250 mg/kg)各10 μL進行預處理1 h,除空白對照組外各組每孔加10 μL的Hcy(200 μmol/L)進行刺激損傷。在各平行操作條件下,未處理組給予等量的空白血清。23 h后每孔加MTT溶液20 μL,4 h后更換DMSO溶液150 μL,震蕩10 min后置于酶標儀(波長490 nm處)進行吸光度檢測。
1.4.2 細胞因子分泌水平檢測 取對數生長期HUVEC細胞,加入DMEM重懸稀釋至1×105個/mL接種于6孔培養板,每孔2 mL,培養24 h待細胞貼壁后更換無血清培養基1.6 mL繼續培養24 h,給藥組每孔加入溫膽湯含藥血清(20 g/kg、40 g/kg)、維生素E含藥血清(250 mg/kg)各200 μL進行預處理1 h,除空白對照組外各組每孔加200 μL的Hcy(200 μmol/L)進行刺激損傷。在各平行操作條件下,未處理組給予等量的空白血清。23 h后收集細胞上清液,分別采用比色法檢測SOD、MDA、ROS、NO含量,ELISA法檢測hs-CRP、TNF-α、IL-6水平。
1.4.3 P38MAPK/NF-κB信號通路相關蛋白表達水平檢測 取對數生長期HUVEC細胞接種于6孔板內,分組與給藥方式同上。處理后收集細胞裂解液,進行BCA蛋白定量,SDS-PAGE凝膠電泳、轉膜。浸于5% BSA封閉,分別用p-P38MAPK、P38MAPK、p-ERK1/2、ERK1/2、p-NF-κB、NF-κB、eNOS以及p-eNOS一抗過夜孵育(1∶2 000,4 ℃)。次日漂洗后加入二抗孵育30 min(1∶5 000,常溫),再漂洗后ECL化學發光、顯影。ImageQuant軟件掃描并分析相應灰度值,檢測需重復3次。

2 結 果
2.1 溫膽湯對HUVEC增殖率的影響 經檢測,與空白對照組比較,模型組中HUVEC增殖率顯著下降(P<0.01)。在溫膽湯的干預作用下,HUVEC增殖活力增加,溫膽湯高劑量組、維生素E組與模型組比較差異有統計學意義(P<0.05或P<0.01)。提示溫膽湯可有效改善Hcy引起的細胞增殖抑制作用。詳見圖1。
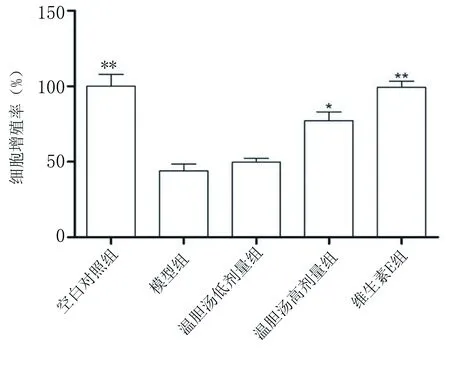
注:與模型組比較,*P<0.05,**P<0.01。
2.2 溫膽湯對HUVEC中MDA、SOD、ROS及NO分泌的影響 溫膽湯可減少HUVEC中MDA和ROS分泌,增加SOD、NO含量。與空白對照組比較,模型組HUVEC中MDA和ROS表達水平增高(P<0.01);給予不同濃度溫膽湯治療后,MDA及ROS水平下降。與模型組比較,溫膽湯(20 g/kg、40 g/kg)與維生素E可明顯減少MDA、ROS表達(P<0.05或P<0.01)。與空白對照組比較,模型組HUVEC中SOD和NO表達水平下降(P<0.01);給予不同濃度溫膽湯治療后,SOD及NO水平提升;與模型組比較,溫膽湯(20 g/kg、40 g/kg )與維生素E可明顯增加SOD、NO表達(P< 0.01)。提示溫膽湯具有緩解氧化應激,增強內皮功能的作用。詳見表1。

表1 溫膽湯對HUVEC中MDA、SOD、ROS及NO分泌的影響(±s)
模型組與空白對照組比較,①P< 0.01;與模型組比較,②P< 0.05,③P< 0.01。
2.3 溫膽湯對HUVEC中IL-6、hs-CRP及TNF-α分泌的影響 與空白對照組比較,HUVEC在Hcy刺激下其炎癥因子表達量顯著增加(P<0.01),給予不同濃度溫膽湯干預后,IL-6、hs-CRP及TNF-α水平均下降。在IL-6方面,與模型組比較,溫膽湯(20g/kg、40g/kg )與維生素E均可明顯降低IL-6表達(P<0.05或P< 0.01);在hs-CRP方面,與模型組比較,溫膽湯(20 g/kg、40 g/kg )與維生素E可明顯降低hs-CRP表達(P<0.05或P< 0.01);在TNF-α方面,與模型組比較,溫膽湯(20 g/kg、40 g/kg )與維生素E可明顯降低TNF-α表達(P<0.05);在降低IL-6、hs-CRP及TNF-α分泌中以溫膽湯(40 g/kg)與維生素E作用更強。由此提示,溫膽湯可改善Hcy刺激引起的炎癥反應。詳見表2。

表2 溫膽湯對HUVEC中IL-6、hs-CRP及TNF-α分泌的影響(±s)
模型組與空白對照組比較,①P< 0.01;與模型組比較,②P< 0.05,③P< 0.01。
2.4 溫膽湯對HUVEC中P38MAPK、ERK1/2、NF-κB和eNOS活化的影響 溫膽湯可抑制HUVEC中P38MAPK/NF-κB信號通路相關蛋白的活化,與空白對照組比較,模型組HUVEC中P38MAPK、ERK1/2、NF-κB活化量顯著增加(P<0.01),各濃度溫膽湯與維生素E可減少其活化量。溫膽湯(20 g/kg、40 g/kg )與維生素E均可有效降低p-p38MAPK、p-ERK1/2、p-NF-κB表達量,與模型組比較差異有統計學意義(P<0.05或P<0.01);與空白對照組比較,模型組HUVEC中p-eNOS活化量顯著降低(P<0.01),各濃度溫膽湯與維生素E可增加其活化量。溫膽湯(20 g/kg、40 g/kg )與維生素E均可有效促進eNOS活化,與模型組比較差異有統計學意義(P<0.05或P<0.01)。詳見圖2。
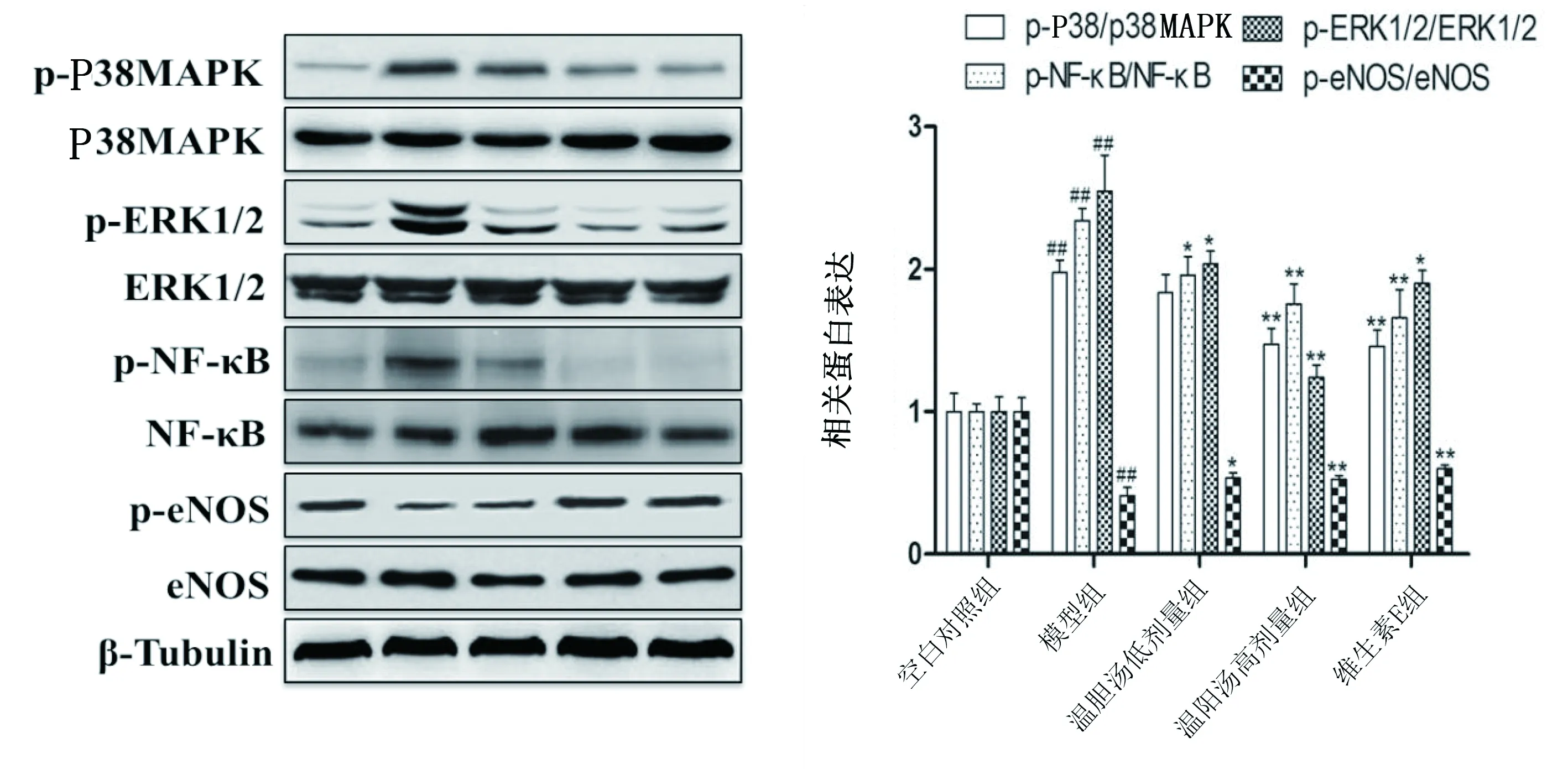
注:與空白對照組比較,##P<0.01;與模型組比較,*P<0.05,**P<0.01。圖2 溫膽湯對HUVEC中P38MAPK、ERK1/2、NF-κB和eNOS活化的影響
3 討 論
血管內皮細胞具有調節血管生長,維持凝血纖溶平衡以及參與免疫炎癥等功能,是維持正常心血管功能的重要物質基礎。研究發現,同型半胱氨酸屬蛋氨酸代謝中產物,可作為動脈粥樣硬化的獨立危險因素[13],而內皮細胞是其重要損傷器官[14-15],因此,Hcy損傷內皮細胞誘發的內皮功能障礙可推進動脈粥樣硬化及其相關心血管事件的發生、發展[16]。氧化應激反應在內皮功能損傷、障礙進程中發揮著關鍵作用。已有研究表明,Hcy在代謝進程中可通過巰基的自身氧化累積大量的氧化自由基,導致內皮細胞中的氧化應激反應[17]。SOD作為機體清除自由基、防止細胞受損的主要酶,其活力的高低體現了抗氧化的能力[18];MDA作為細胞壁破裂及其膜脂降解的終產物,體現了細胞經氧化反應后的受損程度[19];ROS作為重要的氧化還原產物,可直接損傷內皮細胞或介導信號傳導進而加重損傷[20]。因此,同時檢測SOD、MDA及ROS可有效反映體內氧化應激水平。本實驗結果發現,溫膽湯可有效抑制Hcy誘發的MDA、ROS分泌,促進SOD合成,緩解內皮細胞中氧化應激反應,具有一定的內皮保護作用。
有研究表明,炎癥信號傳導受多種復雜網絡通路調控。絲裂原活化蛋白激酶(MAPK)是細胞內信號傳導中的重要途徑,在機體的正常生理與病理中起到關鍵調控作用[21],P38絲裂原活化蛋白激酶在細胞生長、增殖、分化及凋亡中占據重要地位,是各類信號傳導的交集之處,而該信號途徑的激活又受氧化應激的影響[22]。P38MAPK激活后可誘導ERK1/2的活化繼而促進NF-κB轉錄,間接調節炎癥因子表達,參與炎癥反應與血管重構[23]。多項研究表示,P38MAPK信號通路激活后可誘導內皮細胞分泌炎癥因子IL-6、TNF-α和hs-CRP[24-25],而上述炎癥因子又可協同加重內皮細胞損傷,加劇血管粥樣硬化、增加血流阻力,繼而共同影響高血壓的形成、發展、預后轉歸[26]。本研究發現,溫膽湯可有效減少IL-6、TNF-α、hs-CRP分泌,抑制P38MAPK、ERK1/2及NF-κB活化。由此表明,溫膽湯可通過調控P38MAPK/NF-κB信號通路,緩解由氧化應激而導致的內皮細胞炎癥反應。另有研究表明,NO作為內皮細胞分泌的具有松弛血管平滑肌、調節張力、抗動脈粥樣硬化等作用的關鍵因子,受其關鍵酶eNOS調節分泌,而eNOS合成亦受P38MAPK信號介導[27],可通過抑制P38MAPK信號通路促進eNOS磷酸化,繼而發揮血管內皮保護,改善動脈粥樣硬化及抗高血壓等作用[27]。本實驗結果表明,溫膽湯干預后,HUVEC中eNOS及NO水平得到明顯提升,提示溫膽湯可通過抑制P38MAPK/NF-κB信號傳導,恢復損傷后的內皮細胞功能。
綜上所述,溫膽湯可通過下調內皮細胞中Hcy誘導的氧化應激水平,減輕由其加劇的P38MAPK/NF-κB信號傳導,繼而緩解內皮細胞炎癥損傷、恢復內皮功能,最終達到抗動脈粥樣硬化、抗血栓、降血壓等作用,在臨床H型高血壓治療中發揮重要的應用價值。

