低并發癥醫用涂層構建策略研究進展
石恒沖, 車超越, 欒世方, 殷敬華, 2
(1. 中國科學院長春應用化學研究所,高分子物理與化學國家重點實驗室,長春 130022;2. 威高集團有限公司,山東省醫用植入器械技術重點實驗室,山東 威海264210)
材料表面直接與外部相接觸,其表面性質對后續應用至關重要,因此通過有效的方法來控制和調節表面物理化學性質,可使材料具有摩擦性、黏附性、浸潤性、導電性、抗菌性和生物相容性等。醫用材料的功能性主要通過醫用材料表面與生物環境接觸而表現出來,因此需要對醫用材料表面進行功能化改性,否則會產生細菌引發感染或凝血引發血栓等。如:材料在介/植入體內后,細菌經入口處侵入,范德華力和靜電作用使細菌吸附在材料/器械外壁上,隨后沿著周圍的纖維蛋白鞘蔓延入血,引起感染[1],給患者帶來重大的經濟損失,甚至危及生命安全,美國每年治療醫療器械引發感染的費用接近270 億美元[2]。對于血液接觸類材料在使用過程中首先發生的是血液中的各種蛋白質在材料表面吸附,隨后會引發凝血反應、血小板黏附與激活、補體系統激活、紅細胞及白細胞響應,進而形成血栓和炎癥,最終導致器械應用失敗[3]。基于上述問題,在材料表面調控結構組成、構建功能表面、實現低并發癥和生物相容性是該領域亟需解決的重要科學問題,并且“材料表面生物功能化及改性”已列入國務院“十三五”國家科技創新規劃,因此該領域具有重要的研究意義。
目前,賦予材料表面特定化學官能團,進而提供其功能性的最常見方法有:表面化學接枝改性、單分子層自組裝(SAMs)、層層自組裝(LBL)、多巴胺功能涂層等。
1 表面化學接枝改性
表面化學接枝改性在很大程度上增強了材料表面的功能穩定性。表面化學接枝改性主要分為“grafting to”和“grafting from”,較為常見是表面接枝聚合物刷,其類型包括均聚刷、嵌段共聚刷、無規共聚刷、交聯刷、梯度刷等,各種聚合物刷所表現出的功能也有所不同[4]。蘇州大學陳紅課題組[5]論述了表面拓撲結構與化學接枝改性對界面生物學性能的影響;四川大學趙長生課題組[6]在聚醚砜膜表面接枝類肝素物質提高表面的抗凝血性能,可應用到血液凈化領域;華南理工大學張廣照課題組[7]在材料表面接枝聚電解質刷,并研究了與蛋白質特異性吸附作用;浙江大學徐志康課題組[8]將抗污功能聚合物刷接枝到材料表面并研究其氧化穩定性;西南交通大學黃楠課題組[9]通過接枝聚合物刷釋放NO 來改善血管支架的生物相容性及減少體內支架的再狹窄。本課題組采用表面化學接枝構建雙層高分子刷,通過對高分子刷層結構和組成的調控與設計,獲得了水化驅動[10]、溫度驅動[11]和細菌響應性[12]智能雙層刷醫用表面(圖1),實現按需啟動殺菌。
基于化學接枝改性方法存在如下局限性:(1)該策略相對復雜,功能化過程通常會涉及多個步驟;(2)接枝的聚合物刷厚度有限;(3)高額的制備成本以及無法在復雜形狀材料/器械表面進行功能化學接枝改性。
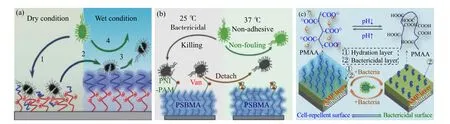
圖 1 智能雙層聚合物刷醫用表面Fig. 1 Responsive medical surface with hierarchical polymer brushes
2 單子層自組裝
SAMs 指分子通過某些特定的基團與基底表面相互作用、從而形成一定程度上有序的單分子層結構。SAMs 由于表面結構確定,因此是研究表面物理化學性質以及表面與生物分子相互作用的理想模型。Whitesides等[13]通過SAMs 將表面化學組成與蛋白質排斥性能相關聯,并總結出排斥蛋白質的化學基團應具有極性、氫鍵受體、非電中性的特征。SAMs 作為模型表面也可用于研究材料表面與細胞間的相互作用[14,15]。通過SAMs 法進行材料表面改性,能夠簡單高效地使表面具有特定化學官能團,但表面單分子層能承載的生物活性分子數量非常有限。
3 層層自組裝
LBL 是利用目標物質與基底表面官能團之間的化學作用、靜電相互作用或氫鍵與配位鍵等逐層交替沉積而成[16]。LBL 具有簡單、多功能性納米級控制等優點,是涂覆平面和顆粒廣泛使用的技術之一,圖2列舉了幾種利用LBL 技術制備的各種功能材料[17]。浙江大學計劍課題組[18,19]采用LBL 技術開展了一系列工作,比如釋放疏水藥物的涂層構建,同時詳細論述了通過LBL 技術構建細胞外基質模擬表面來調控細胞行為;吉林大學孫俊奇課題組利用LBL 技術分別制備了可愈合的抗污膜[20]、納米纖維膜[21]。但LBL 技術存在沉積層多、耗時長、穩定性較差、膜厚度有限、反復沉積過程中沉積液交叉污染等不足。
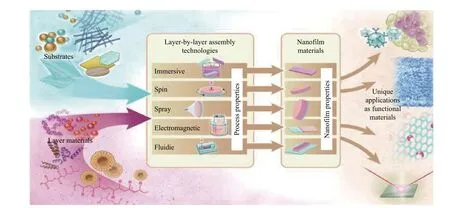
圖 2 LBL 技術制備各種功能材料[17]Fig. 2 Different functional materials prepared by LBL technique[17]
4 多巴胺功能涂層
受到貽貝蛋白黏附的啟發,由于多巴胺具有兒茶酚結構,能夠通過氧化聚合的方式形成無基底依賴性涂層,聚多巴胺涂層中具有兒茶酚以及胺基、亞胺基基團,與其他活性物質后續反應可賦予涂層多種性能[22],Messersmith 等[23]研究了聚多巴胺功能涂層體系,圖3 為多巴胺仿生黏附機制。Caruso等[24]通過一步組裝法制備單寧酸(TA)-鐵(III)絡合物體系,并在顆粒及膜表面進行涂層。這兩類體系均利用了鄰苯酚類衍生物與材料表面的多重相互作用(包括共價鍵和氫鍵、范德華力、陽離子-π等非共價鍵)在多種類型基材的表面實現功能化。在過去10 年里,雖然科研人員在對聚多巴胺或植物多酚涂層的研究中開辟了一種對基底表面進行修飾以獲得多功能材料表面的有效途徑,但聚多巴胺體系中的兒茶酚基團不穩定,極易氧化成鄰苯二醌,從而使材料表面的顏色發生變化,單寧酸體系中因鄰苯三酚與三價鐵離子的絡合作用,材料涂層顏色較深,呈棕色或黑色;另外,多巴胺的聚合過程復雜,沉積速率較慢,上述不足限制了其進一步應用,特別是在生物醫學領域。
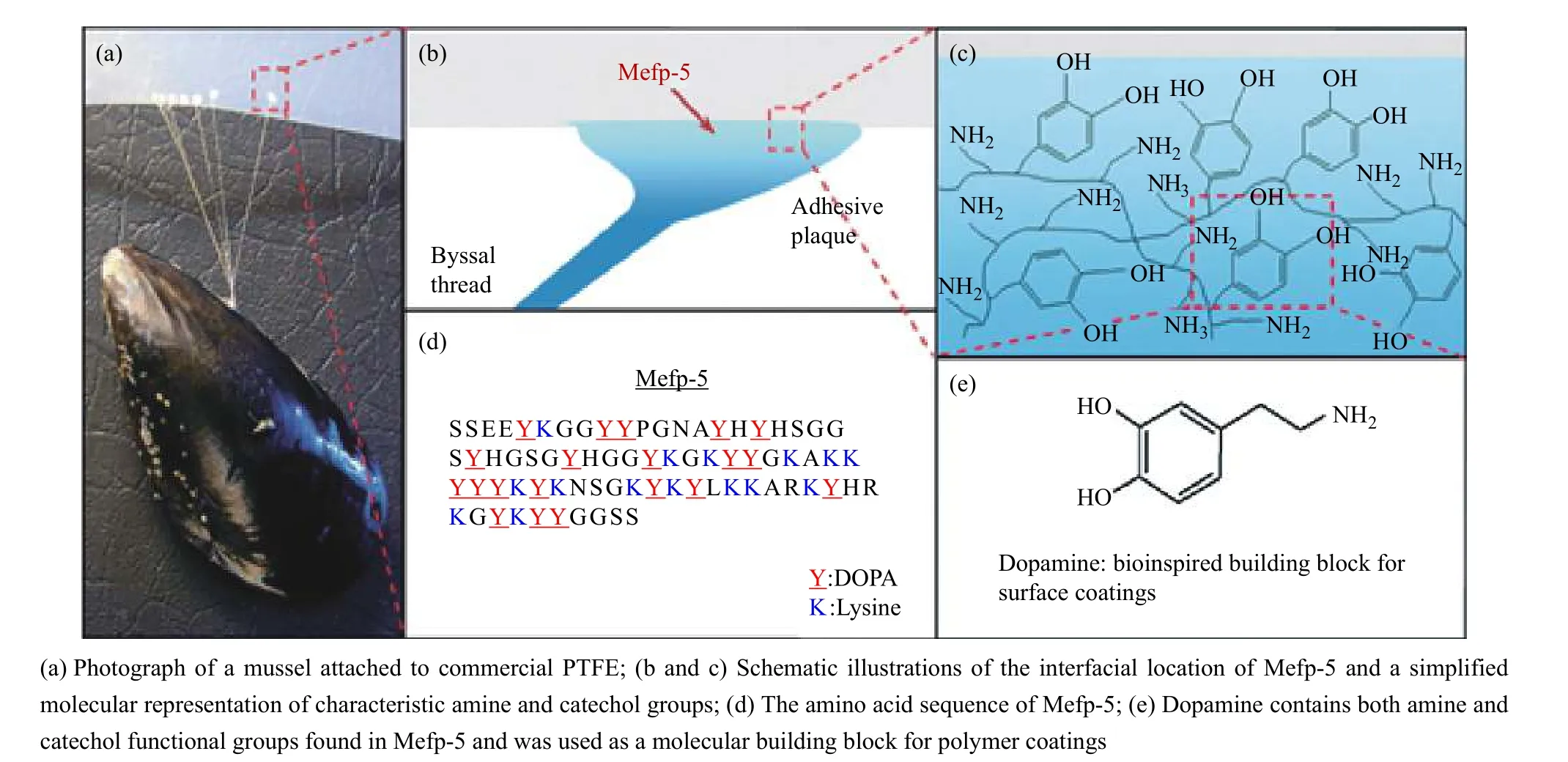
圖 3 多巴胺仿生黏附的機制[23]Fig. 3 Mechanism of dopamine adhesion[23]
5 聚電解質-表面活性劑復合物功能涂層
聚電解質-表面活性劑復合物(簡稱聚電解質復合物)是聚電解質和帶相反電荷的表面活性劑通過靜電組裝誘導形成的復合物,帶電組分之間的靜電相互作用和聚電解質主鏈與表面活性劑烷基鏈之間的疏水相互作用對于驅動分子自組裝以形成有序結構貢獻較大[25-27]。該復合物易于制備和分離,可構建成各種有序結構。圖4 為聚電解質-表面活性劑復合物中可能排列結構的示意圖[27]:通過調節聚電解質電荷密度和分布、聚電解質鏈性質(剛/柔性、分子量及分布、支化結構)、表面活性劑鏈的性質(極性基團、烷基鏈、極性-非極性體積比、分子量)、聚電解質和表面活性劑的電荷摩爾比和靜電組裝條件,可以改變聚電解質和表面活性劑靜電組裝行為和結構。
本課題組利用一步靜電組裝分別制備了聚胍-硬脂酸鈉、聚賴氨酸-雙(2-乙己基)磺基丁二酸鈉、單寧酸-季銨鹽復合物,并成功將上述復合物作為涂層制備抗菌醫用導管[28,29]。其中,通過研究聚己亞甲基鹽酸(PHMB)與不同陰離子反應物之間的反應,得到了理想的復合物。PHMB 的胍基通過質子化靜電相互作用與帶負電荷的硬脂酸鈉(SS)反應得到了不溶于水的復合物PHMB-SS。通過簡單的浸泡過程在醫用導管的表面可以快速形成涂層,此外,該過程不會改變導管的力學性能,PHMB-SS 涂覆的導管可以殺死細菌并防止隨后的細菌定植,在體外靜態及動態流動條件下表現出抗生物膜形成的特性。隨后,分別在體外和動物體內實驗中探究了涂層的生物相容性,在模擬的人類環境中證明涂層的長期穩定性。動物體內實驗中驗證了涂層的抗菌性能(圖5)。這種制作方法簡單且所制備的涂層具有多種優異性能,為表面改性提供了新的方法,但聚電解質復合物涂層通過疏水或范德華力與基底材料相互作用力弱,涂層易脫落,以及在電解質條件下不穩定,作為醫用涂層很難滿足長效性需求。
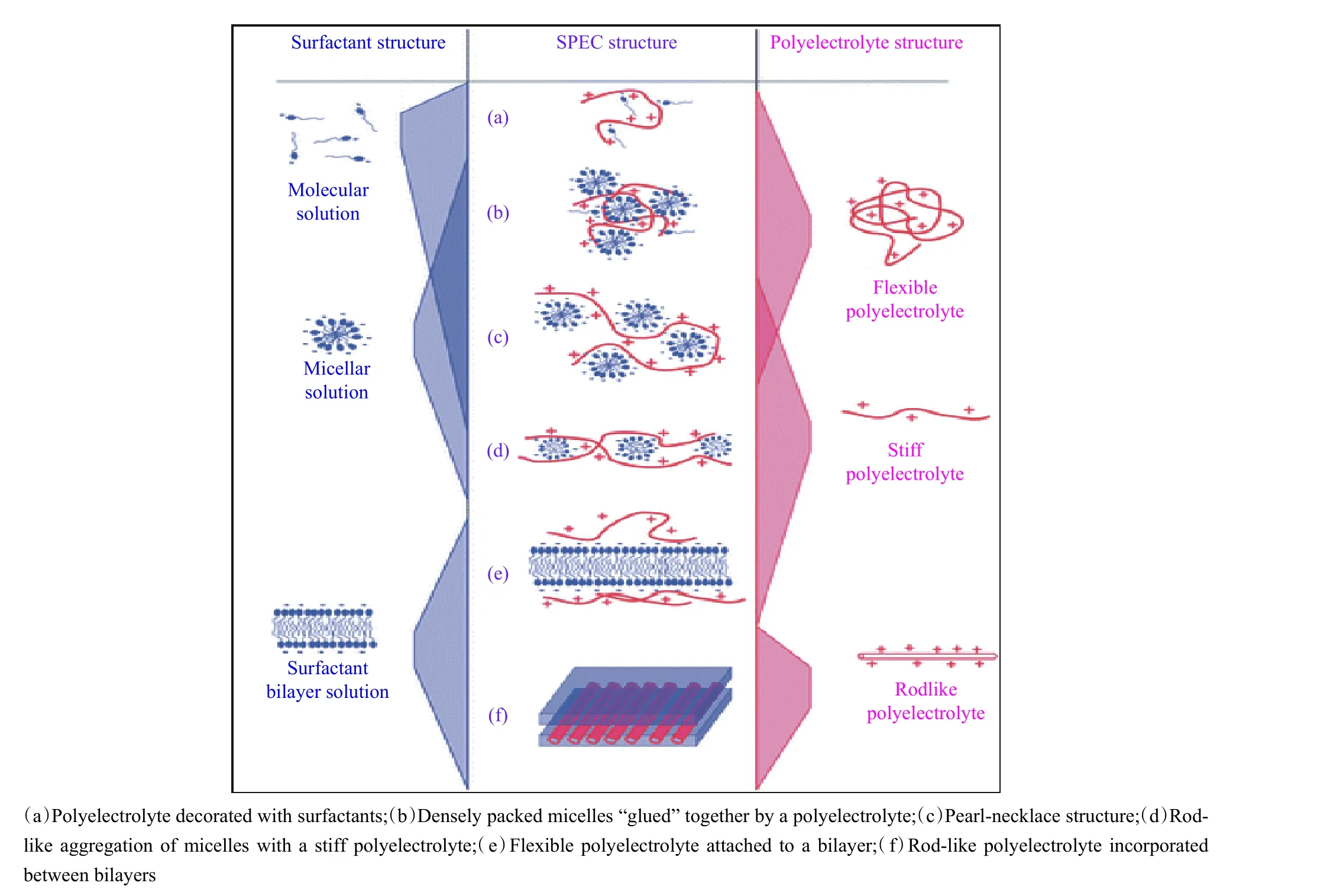
圖 4 聚電解質-表面活性劑復合物可能排列結構的示意圖[27]Fig. 4 Possible arrangements in surfactant-polyelectrolyte complexes[27]
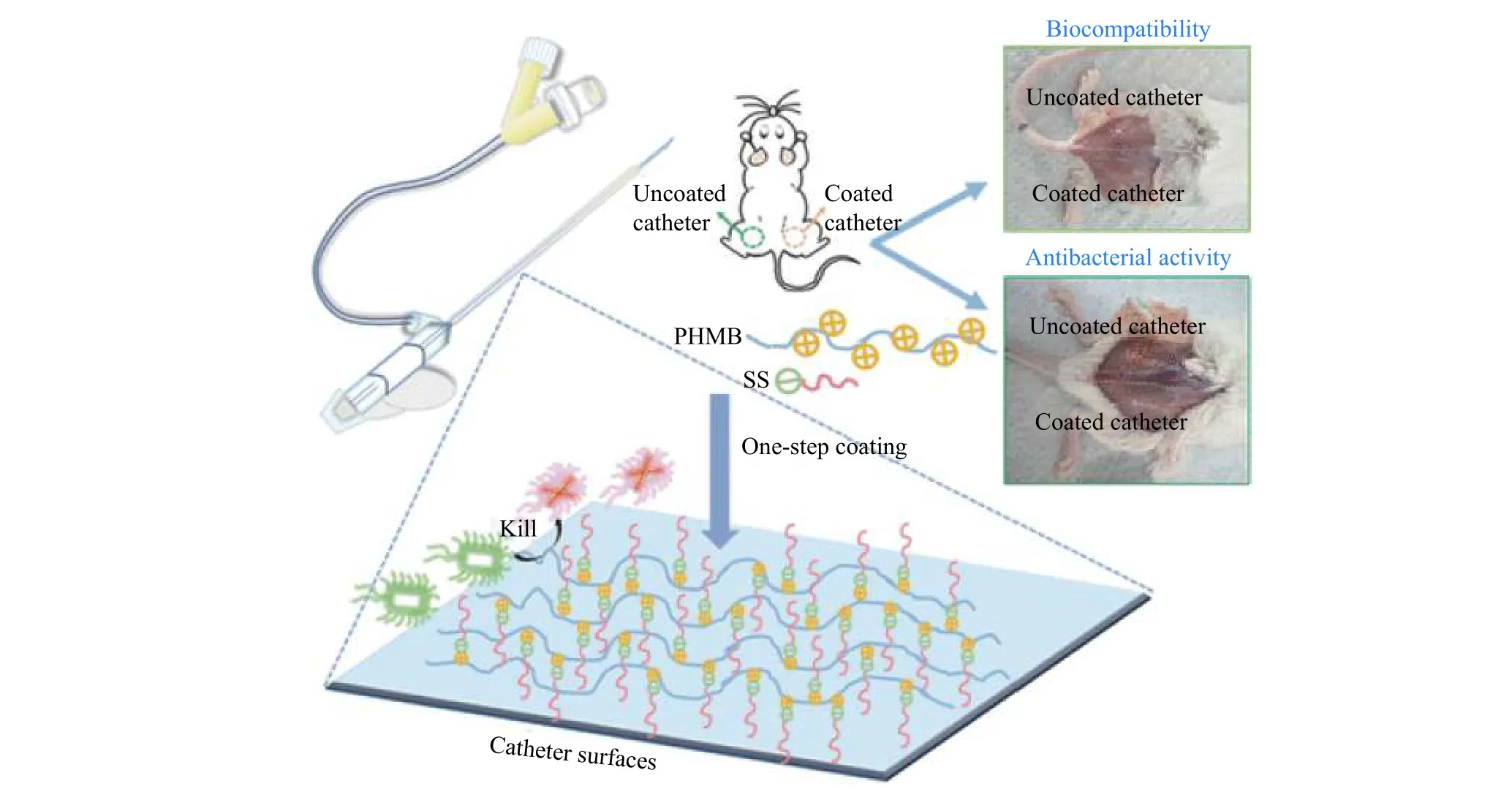
圖 5 一步靜電組裝聚胍-硬脂酸鈉復合物及抗菌涂層[28]Fig. 5 PHMB-SS complex by one step electrostatic assembly and its antibacterial coating[28]
6 總結與展望
上述醫用涂層的構建均取得了較好進展,為其在介/植入醫療器械使用過程降低并發癥提供了很多思路及指導方法,但仍然存在一些局限性或不足。未來低并發癥醫用涂層的研究重點有以下幾個方面:(1)醫用涂層多功能化,兼具抗菌、抗血栓、生物相容性等;(2)醫用涂層無色、穩定、對基底和形狀無依賴性;(3)醫用涂層構建方式簡單,易于工業化。

