一種用于肌腱二級纖維束及周圍腱內膜形態觀察的掃描電鏡制樣方法研究
張憶 蘇波 楊楨 胡若楠 寧良菊
理想的脫細胞肌腱材料需盡可能地保留肌腱天然的超微結構與生化組分,以及近似完整肌腱的力學性能。脫細胞肌腱材料已被廣泛用于動物跟腱、肩袖等組織缺損的修復與重建,并取得了較好的修復重建效果[1-7]。然而,由于肌腱組織過度致密,對完整肌腱直接進行脫細胞處理效果不佳,因此對肌腱進行冰凍切片處理已成為脫細胞肌腱支架材料常用的制備方法之一。肌腱結構中的腱內膜將膠原纖維束分為第一級(Primary fiber bundle)、第二級(Secondary fiber bundle)、第三級(Tertiary fiber bundle)3個不同等級的腱束。已有研究證實,切片厚度只要能保留完整的二級腱束結構就能維持肌腱切片材料的基本力學特性[8-10]。在前期研究中,我們已經摸索出一套染色方法來觀察肌腱膠原纖維束及周圍腱內膜的組分分布情況[11]。但此方法在光學顯微鏡下對于腱內膜較薄弱區域的二級纖維束仍難以辨別,所以我們設想通過掃描電鏡觀察來提高分辨率。然而,常規掃描電鏡的制樣方法往往會失去肌腱本身的結構細節,無法觀察到二級纖維束及周圍腱內膜分布情況[12-14]。結合前期制樣經驗,我們摸索出適用于肌腱二級纖維束及周圍腱內膜形態觀察的掃描電鏡制樣方法,具體報告如下。
1 材料與方法
1.1 實驗材料及主要試劑、儀器
無水乙醇(成都科倫藥業有限公司);Masson染色試劑盒(珠海貝索生物技術有限公司);OCT冰凍切片包埋劑(Tissue-Tek公司,美國);冰凍切片機(Leica公司,德國);雙光子熒光顯微鏡(Nikon公司,日本);熒光顯微鏡(ZEISS公司,德國);體視顯微鏡(ZEISS公司,德國);掃描電子顯微鏡(ZEISS公司,德國)。
1.2 實驗方法
1.2.1雙光子熒光顯微鏡觀察
由市售新鮮豬后蹄分離獲取豬趾淺屈肌腱,以1 cm長度橫切,將肌腱段橫切面直接放置于雙光子熒光顯微鏡下,用1 000 nm波長光源激發,二次諧波顯微成像觀察組織完整性。
1.2.2冰凍切片配合特殊Masson染色觀察
肌腱段經OCT包埋,于-20 ℃下行6 μm厚冰凍切片,行特殊Masson染色。熒光顯微鏡下觀察肌腱二級纖維束與周圍腱內膜組分分布情況。
1.2.3掃描電鏡制樣分組及觀察
根據制樣方法不同,將固定后的肌腱段隨機分為5組。A組,直接進行單純梯度脫水;B組,行冰凍切片,再將肌腱切片梯度脫水;C組,梯度脫水至70%,行冰凍切片,再將肌腱切片繼續梯度脫水;D組,梯度脫水至80%,行冰凍切片,再將肌腱切片繼續梯度脫水;E組,梯度脫水至100%,行冰凍切片。各梯度脫水試劑為乙醇配制,梯度脫水終濃度為100%。冰凍切片厚度均為100 μm。經臨界點干燥噴金后行體視顯微鏡觀察肌腱切片大體結構,掃描電鏡觀察肌腱二級纖維束及周圍腱內膜形態。
2 結果
2.1 雙光子熒光顯微鏡觀察
二次諧波顯微成像觀察示,肌腱段橫切面連續完整,二級纖維束在FITC通道呈現陽性,周圍腱內膜呈現陰性(圖1)。
2.2 冰凍切片配合特殊Masson染色觀察
熒光顯微鏡下觀察示,切片連續均勻,二級纖維束呈紅色,周圍腱內膜呈藍色,但在周圍腱內膜較薄弱區域的二級纖維束邊界難以區別(圖1)。
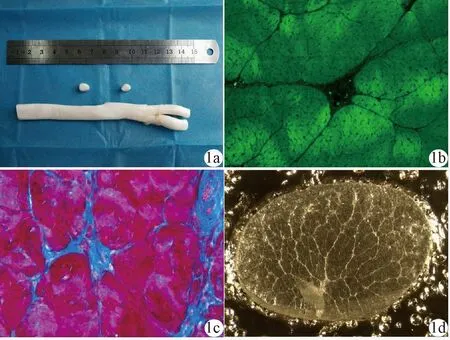
a:肌腱橫切;b:雙光子熒光顯微鏡二次諧波顯微成像觀察(200×);c:Masson染色熒光顯微鏡觀察(200×);d:肌腱切片噴金后體視顯微鏡觀察(25×)a: Crosscutting of the tendon; b: Two-photon fluorescence and second harmonic imaging microscopic observation (200×); c: Fluorescence microscopic observation after Masson staining (200×); d: Stereo microscopic observation of tendon slices after gold sputter coating (25×)
2.3 經不同方法制樣后體視顯微鏡與掃描電鏡觀察
體視顯微鏡觀察示肌腱切片噴金后結構完整連續,三級纖維束的周圍腱內膜清晰可見(圖1)。掃描電鏡觀察顯示:A組,整體過度收縮,呈致密板塊狀,無法觀察到二級纖維束分布情況,高倍鏡下無法辨認膠原纖維排列;B組,有較大冰晶空隙形成,二級纖維束結構難以辨認,高倍鏡下膠原纖維排列清晰可見;C組,二級纖維束及其周圍腱內膜、膠原纖維排列均清晰可見;D組,整體明顯收縮,二級纖維束區別困難,高倍鏡下膠原纖維排列清晰可見;E組,整體過度收縮,由于過于致密,冰凍切片時造成肌腱出現規律性斷裂紋,無法觀察到二級纖維束分布形態,高倍鏡下也無法觀察到膠原纖維排列及形態(圖2、3)。
3 討論
對完整肌腱進行冰凍切片處理在制備脫細胞肌腱支架材料時可有效促進脫細胞效果。其中,切片厚度可決定是否保留肌腱切片的生物力學特性,然而在表征測量與肌腱力學結構單元相關的二級纖維束形態數據時常采用常規的組織學制片方法配合光學顯微鏡采圖[10,15]。傳統表征方法由于對肌腱纖維束與周圍腱內膜缺乏差異化的特異性染色,導致觀察效果較差。在前期工作中,我們摸索出了針對肌腱膠原纖維束與周圍腱內膜的差異化特殊染色方法。該方法能觀察到大部分二級纖維束及周圍腱內膜結構,但是周圍腱內膜較薄弱區域在光學顯微鏡下還是難以區別,所以我們設想通過掃描電鏡來提高表征的分辨精度。在利用掃描電鏡觀察肌腱組織時,大多數研究側重于觀察平行于膠原纖維束的縱切面,但是縱切面無法觀察到完整的二級纖維束及周圍腱內膜形態[16-19]。清晰地觀察到肌腱橫切面對于制備脫細胞肌腱切片材料的厚度選擇至關重要。然而,目前僅有少數研究報道了肌腱橫切面掃描電鏡結果,而且所利用的掃描電鏡制樣方法對組織本身結構破壞嚴重并導致肌腱本身的細微結構消失[12]。

a:A組;b:B組;c:C組;d:D組;e:E組a: Group A; b: Group B; c: Group C; d: Group D; e: Group E

a:A組;b:B組;c:C組;d:D組;e:E組a: Group A; b: Group B; c: Group C; d: Group D; e: Group E
本研究的5組不同的掃描電鏡制樣方法中,A組是最常用的方法,但該方法會導致肌腱整體過度收縮,無法區分膠原纖維束及周圍腱內膜。由于肌腱屬于致密結締組織,纖維束中的膠原纖維致密而有序地平行排列,腱外膜及腱內膜連續且有規律地包裹纖維束[8,20],因此我們推測當肌腱段作為一個整體進行梯度脫水至100%時,組織會呈現過度收縮。肌腱膠原纖維束與周圍腱內膜均主要由Ⅰ型膠原構成,但膠原纖維束因為要提供抗拉功能,其絕大多數膠原纖維極其有序地緊密平行排列,而起支持和營養作用的周圍腱內膜的纖維則呈現明顯的疏松網狀分布[21],我們猜測在整體過度收縮過程中疏松的周圍腱內膜被二級纖維束擠壓至無法觀察。B組將固定后的肌腱段先冰凍切片再進行梯度脫水,由于肌腱切片樣本失去了肌腱段作為整體的收縮能力,保留了二級纖維束及周圍腱內膜的形態,且在高倍鏡下觀察也保留了膠原纖維排列形態。但由于肌腱組織含水量豐富,直接進行冰凍切片非常容易形成大量冰晶[22-23]。冰晶的形成會嚴重干擾對二級纖維束完整形態的判斷。所以我們設置了不同梯度脫水時間節點,對肌腱段脫去不同程度的水分后再進行冰凍切片制備。D組與E組都由于脫水過度,肌腱二級纖維束與周圍腱內膜形態消失,高倍鏡下僅D組保留了膠原纖維的排列及形態,E組還由于過度脫水導致肌腱段硬度變高,在冰凍切片時極易發生脆裂。C組脫水程度適當,肌腱段失去70%水分后在冰凍切片環境下無明顯冰晶形成,也未出現過度收縮情況,并且硬度適中,能輕松均勻連續地切出具有完整性的肌腱切片。
綜上所述,本實驗通過10%甲醛固定豬趾淺屈肌腱,乙醇梯度脫水至70%,行冰凍切片橫切,厚100 μm,再將肌腱切片繼續梯度脫水至100%,按照常規掃描電鏡臨界點干燥與噴金后,能清晰地觀察到肌腱二級纖維束及周圍腱內膜形態,同時能保留膠原纖維排列狀態。在制備脫細胞肌腱切片支架材料時,此方法對指導材料生物力學性能的保護具有重要的組織形態學意義。

