肺結核活動性判斷規范及臨床應用專家共識
國家感染性疾病臨床醫學研究中心 深圳市第三人民醫院 《中國防癆雜志》編輯委員會
結核病是傳染性疾病領域死亡人數第一位的疾病。中國肺結核疫情十分嚴峻,是全球第二大結核病高負擔國家,2018年新發肺結核患者82.3萬例[1-2]。結核分枝桿菌病原學檢查陽性是診斷肺結核的金標準[3],但我國仍有大量病原學陰性的肺結核患者。《“十三五”全國結核病防治規劃》[4]指出,到2020年,我國肺結核患者病原學陽性率要達到50%以上,這意味著即使在2020年完成了國家規劃指標的情況下,仍可能有接近50%的病原學陰性肺結核患者。活動性判斷作為肺結核診療工作中不可或缺的環節,主要解決肺結核“治不治療”和“停不停藥”的問題。對病原學陽性肺結核進行活動性判斷相對容易,但對病原學陰性肺結核則需要結合臨床表現、治療史和影像學等多種手段,才能做出最終判斷[5-7]。
背 景
一直以來,我國尚未建立肺結核活動性判斷的科學評價體系,肺結核過診過治和漏診漏治的現象時有發生,影響了醫療質量,加重了醫療負擔。
影像學在肺結核活動性判斷中發揮著重要作用[8-10],但需要指出的是“影像學穩定”不能等同于“非活動性”或“陳舊性”[5]。特別是當患者具有典型的結核中毒癥狀,或并發艾滋病、糖尿病,以及存在耐藥、治療不規律和血藥濃度不達標等因素時,雖然影像學判讀為“穩定”或“陳舊”,但病變內的結核分枝桿菌仍可能處于復制狀態[11]。片面依靠影像學診斷會導致一部分活動性肺結核患者失去早期治療的機會,這反映了影像學評價的局限性,因此需要對影像學診斷標準進行規范[12]。胸部X線攝影(簡稱“胸片”)由于對微小病灶和隱蔽部位的病變檢出率較低,在肺結核活動性判斷上存在不足,近年來已經逐漸被胸部CT(computed tomography)所取代[13]。胸部CT具有較高的密度分辨率和空間分辨率,在肺結核活動性判斷方面具有較為突出的作用[14]。有研究表明,約80%的活動性肺結核、89%的非活動性肺結核病變可由CT檢查正確區別[15],但也有不足之處。近年來,基于肺結核征象演變與治療隨訪研究的深入開展,以及影像學技術的普及應用[包括高分辨率CT(HRCT)、CT增強技術、MRI等],肺結核活動性判斷的準確性得以大幅度提高。
另一方面,臨床評價對于肺結核的活動性判斷亦至關重要,判斷依據包括臨床表現、治療史和實驗室檢查等。截至目前,在肺結核活動性判斷方面還沒有高效的生物標志物問世。γ-干擾素釋放試驗(interferon-γ release assays,IGRAs)和血清結核抗體檢測不能直接用于肺結核活動性判斷[16]。近年來,基于氣管鏡技術的支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)聯合分子生物學檢測、肺組織活檢,以及超聲內鏡引導下的經支氣管針吸活檢(endobronchial ultrasound-transbronchial needle aspitation,EBUS-TBNA)等,為肺結核活動性判斷提供了精準的技術保證[17]。
綜上,建立肺結核活動性判斷的臨床綜合評價體系變成可行之事、當務之急。基于此,由國家感染性疾病臨床醫學研究中心、深圳市第三人民醫院與《中國防癆雜志》編委會牽頭組織國內結核病科、影像科、綜合醫療機構相關學科和結核病防治領域等有經驗的專家,依據臨床經驗和循證醫學證據撰寫了《肺結核活動性判斷規范及臨床應用專家共識》(以下簡稱“《共識》”)。考慮到《共識》的普遍適用性,同時邀請了綜合醫療機構的關聯學科專家及基層結核病防治機構的醫生共同參與討論與撰寫過程。
活動性判斷的對象
一、肺結核患者治療前需要進行活動性評價
對于初診,且僅有近期臨床和影像學資料的肺結核患者,需進行活動性評價以決定是否進行抗結核治療。病原學陽性肺結核可直接判斷為活動性肺結核[3],病原學檢測陰性肺結核則需要進一步進行活動性評價。
二、肺結核患者療程結束時需要進行活動性評價
肺結核患者在療程結束時,需要進行活動性評價以決定是否終止治療。活動性評價需基于以下信息:(1)患者的臨床癥狀是否改善、有無并發癥及其治療情況等;(2)在療程結束前連續2個月痰菌檢查陰性[18],獲得連續的病原學檢查陰性證據;(3)治療第2個月末、第5個月末和療程結束時分別進行3次影像學檢查(胸片或CT檢查,以CT檢查為佳),這些序貫性資料是活動性判斷的重要依據。
肺結核活動性評價方法
一、臨床癥狀評價
1.初診患者:出現臨床癥狀是患者就診的常見原因,可將其作為判斷肺結核活動性的依據之一。咳嗽、咳痰≥2周,可合并有痰中帶血或咯血;出現全身結核中毒癥狀,如盜汗、乏力、間斷或持續午后低熱,以及食欲不振、體質量減輕等,以上癥狀往往提示肺結核具有活動性[19]。部分患者可無癥狀而在體檢時發現肺部病變[20],需要結合影像學及相關檢查進行肺結核診斷及活動性判斷。
2.療程結束的患者:多數患者癥狀消失,細菌學檢查陰轉,影像學表現為肺部病灶持續穩定。少數患者由于肺部不可逆的組織損傷或并發其他肺部疾病,即便存在咳嗽、咳痰、喘息、咯血等癥狀,亦不能將其作為活動性肺結核的判斷依據,需仔細甄別。
二、治療史評價
1.療程結束的患者:需要系統地進行治療史評價,包括抗結核化療方案的藥物組成和療程、患者依從性和耐受性、細菌學及藥物血藥濃度等。
2.化療不徹底和治療不規律的患者:需要調整治療和管理方式,確保完成療程后再行活動性評價,同時觀察細菌學和影像學的動態變化。
三、實驗室評價
(一)病原學評價
1.初診患者:對于痰標本病原學檢測(包括涂片、培養和分子生物學檢測等)為陰性的肺結核患者,推薦采用BALF和支氣管鏡下活檢技術,以進一步獲取病原學和病理學證據。
2.療程結束的患者:主要檢測技術包括痰涂片、結核分枝桿菌培養等。由于基于結核分枝桿菌DNA檢測的分子檢測方法不能區分死菌和活菌,因此不推薦用于抗結核化療的療效評價[21-22]。有研究顯示,結核分枝桿菌RNA檢測技術有助于區分死菌和活菌[23-24]。
(二)血清學及免疫學評價
在判定結核病活動性方面,目前尚無可用的、有效的生物標志物。血清學檢查在活動性判斷上證據級別較低,存在疑似結果時需結合影像學和臨床表現進行綜合判斷。以下幾個指標僅供參考:
1.炎性指標:血紅細胞沉降率(erythrocyte sedimentation rate,ESR)增快和C反應蛋白(C-reactive protein,CRP)升高常提示炎癥反應的持續存在[25];貧血可作為活動性肺結核的慢性消耗性指標[26]。但這些指標應在排除其他疾病的基礎上用于輔助判斷肺結核活動性。
2.T細胞免疫學檢查:結核菌素皮膚試驗(tuberculin skin test,TST)和IGRAs僅能反映機體處于潛伏結核感染(latent tuberculosis infection,LTBI)狀態,而在肺結核活動性判斷中的價值有限。有研究發現,IGRAs對于新近感染的判斷較TST具有一定優勢,50%的活動性肺結核患者經治療后可出現IGRAs陰轉,提示IGRAs對肺結核轉歸判斷可能具有一定意義[27-29]。由IGRAs技術衍生而來的結核分枝桿菌特異性抗原/植物凝集素比值(TBAg/PHA比值),在活動性肺結核患者往往高于LTBI者的水平,提示T細胞免疫反應可能與抗原載量有關[30]。目前,IGRAs尚不能對肺結核活動性做出精確判斷。另外,T淋巴細胞標記物CD 27、 CD 38、人白細胞抗原(HLA)-DR和細胞內Ki 67表達最近被證明是有希望的生物標志物[31],但還有待進一步做深入研究證實。
四、影像學評價
(一)肺結核活動性、穩定性及不確定性征象
1.胸部X線檢查:(1)活動性征象,包括多發性結節狀病灶,片狀、云絮狀及大葉性肺實變,團塊狀陰影,以及肺門或縱隔淋巴結增大等。這些病灶具有密度不均、中間密度高周邊密度低、分布不均、呈浸潤性改變等特點;可伴有厚壁、薄壁、張力性空洞及多發蟲蝕狀空洞;還可伴有鄰近“衛星灶”、支氣管播散灶、引流性支氣管、淋巴管炎、胸腔積液等。(2)穩定性征象,包括致密的結節及斑塊狀病灶、鈣化灶、纖維條索狀病灶、肺氣腫,以及治療后殘留的凈化性空洞等,這些病灶邊界清晰銳利,可伴有胸膜和(或)縱隔淋巴結鈣化。雙肺尖的胸膜增厚也是既往肺結核感染的證據之一。(3)不確定性征象,包括毀損肺、肺不張、結核瘤、斑塊狀病灶等尚未完全鈣化的病變,不能據此做出非活動性肺結核判斷,需完善CT檢查后做進一步分析。
2.胸部CT檢查:對CT掃描所顯示的各種征象分述如下。
1)活動性征象:包括小葉中心結節狀病灶、樹芽征、病灶邊緣模糊、中低密度的結節及腫塊狀病灶、不同范圍的肺實變、磨玻璃樣密度影(GGO)、小葉間隔增厚、結節狀病灶簇集征、空洞(厚壁、薄壁、張力性、蟲蝕樣)伴或不伴引流支氣管、支氣管壁增厚、反暈征、彌漫性分布的粟粒結節狀病灶、淋巴結腫大、胸腔積液(含包裹性)等。活動性肺結核患者的肺野可檢出多種形態的活動性病變,往往以“征象群”的形式存在[32]。其中,以小葉中心結節、樹芽征、邊緣模糊結節和大小不等的斑片狀實變影在活動性肺結核中較為常見,這些征象在活動性判斷上具有較高價值。雖然病原學陰性肺結核中空洞的檢出率明顯低于病原學陽性肺結核,但治療前業已存在的肺部空洞是提示活動性的重要依據。反暈征與結節狀簇集征較少見,多見于病原學陰性肺結核患者中,對“活動性”判斷有一定提示意義[33-34]。值得注意的是,對于完成治療并獲得細菌學治愈的肺結核,有時病灶區域也可殘留1~2種活動性病灶的CT征象,其中以樹芽征、GGO、不規則實變影多見,為療程結束后的病灶殘留征象,并不代表疾病仍處于活動狀態[35]。雖然GGO多代表滲出性改變,也是活動性判斷的重要依據,但在治療過程中長期存在的GGO可能反映肺泡壁的間質纖維化改變,與病變修復有關,即磨玻璃樣影并非具有特異性,故需進行綜合分析判斷。
2)穩定性征象:包括發生鈣化的結節或斑塊狀病灶、纖細銳利的線狀及條索狀影、支氣管聚攏迂曲、支氣管擴張、肺氣腫、胸膜鈣化、包裹性鈣化或線樣增厚、凈化性空洞(具有規律治療史)或空洞內容物鈣化等。需要注意的是,由于肺結核的慢性病程特點,往往可出現“活動性”與“穩定性”征象并存的現象,因此在判讀時需對全肺病變仔細觀察,在排除活動性CT征象后方能做出非活動性判斷。例如,支氣管擴張通常為肺結核痊愈后殘留的氣道不可逆性損傷,為非活動性表現,但當并發支氣管壁增厚、黏液嵌塞及周圍結節狀病灶呈樹芽征樣分布時,往往反映肺結核病變的活動性。此外,條帶樣實變、胸膜不規則增厚是活動性不確定的CT征象,部分仍可能具有潛在的活動性;如經過治療后隨訪,出現纖細、銳利的條索狀影,胸膜增厚逐漸變薄呈線樣、伴鈣化或出現胸膜下脂肪層增厚,則提示為非活動性。“肺尖帽”為肺尖部胸膜增厚的CT征象,可能為既往感染肺結核的證據。
3)不確定性征象:包括未發生鈣化的結核瘤、斑塊狀或界限清楚的不規則實變、空氣潴留征、肺不張、支氣管閉塞或狹窄、胸膜不規則增厚與包裹等。這些征象往往提示肺結核病變主體穩定,但部分病變經治療觀察可獲得不同程度的好轉,提示部分仍具有潛在的活動性。例如,界限清楚的不規則實變、斑塊狀病灶或結核瘤,仍不能除外活動性,需要進一步行CT增強檢查;如出現明顯強化,邊緣強化、環形強化或灶性低密度區則提示處于活動期。結核球周圍衛星灶形態也有提示作用,呈小葉中心結節狀病灶或為樹芽征表現時,往往提示具有活動性。肺不張通常見于非活動性肺結核,多見于治療后支氣管不可逆損傷而導致陷閉和(或)毀損肺,但支氣管結核也可繼發肺不張,伴隨征象多為支氣管壁增厚、管腔不均勻狹窄,以及在其他肺野檢出結核播散征象,此時則提示肺不張仍具有活動性。胸膜不規則增厚與包裹往往提示胸膜存在嚴重的炎性反應,CT增強掃描多呈明顯強化,但對于完成療程的胸膜炎患者,如胸膜包裹長期穩定,則可停藥進行隨訪觀察,或進行外科胸膜剝脫術以改善肺功能。空氣潴留征反映小氣道功能損傷,與氣道炎癥或瘢痕狹窄導致活瓣通氣閥形成相關,本身不提示活動性,需要結合肺內病變狀況區別對待[16]。對活動性不確定征象評價時需結合臨床表現、治療史,以及動態隨訪做出評價,必要時采用CT增強檢查、支氣管鏡、經皮肺穿刺活檢等進一步明確。
3.胸部MRI:胸部MRI具有無輻射性,因此可以作為特殊人群,如兒童、育齡婦女、孕婦(在妊娠的前3個月應避免做MRI檢查),或行CT增強掃描時發生對比劑過敏的患者,肺結核活動性判斷的替代性檢查手段。胸部MRI也可以用于特殊人群肺結核治療后的隨訪。隨著快速成像序列的開發和高場強的應用,尤其是超短回波時間(UTE)序列的使用,胸部MRI在成像速度和圖像質量方面均有顯著的提升,已經在顯示肺部病灶的部分形態學特征方面(實變、結節、空洞等)可與CT相媲美;但是,在顯示樹芽征、小磨玻璃樣影等方面尚有欠缺[36]。胸部MRI具有較高的組織對比度和多參數成像的優勢[T1WI、T2WI、擴散加權成像(DWI)、動態對比增強磁共振成像(DCE-MRI)等],對于評估結核病灶組織特征方面明顯優于CT,可用于肺內結核病灶、縱隔淋巴結的活動性和治療后評價。有研究顯示,根據T2WI的病灶信號強度,可以預測不同的病理階段或肺結核進程的演變[37]:(1)T2WI呈輕度高信號,提示滲出性炎癥階段;(2)病灶內T2WI呈現顯著高強度,提示液化壞死形成;(3)中心區T2WI等信號伴周圍T2WI高信號,提示干酪樣壞死形成;(4)病變內T2WI呈相對低信號,提示病灶以纖維化為主;(5)T2WI 呈顯著低信號,提示為鈣化成分,為愈合階段。胸部MR增強掃描也有助于評估肺結核的不同病理階段:呈均一的顯著強化時,提示急性期肉芽腫階段;呈特征性環形強化、中央無強化區域時,提示為干酪成分,環形強化區域提示為纖維肉芽組織;未強化時,提示靜止期或愈合階段。
4.正電子發射體層攝影術(PET)-CT :PET-CT對于區分肺結核活動性與非活動性具有獨特價值。研究表明,活動性肺結核病灶中含有大量類上皮細胞、朗罕細胞和淋巴細胞,這些細胞的葡萄糖代謝旺盛,其最大標準攝取值(SUVmax值)明顯高于非活動性病變。因此,PET-CT在確定亞臨床結核病患者、陳舊性肺結核的早期復發和評估治療反應方面均有應用意義[14, 38]。有研究發現,經過抗結核藥物治療并獲得治愈的肺結核患者行PET-CT顯像時,盡管大多數殘留病灶經過隨訪其大小和代謝強度有所改善,但仍有部分患者殘留18F-氟代脫氧葡萄糖(18-fluorine flurode oxyglucose,18F-FDG)陽性病灶,主要原因是肺組織中可能仍有結核分枝桿菌殘留所致的炎性反應,此時機體對結核分枝桿菌的免疫清除是病變修復的重要補充,但這一過程需要更長的時間[11]。該技術為活動性判斷帶來全新的思路,也進一步詮釋了肺結核治愈后組織修復的進程要明顯滯后于細菌學轉陰的特點。PET-CT對肺結核活動性評價具有重要價值,但由于PET-CT價格昂貴,在我國尚不能常規用于肺結核活動性判斷。
(二)肺結核活動性影像學判斷的基本原則
1.治療前活動性判斷要堅持“排除法”原則:活動性征象對提示活動性肺結核有重要意義。治療前活動性影像學判斷應堅持“排除法”原則,即首先排除“活動性”征象,然后采取多種診斷技術提高對“不確定性病變”的精準評價效果。尤其注意不能僅根據“鈣化”“纖維條索狀影”等直接做出“陳舊性結核”的結論。對于復雜和多發的疑似“穩定性”病變的判斷要持慎重態度,不能輕易作出“陳舊性”病變的診斷。必要時可行CT增強掃描、支氣管鏡檢查及肺活檢等檢查手段以進一步明確診斷。
2.療程結束后活動性判斷要堅持“趨勢評價”原則:由于肺結核的病理學與影像學轉歸多滯后于細菌學轉歸,故在療程結束后仍會殘留一些活動性征象,并在停藥后的隨訪過程中,殘留病變仍可繼續修復和重塑[39]。故在療程結束后進行活動性判斷時,通過對連續性的影像學資料進行評價,掌握趨勢變化尤為重要[40]。如病變進展、反復則提示仍處于活動期;如病變主體處于顯著吸收或好轉的趨勢,未出現新發病變,則提示肺結核病灶趨于穩定。如病變吸收但不顯著,或殘留較多的活動性征象特點,則提示活動性不確定。總之,在療程結束后的活動性判斷上應注重轉歸趨勢評價,而不是將重點放在具體殘留征象的評價上,這與初診肺結核的活動性判斷有所區別。
(三)影像學“分類判斷”原則
影像學推薦分類判斷原則,判斷意見一般分為活動性、穩定及不確定等3種情況,這符合病理-影像學演變的客觀性原則。對于不確定的情況需要選擇影像學手段(如HRCT、CT增強掃描)或支氣管鏡檢查,并進一步獲得病原學和組織學證據。同樣對于影像學“穩定”也推薦進行臨床綜合評價,以利于最終做出“治”與“不治”的臨床決策。
總之,在影像學活動性判斷上應堅持客觀性原則,初診患者以排除活動性征象為主;療程結束的患者活動性判斷則以觀察病變的趨勢變化為主。
五、病理學評價
肺結核病理學檢查包括常規病理學、抗酸染色及分子病理學檢測等。結核病的基本病理變化主要為滲出性病變、增生性病變和壞死性病變,這3種類型的病變可以共存,隨機體抵抗力、對結核分枝桿菌的變態反應強度、結核分枝桿菌的菌量及毒力強度的變化而相互轉化[40]。肺結核的組織病理學改變通常為壞死性肉芽腫性炎,但亦可為非壞死性肉芽腫性炎,典型病變是肉芽腫伴干酪樣壞死及結核結節形成,外周有纖維結締組織和慢性炎性細胞浸潤,周邊可見朗罕細胞[41]。結核病病理診斷僅憑組織形態學觀察只能做出提示性診斷,如符合結核等;抗酸染色查病原菌有重要意義,但陽性檢出率相對較低。近年來,應用熒光定量聚合酶鏈式反應技術檢測石蠟組織中結核分枝桿菌脫氧核糖核酸(TB-DNA),越來越受到重視。多項研究表明,該技術檢測敏感度明顯高于抗酸染色法,對確診結核病有重要意義[42- 43]。
結核病經過抗結核藥物治療,病變可吸收、縮小甚至消散,也可出現纖維化及鈣化(稱為纖維鈣化性病變)。因此,病理學評價肺結核的病變活動與否,主要有以下表現:(1)外科手術切除標本判斷較易,較穩定的病變表現為病變周圍纖維化、鈣化和纖維包裹性壞死病變,如局灶型結核和結核瘤;活動性病變主要為壞死性肉芽腫及滲出改變,如浸潤性肺結核、干酪性肺炎、空洞性肺結核等。(2)支氣管鏡下活檢標本,或經皮肺穿刺活檢的組織標本,若病變為壞死性肉芽腫性炎,或見病變旁肺組織滲出性改變,提示活動性肺結核;如僅為壞死、少許肉芽腫病變,同時纖維組織增生變性及伴鈣鹽沉積時,則判斷為活動性較困難,需結合臨床、影像及其他病理檢查結果進行綜合判斷。(3)在病變組織內找到抗酸桿菌,且細菌的數量較多,TB-DNA含量增高提示活動性肺結核。
肺結核活動性的臨床綜合評價
病原學陽性是肺結核活動性判斷的金標準。對于痰病原學陰性的患者,推薦采用BALF進行結核分枝桿菌培養,必要時進行肺活檢,盡可能獲得病原學證據。在進行臨床綜合評價前,需要結合詳細的臨床表現、影像學及實驗室檢查資料,還需要考慮到免疫學等檢測技術、患者的不典型癥狀對活動性判斷的影響,全面客觀地評價各項指標以爭取做到準確判斷。
一、肺結核治療前的活動性評價
病原學陽性的肺結核患者可直接判斷為活動性。但是對于病原學陰性的患者,在進行抗結核藥物治療前的活動性評價需要綜合影像學、臨床和實驗室等方面進行判斷。如經過影像學、臨床癥狀和實驗室評價仍不能明確活動性者,推薦使用支氣管鏡下肺活檢、BALF、分子生物學檢測獲得病理學和病原學診斷依據,進行精準的活動性判斷。如仍不能明確,可以采用經驗性抗結核藥物治療(一般2個月療程),通過觀察療效來評價活動性。如影像學判斷為“穩定”,又無支持活動性的臨床癥狀及實驗室證據,推薦對患者進行隨訪觀察。活動性判斷的臨床決策應由結核科診療小組最終做出,其成員由3名以上醫師組成,其中應包括結核科/呼吸科、檢驗科和影像科醫生。病原學陰性肺結核治療前活動性臨床綜合評價流程見圖1。
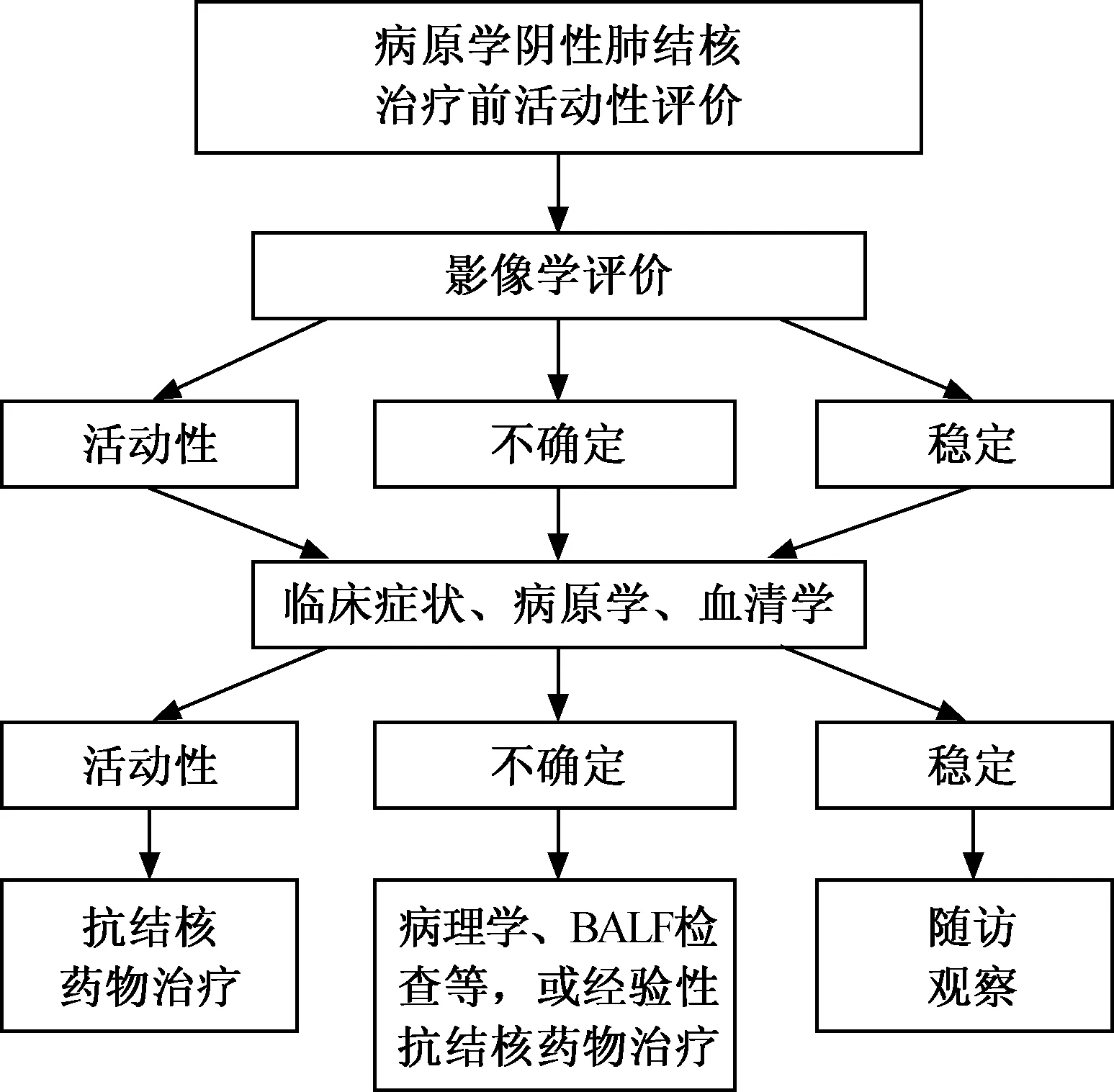
圖1 病原學陰性肺結核治療前活動性臨床綜合評價流程
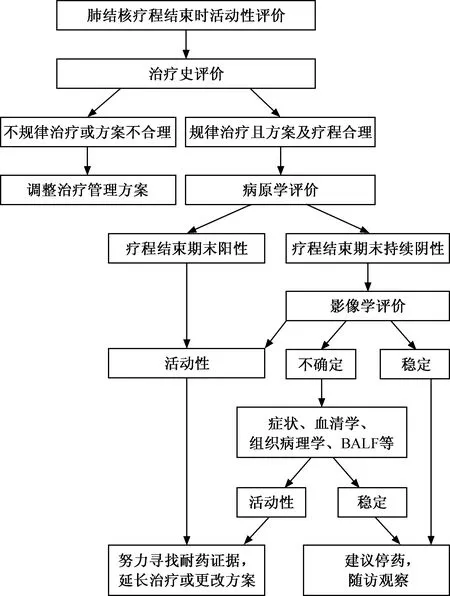
圖2 肺結核療程結束時活動性判斷的臨床綜合評價流程
二、肺結核患者療程結束時的活動性評價
療程結束時肺結核的活動性評價原則與治療前評價不盡相同,推薦優先進行治療史和病原學評價,而影像學評價的重點應放在趨勢變化上。對于病原學陰性、規律治療、影像學呈持續吸收好轉的患者,一些活動性征象的殘留并不代表患者需要繼續治療[44]。對于影像學活動性不確定的患者,需要結合臨床進行評價:(1)借助肺活檢、BALF獲得活動性的證據;(2)對患者的藥物敏感性試驗結果、服藥規則性、方案合理性、基礎疾病做出評價。如排除各項不利因素,且臨床評價和影像學判斷一致時,可給予終止治療、定期隨訪;如臨床評價和影像學判斷互相矛盾時,應盡可能獲得新的證據[45]。具體流程見圖2。
展 望
肺結核活動性判斷是臨床醫療實踐中的熱點難點問題,本《共識》為其提供了基本原則和方向,未來尚有許多問題有待解決,包括:(1)研發高效的生物標志物應用于肺結核活動性判斷,不斷提升肺結核活動性判斷的準確度;(2)開展針對肺結核患者亞臨床及自限狀態化療方案的隨機對照研究,建立科學的活動性判斷技術體系和用藥原則;(3)肺結核患者的并發癥、殘留損壞和結構性肺病也不容忽視,其不僅影響肺結核活動性的判斷,還降低了患者的生存質量,甚至可能威脅其生命安全[40]。
肺結核治療后的并發癥主要包括:(1)實質并發癥,主要為殘存空洞內曲霉菌球,肺結核瘢痕癌或與原發肺癌共存;(2)氣道并發癥,主要表現為支氣管擴張、支氣管結石、繼發性淀粉樣變、肺氣腫等;(3)血管并發癥,主要有肺動脈高壓、與肺結核相關的肺血栓栓塞癥、Rassmussen動脈瘤或支氣管擴張引起的咯血;(4)胸腔并發癥,包括慢性膿胸、膿胸相關腫瘤、支氣管-胸膜瘺、氣胸等;(5)縱隔并發癥,主要有縱隔纖維化、縮窄性心包炎等[11, 46-47]。
上述問題在肺結核活動性判斷中需要同時進行臨床評估,需要建立整合醫學模式、制定精準治療計劃,以保障患者的生活質量。
執筆人鄧國防(518112 深圳市第三人民醫院);路希維(116033 大連市結核病醫院)
參加討論與撰寫本共識的主要單位和專家(排名不分先后):福建省福州肺科醫院結核科(陳曉紅);首都醫科大學附屬北京胸科醫院(陳效友、初乃惠、黃海榮、張海青、周新華);深圳市第三人民醫院(劉磊、王召欽、鄧國防、付亮、王立非);太原市第四人民醫院結核科(段慧萍);同濟大學附屬上海市肺科醫院結核科(范琳);大連市結核病醫院(路希維);北京,解放軍總醫院第八醫學中心 全軍結核病防治研究所(王仲元);哈爾濱市胸科醫院結核科(王蓮芝);大連大學附屬中山醫院(伍建林);廣州,廣東省結核病控制中心(溫文沛、吳惠忠、陳瑜暉、陳亮);《中國防癆雜志》期刊社(薛愛華);首都醫科大學附屬北京地壇醫院影像科(謝汝明);南京市第二醫院(張俠、曾誼);大連醫科大學附屬第一醫院影像科(李智勇);武漢市肺科醫院影像科(余輝山)
利益沖突:無利益沖突。
志謝蘭州大學循證醫學中心/GRADE中國中心陳耀龍課題組對本共識提出了寶貴意見和建議。

