紫杉醇脂質體聯合鉑類治療晚期食管癌療效與安全性系統評價*
王亞露,江潔美,方 玲,許杜娟,△
(1.安徽醫科大學藥學院,安徽 合肥230032;2.安徽醫科大學第一附屬醫院藥劑科,安徽 合肥230022)
食管癌患者預后通常較差,確診時多數已為局部不可切除或有遠處轉移,故多采用姑息性化學治療(簡稱化療)[1]。紫杉醇為抗微管藥物,可破壞微管和微管蛋白二聚體間存在的動態平衡,誘導和促進微管蛋白裝配微管,防止解聚,抑制細胞有絲分裂,使細胞阻滯于M期,從而發揮抗腫瘤作用[2]。以紫杉醇為基礎的聯合化療方案治療食管癌已被多項臨床試驗證實具有一定療效[3-7],且在2019年食管癌和食管胃交界癌美國國立綜合癌癥網絡(NCCN)臨床實踐指南和2018年版國家衛生健康委員會食管癌診療規范中均推薦紫杉醇和鉑類的聯合方案作為食管癌輔助化療、同步放化療及晚期化療的主要治療方案。由于紫杉醇幾乎不溶于水,故加入聚氧乙烯蓖麻油提高紫杉醇的溶解度,但聚氧乙烯蓖麻油在體內降解時會引起嚴重過敏反應、腎毒性、神經毒性等不良反應。紫杉醇脂質體作為一種紫杉醇藥物的新劑型,通過藥物與脂質體在膜雙層內的結合,提高了紫杉醇疏水分子的溶解度和體內的穩定性,避免了聚氧乙烯蓖麻油的毒副作用[8]。目前,已有文獻在卵巢癌、乳腺癌、非小細胞肺癌及胃癌的治療中將紫杉醇脂質體與普通紫杉醇進行療效和安全性對比的Meta分析[9-16],但在治療食管癌方面僅有隨機對照試驗(RCT)或單臂臨床試驗,有效性和安全性尚不確切。本研究中系統檢索了相關文獻,對紫杉醇脂質體治療食管癌療效與安全性的單臂試驗及RCT進行了系統評價,為臨床治療提供參考。現報道如下。
1 資料與方法
1.1 文獻納入標準與排除標準
納入標準:經臨床內窺鏡,細胞學、影像學等檢查確診為晚期食管癌;研究類型為采用紫杉醇脂質體聯合鉑類方案治療晚期食管癌的臨床試驗,包含與普通紫杉醇對比的RCT;RCT中研究組干預措施為紫杉醇聯合鉑類化療方案(包括順鉑、奈達鉑、奧沙利鉑),對照組干預措施為普通紫杉醇聯合鉑類化療方案,兩組患者的其他基礎治療相同;單臂試驗與RCT研究組化療方案相同;化療時間為2個周期以上,21~28d為1個周期。
排除標準:缺失療效和不良反應評價指標數據;重復發表;個案、綜述、摘要及會議報告等;回顧性觀察。
1.2 結局指標
本研究的療效評價指標為客觀緩解率(ORR),按世界衛生組織(WHO)或實體瘤的療效評價標準(RECIST)制訂的標準,ORR為完全緩解(CR)和部分緩解(PR)的病例數占總病例數的百分比。安全性評價指標為不良反應發生率,按常見不良事件評價標準(CTCAE 5.0版),不良事件的嚴重程度分為0~Ⅳ級,不良反應發生率=[(Ⅰ+Ⅱ+Ⅲ+Ⅳ)/總病例數]×100%。
1.3 文獻檢索策略
利用計算機檢索數據庫PubMed,Embase,Cochrane Library,WebofScience以及中國期刊全文數據庫(CNKI)、中文科技期刊數據庫(VIP)、萬方數據庫(WanFang Data),并輔以手工檢索原文中的相關參考文獻。檢索時間為自建庫至2019年7月。中文檢索關鍵詞:“紫杉醇”“泰素”“奧素”“普通紫杉醇”“紫杉醇脂質體”“力撲素”“注射用紫杉醇脂質體”“食管癌”“食管腫瘤”;英文檢索關鍵詞:paclitaxel OR taxol OR traditional paclitaxel and liposomal paclitaxel OR paclitaxel liposome OR lipusu and esophageal neoplasms OR esophageal cancer OR esophageal carcinoma。不限制發表語言、發表時間等。
1.4 文獻篩選及資料提取
依據納入與排除標準,由2位研究員獨立完成文獻篩選、數據提取,且進行交叉核對,若產生分歧則由第三位研究員進行裁定。提取資料的數據內容包括第一作者,發表時期,發表類型,患者特征(人數、年齡、疾病分期等),干預措施與化療方法,化療療程,結局指標數據。
1.5 文獻質量評價
2位研究員根據Cochrane系統評價手冊5.1.0版[17],對最終納入的RCT獨立進行質量評價,若產生分歧則由第三位研究員進行裁定。根據偏倚類型包括選擇偏倚:隨機序列的產生、分配隱藏;實施偏倚:實施者與參與者雙盲;測量偏倚:結局評估盲法;失訪偏倚:結局數據不全;發表偏倚:選擇性報告;其他來源偏倚。按照“低風險”“不清楚”“高風險”進行選擇回答。
1.6 統計學處理
納入的RCT采用Cochrane協作網提供的RevMan 5.3軟件進行Meta分析,其中分類資料使用比值比(OR)或風險比(RR)和95%可信區間(CI)進行分析。各納入研究結果間的異質性采用I2檢驗進行分析。若P>0.1,I2<50%,說明各研究間有統計學同質性,即采用固定效應模型進行Meta分析;若P<0.1,I2>50%,說明各研究間存在異質性,隨即分析異質性來源,采用隨機效應模型進行Meta分析,若異質性過大,則進行描述性分析。單臂試驗研究中的分類變量由StataSE 11.0軟件進行效應量合并。
2 結果
2.1 文獻檢索結果及納入文獻基本特征
首次檢索文獻172篇,經去重,最終共納入13篇研究,文獻納入及排除過程見圖1。其中單臂試驗研究7篇[18-24],RCT研究6篇[25-30],包括713例患者。所有研究均報道了療效與安全性,均在治療2周期后進行療效評價。納入的單臂試驗中紫杉醇脂質體應用劑量均為135 mg/m2。詳見表1。

圖1 文獻篩選流程及結果

表1 納入研究的基本特征
2.2 納入文獻的質量評價
對納入的6篇RCT進行質量評價。6篇RCT均描述為隨機分組,1個研究[26]運用“分層隨機分組法”,評價為“低風險”,2個研究[27,30]按“入院先后分組”,評價為“高風險”,其余3個研究[25,28-29]未描述具體的隨機方法,評價為“不清楚”。所有研究均未描述分配隱藏,盲法,評價為“不清楚”。所有研究報告的數據均完整且沒有選擇性報告的結果,評價為“低風險”。詳見圖2。
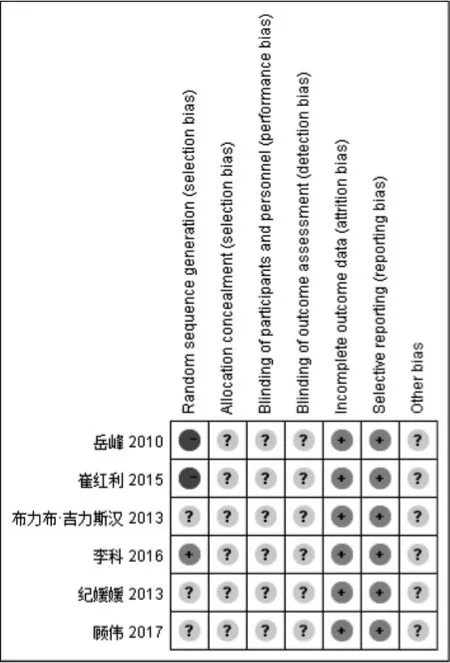
圖2 納入文獻的偏倚風險圖
2.3Meta分析結果
單臂試驗的合并ORR:納入了7篇紫杉醇脂質體的單臂試驗研究[18-24],共273例患者,均報道了ORR,應用StataSE 11.0軟件進行ORR的合并,計算合并ORR并繪制森林圖,見圖3。結果顯示,ORR為46%,95%CI(0.40,0.52)。
RCT的ORR:納入了6篇紫杉醇脂質體聯合鉑類與紫杉醇聯合鉑類治療晚期食管癌的的RCT[27-32],均報道了ORR,患者440例。通過異質性檢驗,各研究同質性較好(P=0.81,I2=0%),故采用固定效應模型分析。結果顯示,兩組ORR比較,差異無統計學意義[RR=1.08,95%CI(0.87,1.35),P=0.50]。詳見圖4。
不良反應發生率:比較6個RCT中的不良反應發生率,出現的不良反應包括骨髓抑制、白細胞減少、血小板下降、血紅蛋白減少、疲乏、呼吸困難、肌肉痛、皮膚潮紅、消化道癥狀、脫發、惡心嘔吐、心電圖變化、肝功能損傷、腎功能損傷、周圍神經炎、皮疹、腹瀉及口腔黏膜炎。將至少2篇以上均報道的不良反應進行Meta分析,詳見表2,由于各組同質性較好,均采用固定效應模型分析。其中紫杉醇脂質體呼吸困難、肌肉痛、惡心嘔吐、皮膚潮紅的發生率均低于紫杉醇組,差異有統計學意義(P<0.05)。詳見圖5。

圖3 單臂試驗的合并客觀緩解率Meta分析森林圖
2.4 發表偏倚分析
基于客觀緩解率的結果采用倒漏斗圖進行發表偏倚分析。結果6個研究全部位于95%CI內,且基本呈對稱分布,表明納入的研究間不存在明顯的發表偏倚。詳見圖6。

圖4 兩組ORR比較Meta分析森林圖
3 討論
本研究中納入了紫杉醇脂質體治療晚期食管癌的單臂試驗,并通過合并客觀有效率,結果顯示,紫杉醇脂質體聯合鉑類治療晚期食管癌有效率可達46%。與CAO等[31]報道的紫杉醇聯合奈達鉑在食管癌的一線治療中所得的ORR=41.7%,95%CI(27.8,55.7%),與GONG等[32]報道的ORR=43.6%相近。故紫杉醇脂質體聯合鉑類治療晚期食管癌療效較好。
同時,將納入的RCT進行Meta分析,在療效方面通過ORR評價,結果顯示,兩組的ORR無顯著差異(P=0.50),即紫杉醇脂質體聯合鉑類與紫杉醇聯合鉑類治療晚期食管癌的療效相當。紫杉醇脂質體和紫杉醇治療卵巢癌、乳腺癌、晚期非小細胞肺癌的有效性比較無顯著差異[9-10,12],療效相當。但唐慕菲等[11]報道,在治療卵巢癌的有效性上,兩組有統計學差異(P=0.02),紫杉醇脂質體的療效優于紫杉醇。以上分析結果不同的原因還需進一步臨床試驗去探討。

圖5 兩組不良反應發生率比較Meta分析森林圖

表2 兩組不良反應發生率Meta分析結果

圖6 客觀緩解率倒漏斗圖
在安全性方面,通過對兩組不良反應發生率進行Meta分析,其中紫杉醇脂質體聯合鉑類較紫杉醇聯合鉑類在呼吸困難、肌肉痛、惡心嘔吐、皮膚潮紅的發生率低(P<0.05)。過敏反應是紫杉醇注射液的主要不良反應,通常是由于紫杉醇注射液中的聚氧乙烯蓖麻油所引起,主要表現為局部或全身性潮紅、呼吸困難、胸背部疼痛及常伴有惡心嘔吐等消化道癥狀[33]。本研究結果顯示,這幾種不良反應,紫杉醇脂質體的發生率均低于紫杉醇,表明紫杉醇脂質體在一定程度上可降低過敏反應的發生率。過敏反應的出現,往往限制了繼續用藥,間接影響療效。故通過劑型的改變,一定程度上可增加紫杉醇的用藥機會和安全性,提高治療效果,改善預后。
綜上所述,紫杉醇脂質體聯合鉑類治療晚期食管癌臨床有一定獲益率,且部分不良反應發生率明顯較普通紫杉醇低。本研究局限性在于,檢索出的文獻均為中文文獻,可能由于紫杉醇脂質體為我國自主研發藥物,在國外的應用受限。自紫杉醇脂質體上市以來,臨床應用日漸廣泛,在國內藥品市場的占有率有逐漸上升趨勢[34]。由于紫杉醇脂質體的價格遠高于普通紫杉醇,國內仍會進行一些RCT,探索兩者的療效和安全性差異,尋得更新的證據,但較少的樣本量限制了效應量的檢出,故仍需更高質量、更嚴謹、更大樣本的RCT去驗證。

